首页 > 医疗资讯/ 正文
心肌梗死(MI)后的严重全身炎症是导致患者死亡的主要原因。MI诱导的炎症会引发自由基的产生,进而最终导致心脏病变炎症增加(即炎症-自由基循环),导致心力衰竭和患者死亡。然而,目前可用的抗炎药由于其抗炎作用弱和在心脏部位的积聚差而疗效有限。
在本研究中,上海交通大学杨宇教授/吴连明和苏州大学刘庄教授等人开发了新型的Fe-Cur@TA纳米酶用于靶向治疗MI,其通过将Fe3+和抗炎药姜黄素(Cur)与单宁酸(TA)的修饰配位而产生。Fe-Cur@TA纳米酶通过减少免疫细胞浸润、促进巨噬细胞向M2样表型极化、抑制炎症细胞因子分泌和阻断炎症自由基循环,表现出优异的清除自由基和抗炎特性。在小鼠和临床前比格犬MI模型中,Fe-Cur@TA纳米酶保留了心脏功能并减少了疤痕的大小,这表明其在心血管疾病的临床转化方面具有很好的潜力。
相关工作以“A Cardiac-Targeted Nanozyme Interrupts the Inflammation-Free Radical Cycle in Myocardial Infarction”为题发表在Advanced Materials。

【文章要点】
如图1所示,本研究合成了一种新型的药物基金属纳米酶Fe-Cur@TA。具体而言,作者利用Fe3+与抗炎药姜黄素(Cur)之间的强配位作用制备了纳米酶,并进一步利用单宁酸(TA)修饰该纳米酶。该纳米酶可通过抗炎和抗氧化活性的协同作用,靶向治疗心肌梗死。
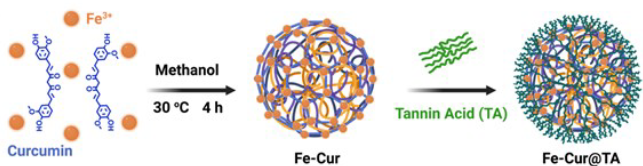
图1 Fe-Cur@TA纳米酶的制备
机制研究表明,Fe-Cur纳米酶具有优异的清除自由基和抗炎能力,有效阻断了炎症自由基的恶性循环。这可导致心脏中急性免疫细胞聚集减少,M2巨噬细胞极化诱导,MI后炎性细胞因子分泌减少。
值得注意的是,TA对心脏弹性蛋白和胶原的高亲和力促进了Fe-Cur@TA在心脏组织中的滞留,与Fe-Cur纳米酶相比,Fe-Cur@TA的保留率可增加近10倍。在心肌梗死的小鼠和临床前比格犬模型中,Fe-Cur@TA显示出有效的心脏保护、改善心脏功能和减轻不良重塑。该研究有望为心肌梗死治疗的临床可行性和改进提供坚实的基础。而使用Fe-Cur@TA纳米酶通过提供对抗炎症和氧化应激的靶向方法,有望彻底改变MI的治疗。
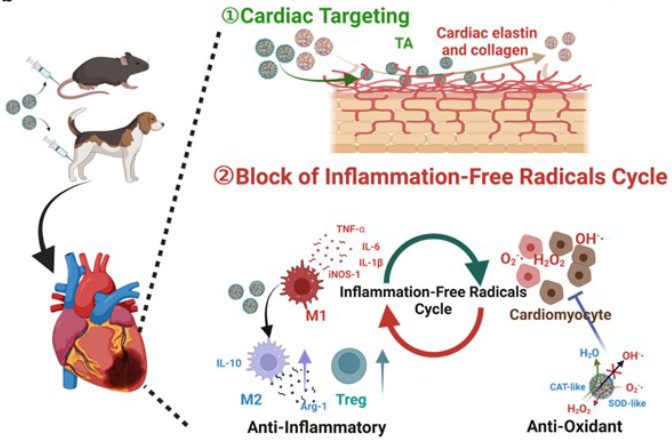
图2 心肌梗死治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202308477.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)