首页 > 医疗资讯/ 正文
CAR T细胞疗法已成为B细胞恶性肿瘤患者的一种强大治疗选择,但神经系统不良反应在一定程度上阻碍了CAR T的成功。免疫效应细胞相关神经毒性综合征(ICANS)包括一系列急性神经系统不良反应,例如脑病以及认知和行为、语言、运动功能和协调能力的改变。在接受CAR T细胞治疗中枢神经系统恶性肿瘤的患者中,还可能会急性出现一种更局部的肿瘤炎症相关神经毒性综合征,即肿瘤炎症相关神经毒性(TIAN),可导致局部水肿产生占位效应,或出现电生理功能障碍并伴有神经系统症状。此外对于BCMA CAR T细胞治疗,人们越来越认识到还可能发生一些迟发性神经系统并发症,包括颅神经麻痹和独特的迟发性帕金森综合征。
神经系统并发症的管理包括对症治疗(抗癫痫药物或脑脊液引流等)、使用皮质类固醇进行临时免疫抑制、各种细胞因子靶向药物以及其他根据毒性性质的不同而采用的特定方法。随着对CAR T各种神经系统不良反应的机制的理解不断增加,对神经系统症状的临床表型和病理生理学的理解也得到极大改善,新的治疗策略有望缓解症状,此外创新的CAR设计也有望提高其安全性和减少神经毒性。
《Nature Reviews Neurology》近日发表综述,概述了关于CAR T细胞治疗后出现的神经系统毒性的分子和细胞机制,强调了以症状为中心的治疗策略、新兴的以机制为导向的预防或减轻毒性的干预措施,以及正在进行的针对中枢神经系统毒性的治疗临床试验。

免疫效应细胞相关神经毒性综合征
临床表现
CAR T细胞疗法对大脑最显著的典型不良反应为ICANS,而较罕见的反应则称为非ICANS神经毒性。轻度至中度ICANS病例的特征性症状通常反映为急性发作的中毒性脑病,包括注意力受损、定向障碍、行为改变、震颤、精细运动技能受损和表达性失语。症状通常在CAR T细胞输注后10天内出现(图1)。严重病例可能观察到意识水平下降,可能需要插管以提供呼吸支持,并且可能发生危及生命的弥漫性脑水肿。
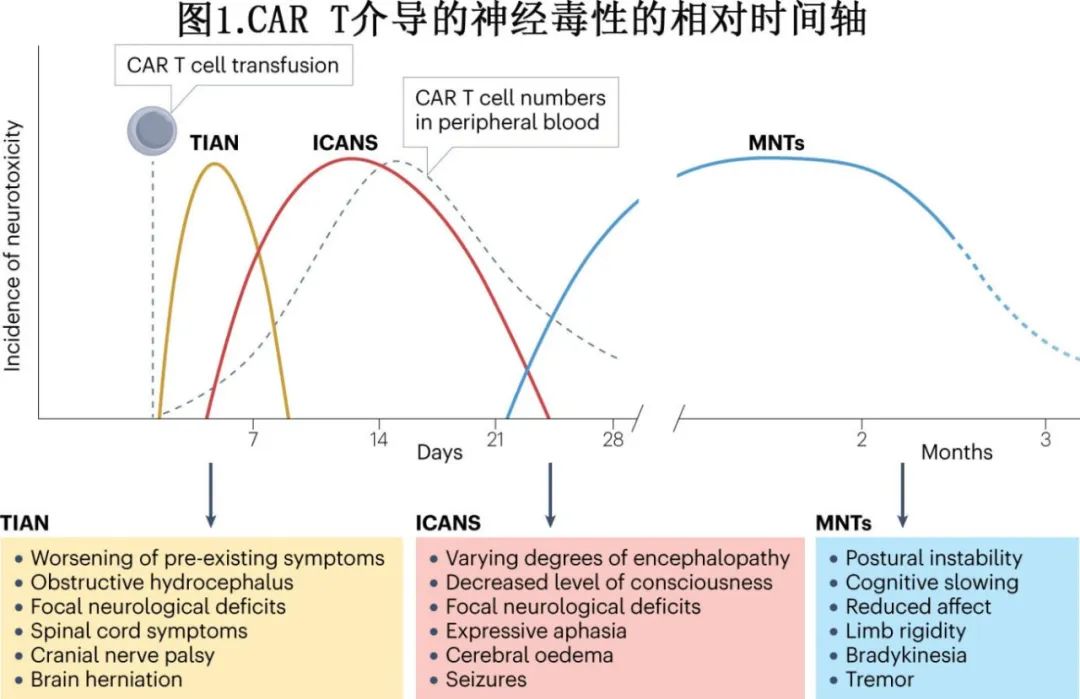
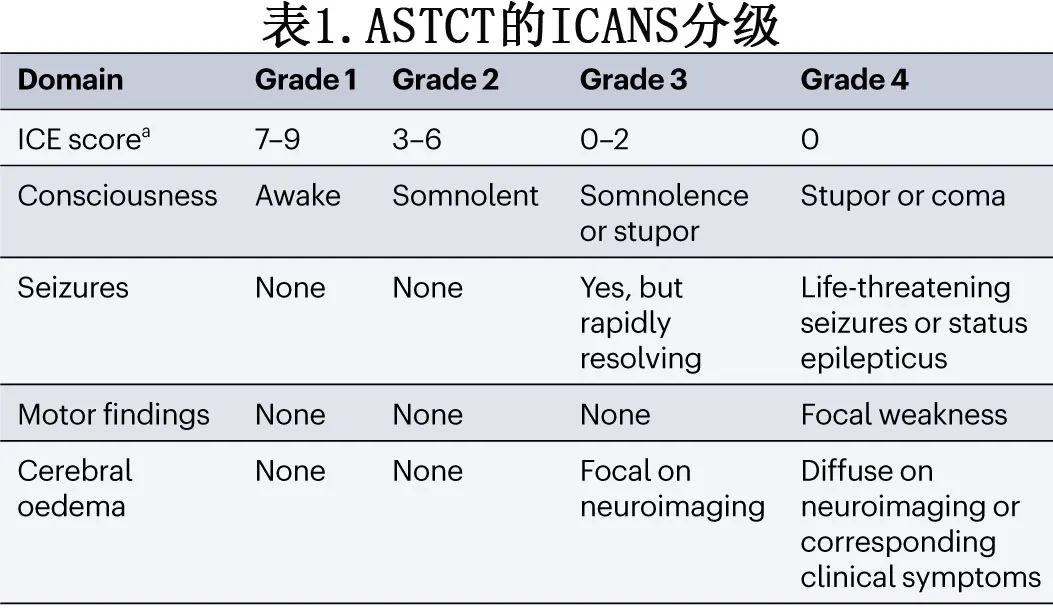
遵循美国移植与细胞治疗学会(ASTCT)发布的指南,根据对注意力、遵循命令的能力、命名、定向和书写能力的临床评估,可对症状进行分级并用于纵向评估毒性。ASTCT的四层分类系统使用10分免疫效应细胞相关脑病(ICE)评分,可提供标准化的术语来区分轻度(1级:7-9分)、中度(2级:3-6分)、重度(3级:0-2分)和极重度脑病症状(4级:0分,患者无法唤醒)(表1)。用于分级ICANS的其他制备包括意识水平、癫痫发作的存在和类型、运动缺陷,以及基于影像学或临床的脑水肿结果。发热和其他典型的CRS症状通常先于并伴随ICANS出现。
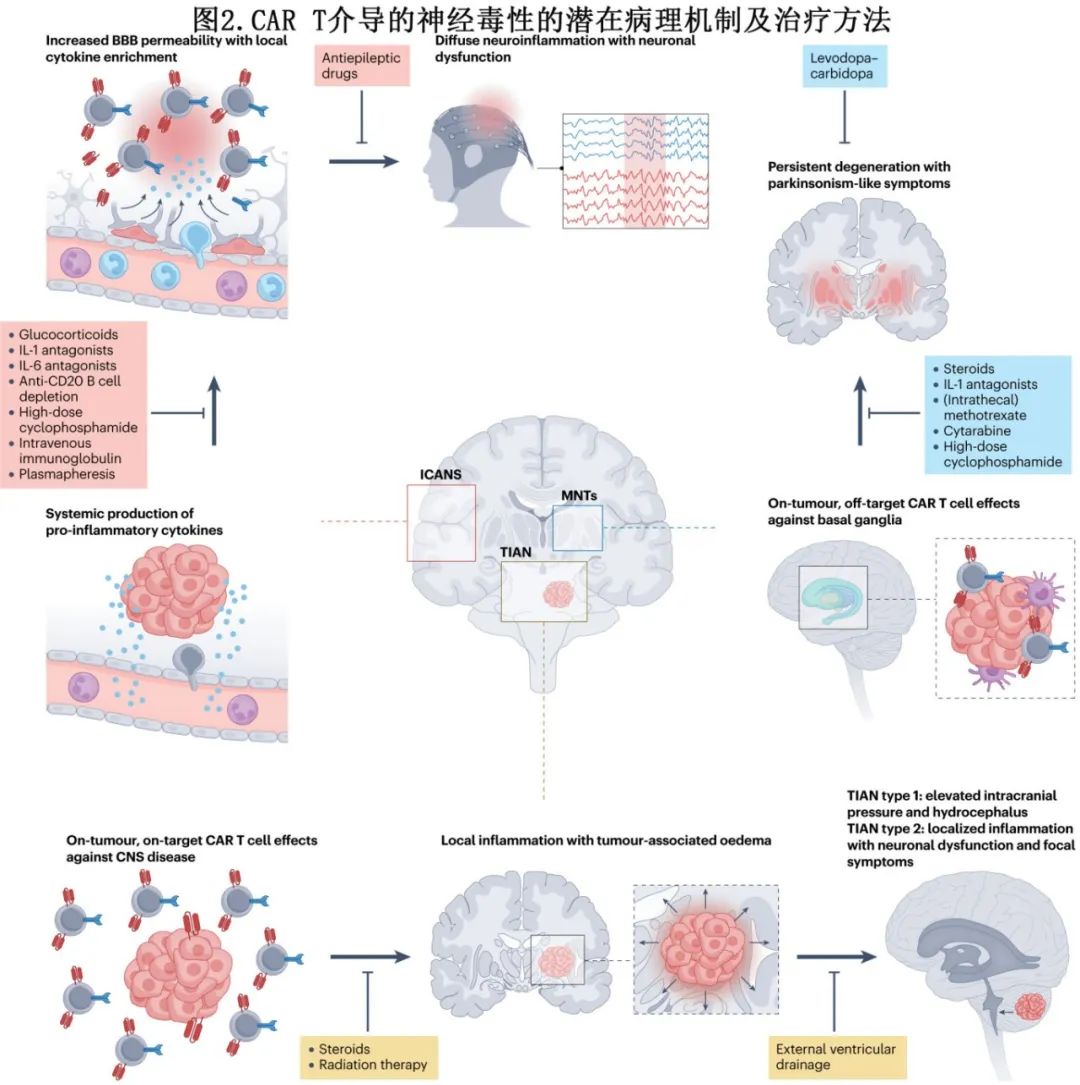
鉴于ICANS已在接受针对多种不同抗原的CAR T细胞治疗的患者中观察到,包括B细胞抗原CD19、CD22和BCMA,以及非B细胞抗原,其潜在的病理机制可能与靶抗原无关(图2)。ICANS的发生频率和严重程度似乎取决于CAR T细胞输注后T细胞的扩增动力学,与CAR共刺激域密切相关。例如,含有4-1BB的CAR倾向于产生较慢的T细胞动力学,并且与含有CD28的CAR相比,ICANS的发生率较低,严重程度也有所降低。
大多数专业中心采用策略来识别特别容易患ICANS的患者,并且通常使用与较低ICANS率相关的商业化CAR T细胞产品来治疗这些高风险患者。随着这一过程,以及内部管理和监测指南的实施,ICANS的当前发生频率似乎低至35%至80%,而系统性B细胞恶性肿瘤最初临床试验中约为70%。尽管如此,自2017年第一个商业化CD19 CAR T细胞产品tisagenlecleucel获得FDA批准以来,合理假设已有数千例ICANS患者接受治疗。
病理机制
ICANS可反映超生理性的免疫反应,其发生与靶抗原无关,并且几乎总是伴随着某种程度的CRS(图2)。该假设进一步得到了以下观察的支持:中枢神经系统(CNS)内靶抗原的存在可能不是ICANS的关键驱动因素,因为患有原发性或继发性CNS淋巴瘤的患者与患有系统性淋巴瘤但无CNS疾病的患者相比,神经毒性发生率相似甚至更低。在经历ICANS的患者中检测到高水平的循环细胞因子,其中白细胞介素-1(IL-1)、IL-6、IL-15和粒细胞-巨噬细胞集落刺激因子被认为可能是神经毒性症状的潜在介质。这些细胞因子通常由增殖的T细胞或单核细胞-巨噬细胞系的细胞释放,作为调节CNS对病毒感染或自身免疫反应的调节因子,并促进神经炎症。
鉴于CAR T细胞在与肿瘤细胞和其他肿瘤微环境细胞接触时会产生这些细胞因子,治疗前疾病负担已确定为ICANS的风险因素。IL-1和IL-6也与内皮细胞激活有关,无论是全身性的还是与血脑屏障(BBB)相关的微血管,因此,BBB的通透性增加以及这些循环细胞因子被动流入CNS也是合理机制。此外,单细胞RNA测序和染色已识别出围绕整个人类大脑BBB内皮的CD19阳性脑壁细胞。此外,死于高级别ICANS的患者的尸检报告显示,在MRI显示受影响的大脑区域的血管周围空间内有T细胞(可能是CAR T细胞)浸润。这些发现共同表明,CD19 CAR T细胞的on-target off-tumour效应促进BBB的渗漏和ICANS中的脑水肿。
值得注意的是,之前对患有B细胞白血病的患者在输注CD19 CAR T细胞后出现ICANS的脑脊液(CSF)和血清样本的研究,揭示了CSF特异性的IL-6、IL-8、IP10和MCP1水平升高,这不仅指向被动细胞因子流入,还指向这些细胞因子由驻留脑细胞(如小胶质细胞)的局部产生。这种局部产生可能通过受损的BBB进入CNS空间的CAR T细胞来促进。尽管单一细胞因子水平的增加似乎不太可能转化为临床上相关的症状,但临床前研究表明,特定的细胞因子确实介导了不同的CAR T细胞诱导的不良反应。使用白血病的人源化小鼠模型,Norelli及其同事发现,在表现出类似CRS症状的小鼠中,IL-6水平升高,而IL-6受体拮抗剂托珠单抗可成功预防这些症状的出现。与之相反,IL-1受体拮抗剂anakinra(而非托珠单抗)可改善受影响小鼠的神经系统症状。值得注意的是,在患有自身免疫性疾病(如系统性红斑狼疮或炎症性肌病)的患者中,使用CD19 CAR T细胞仅发生轻度神经毒性症状,可能是由于与肿瘤患者不同的细胞因子动态。
CNS特异性的细胞因子水平升高可能转化为弥漫性神经炎症,该观点得到了在ICANS患者大脑中通过转位蛋白(TSPO)PET观察到小胶质细胞激活的支持。临床前研究还发现,在抑制小胶质细胞激活途径的组成部分TAK1后,小鼠的神经认知得到改善。神经炎症诱导神经轴索损伤,可通过血清中神经丝轻链(NfL)生物标志物水平与ICANS严重程度之间的显著相关性以及最终的神经元去同步化来表明。重要的是,神经元去同步化(而非任何持续的结构性损伤)可能是临床症状的关键原因,因为在2年的随访后,未在无病的ICANS幸存者中检测到迟发性主观神经认知问题。
通过脑电图(EEG)监测时,ICANS患者通常表现出与脑病一致的弥漫性背景减缓,而有局灶性缺陷的患者经常在没有结构性病变的情况下,在发作-发作间期连续体上显示出局灶性异常。在语言产生或语言识别中起作用的主导半球的功能区域似乎特别容易在ICANS期间受到损伤,使用静息态功能磁共振成像的研究检测到在Broca区(额下回和额叶操作区)和Wernicke区(颞上回后部和颞顶联合区)的高度功能连接障碍。在少数症状最严重的病例中,可遇到弥漫性幕上和幕下脑水肿以及脑实质内出血。在接受CAR T细胞治疗后出现神经毒性的患者中,估计致命的神经毒性发生率不到5%。
肿瘤炎症相关神经毒性
临床表现
2023年,Mahdi及其同事报告了CAR T细胞过继免疫疗法以及其他免疫疗法(如免疫检查点抑制剂、抗体疗法、细胞因子或癌症疫苗)治疗脑或脊髓肿瘤时由局部神经毒性引起的一系列症状。这种综合征称为肿瘤炎症相关神经毒性(TIAN),可分为两种临床表型,两者也可能同时发生(图2)。
TIAN 1型由肿瘤部位的炎症性水肿引起,导致与占位效应相关的症状,如脑疝综合征和梗阻性脑积水。在TIAN 2型中,局部炎症会导致电生理功能障碍,从而加重(通常是预先存在的)神经系统症状。即使在没有水肿的情况下,也可能存在局部的神经-免疫相互作用。可以应用一个五级分级量表来描述TIAN的严重程度,从轻度缺陷(1级)到危及生命的症状(4级)以及因TIAN导致的死亡(5级)。TIAN的定义相当广泛,涵盖以前被分类为胶质瘤患者中的假性进展的症状。因此,似乎有理由认为,最初被解释为CAR T细胞治疗后性脑放射性坏死的病例(且与过继免疫疗法无关),现在可以重新归类为TIAN。与ICANS不同,TIAN表现为特定肿瘤部位的区域性现象,而非以意识改变为特征的整体大脑功能障碍。
鉴于TIAN只是最近才被概念化,而且CAR T细胞治疗CNS疾病仍处于起步阶段,来自真实世界或临床试验队列的临床观察仍然有限。在一项针对儿童H3K27突变弥漫性中线胶质瘤(或其他表达GD2的CNS肿瘤)的系统给药的GD2 CAR T细胞的I期试验中,CAR T细胞表达一个组成性激活的IL-7受体,八名患者中有七名出现基线神经功能缺陷的轻度加重,解释为1级TIAN。在接受IL-1抗体anakinra治疗后,所有与TIAN相关的症状在7天内都得到缓解,基线神经症状得到改善,持续时间从2个月到超过12个月不等。
在Monje及其同事进行的另一项II期试验中,儿童H3K27突变弥漫性中线胶质瘤患者接受靶向GD2的CAR T细胞治疗,最初是系统性给药,如果在第一次系统输注后观察到临床或影像学获益,则随后进行脑室内给药。在11名入组的患者中,有9名接受了脑室内CAR T细胞输注,都在一定程度上出现了TIAN,但随着后续输注,TIAN有所减轻。报告了2例4级TIAN和3例3级TIAN;然而随着时间的推移,在密切监测、使用anakinra和管理梗阻性脑积水的情况下,所有神经系统不良反应都得到缓解。尽管TIAN患者的治疗经验仍然有限,但这两项I期试验表明,TIAN将经常遇到,并且需要视为CNS患者治疗中的一个重要神经毒性。
病理机制
由于TIAN主要局限于特定的肿瘤部位,其发病机制为肿瘤部位的on-tumour on-target毒性。CAR T细胞跨越血脑屏障的浸润引起的局部炎症可通过磁共振成像(MRI)和正电子发射断层扫描(PET)可视化,其特征是T2加权液体衰减反转恢复(T2-FLAIR)高信号增强,伴随着对比增强肿瘤结节及其代谢活动的消退。当CAR T细胞对肿瘤细胞发挥杀伤活性时,会释放细胞因子,尽管导致TIAN的确切细胞因子仍有待阐明。神经元、星形胶质细胞和神经血管细胞表达细胞因子受体共同影响神经回路的功能。细胞因子、生理大脑功能和大脑肿瘤生长之间的相互作用促成了癌症神经科学领域的发展,该领域强调了神经信号分子对免疫系统功能的相关性。例如,神经递质GABA由B淋巴细胞合成,通过激活抗炎性巨噬细胞和抑制杀伤性T细胞功能来降低免疫系统的抗肿瘤反应。此外,局部细胞因子水平的升高可能有助于BBB的通透性增加,进而导致局部水肿。
BCMA CAR T后的毒性
运动障碍和神经认知不良事件
临床表现:在多发性骨髓瘤患者中,关键Ib/II期CARTITUDE-1研究确定BCMA可作为临床上有价值的CAR T细胞。该研究中令人鼓舞的骨髓瘤缓解率促使了商业产品ciltacabtagene autoleucel的获批,但研究人群中约5%的患者,即5名患者,出现亚急性至晚发性运动障碍,其特征包括肢体僵硬、姿势不稳和震颤导致的运动迟缓;还遇到了神经认知症状,表现为情感迟钝。随着ciltacabtagene autoleucel的更广泛使用,还出现了类似帕金森病的患者报告,且在接受另一种商业化的BCMA CAR T细胞产品idecabtagene vicleucel输注后,也观察到迟发性帕金森病样症状,这表明这些症状可归因于BCMA靶向活性,而非特定产品的特性。
病理机制:转录组学研究表明,至少到青年时期,BCMA在人类纹状体中有表达,而纹状体接收来自黑质的多巴胺能神经支配,以协调复杂运动。与CAR T细胞对这些基底神经节细胞的靶向、非肿瘤交叉反应的想法一致,MRI研究揭示了在接受BCMA CAR T细胞治疗后出现帕金森病的患者中,尾状核头部、豆状核和苍白球出现T2-FLAIR高信号。另一项研究显示,在类似受影响患者的脑部,18F-氟脱氧葡萄糖(18F-FDG)PET出现局部低代谢。症状的严重程度可能与循环CAR T细胞的扩增相关,其可能是评估迟发性帕金森病风险的可能生物标志物。然而需要注意的是,帕金森病的迟发性起病不一定反映基底神经节细胞受损的时间;在其他神经损伤情况下,如中风,症状可能在损伤后数月甚至数年才出现。作为BCMA靶向治疗后果的帕金森病在大多数情况下可能是不可逆的,但部分症状缓解的报告仍令人鼓舞。
颅神经病
临床表现:在纳入CARTITUDE-1、CARTITUDE-2和CARTITUDE-4试验的332名接受BCMA CAR T细胞产品的患者中,有21名(6.3%)出现颅神经缺陷。最常见的是面神经受到影响,通常在CAR T细胞输注后大约3周开始出现轻度麻痹。部分患者可通过MRI观察到受累面神经的对比增强。在大多数患者(21名中的19名)中,症状在接受皮质类固醇治疗后大约2个月内完全缓解。在临床试验之外接受BCMA靶向产品的受者中,也有报告单侧或双侧面神经麻痹且预后良好的类似病例。
病理机制:血清分析将BCMA CAR T细胞治疗后的颅神经病变与外周血液中丰富的CAR T细胞扩增联系起来。然而由于文献中这类病例的稀缺性以及缺乏受影响个体的先进成像发现和关于CAR表型及细胞扩增的详细数据,颅神经缺陷的发病机制仍然难以判定。值得注意的是,在靶向CD19治疗后也有报告出现Guillain–Barré样综合征的情况,表现为面神经麻痹和严重的肌肉无力,MRI显示马尾和受累面神经的增强,这些综合征可能与帕金森病和颅神经麻痹有重叠的特征。
较少见的神经系统毒性
在CAR T细胞介导的毒性中,脊髓受累的情况很少被描述,主要表现为白质脑脊髓病、脊髓水肿或脊髓炎。其他罕见的毒性包括持续性姿势性震颤、特发性震颤、在ICANS治疗后使用IL-1抑制剂后出现的新偏头痛,以及各种周围神经病变。迄今为止,这些罕见的毒性仅在CD19 CAR T细胞治疗后遇到,但需要考虑到,商业化BCMA CAR T细胞产品直到2022年才获批,且只有有限数量的患者接受了这些产品的治疗。
在接受CD19或BCMA CAR T细胞治疗的患者中,也可以发生周围神经病变。然而,目前尚不清楚这一发现是否反映以下情况:CAR T细胞能够进入周围神经的直接影响;由循环细胞因子介导的间接毒性,类似于危重病多神经病变的概念;还是仅仅是多线经治患者群体。
风险因素和自然史
ICANS是CAR T细胞治疗后特征最为明确的神经毒性综合征,基于回顾性队列的几种风险模型都提出,基线全身性炎症(例如,最高日常体温、CRP、IL-6或降钙素原)、CRS的发生、年龄较大、疾病更具侵袭性以及疾病负担更广泛都可以作为预测这一状况的因素。包括EASIX评分(乳酸脱氢酶(LDH)×肌酐或血小板计数)、mEASIX评分(LDH×CRP或血小板计数)和sEASIX评分(LDH或血小板计数)在内的各种量化基线内皮功能障碍水平的模型均经过验证为ICANS的预测因子。在这三种风险模型中,根据队列、目标抗原以及在CAR T细胞输注后多少天计算风险评分,报告了不同的预测值以识别ICANS高危患者。然而,mEASIX评分似乎在识别发展为重度ICANS风险增加的个体方面最为准确(曲线下面积73%-82%)。此外,作为基线神经轴索损伤的替代标志物,治疗前高NfL水平与更严重的ICANS相关。在患者等待CAR T细胞治疗时给予的任何桥接治疗均与ICANS的发生或严重程度无关。
有趣的是,CNS疾病的存在(因此导致在BBB内表达目标抗原)本身似乎并不构成ICANS的相关风险因素,因为患有原发性或继发性CNS淋巴瘤的患者与患有非CNS治疗的患者相比,ICANS的频率和严重程度相似甚至更低。相比之下,CNS疾病是TIAN发展的先决条件。目前还不知道局部脑室内CAR T细胞给药是否增加神经毒性的风险,然而以这种方式治疗的患者中有很大一部分发生了某种形式的神经毒性。同样,由于罕见性,尚未确定其他不良反应(如迟发性帕金森病、颅神经或周围神经病变或脊髓炎)发作的可靠预测因素。
对于1级至2级ICANS的患者,预计在中位持续时间5天后可以完全恢复,而对于3级至4级ICANS的患者,则需要数周时间,迄今为止尚未证明有确定性的长期神经认知不良影响。预计TIAN将遵循类似的临床过程。相比之下,迟发性帕金森病样症状倾向于在大多数情况下进展或保持稳定(尽管进行了积极治疗),并且只描述了一例相关症状的逆转。这些发现表明,急性发作的神经毒性可能是完全可逆的,而迟发性发作的毒性可能有不太有利的预后。
诊断
所有CAR T细胞介导的神经毒性都是一种临床诊断,可以归因于最近接受的过继免疫疗法。专门的临床评估会考虑症状的时间过程、个体患者特征(包括是否存在中枢神经系统疾病)以及特定的CAR T细胞产品(可能会指向ICANS、TIAN、帕金森病样症状、神经认知投诉或颅神经或周围神经病变)。初步的怀疑可以通过全面的神经学评估来确认,包括进行眼底检查以检查可能的视神经乳头水肿(作为颅内压增高的迹象),以及在ICANS潜在病例中计算ICE评分。在患有ICANS或TIAN的患者中,神经毒性的发作通常与实验室检测(包括全血细胞计数、化学检测和凝血概况,以及常规炎症标志物)中炎症标志物(如铁蛋白和CRP)的升高有时间上的关联。
MRI神经影像学检查(或者,如果MRI不安全或由于评估时间较长而不现实,尤其是如果患者出现不自主运动,则使用CT)结果可能不具特异性,但可以揭示细微的变化,例如在患有ICANS的患者中胼胝体压部的T2-FLAIR高信号;在患有TIAN的患者中,围绕(通常有对比增强的)CNS肿瘤病变的T2-FLAIR高信号水肿,伴或不伴脑室扩大;在BCMA靶向治疗后出现运动迟缓症状的患者中基底神经节的轻微T2-FLAIR高信号病变;或受影响的周围或颅神经的弥漫性增强。重要的是,影像学检查缺乏这些结果并不能排除CAR T细胞介导的毒性。更先进的神经影像学检查可能会提供额外的诊断信息,例如通过TSPO PET可视化的弥漫性ICANS诱导的神经炎症,或在帕金森病样症状患者中18F-FDG PET显示的局灶性基底神经节低代谢。
其他检查可能包括EEG,以评价癫痫发作活动或确认症状波动或警觉性水平降低患者中的疑似脑病。大约半数ICANS患者显示出弥漫性背景减缓,伴有节律性或周期性模式(通常在发作-发作间期连续体上),伴或不伴局灶性异常。腰椎穿刺可能有助于排除其他感染性或肿瘤性鉴别诊断。但需要注意的是,腰椎穿刺脑脊液引流可能会在弥漫性脑水肿的患者中引发脑疝,并且在有凝血病或严重血小板减少症的患者中存在出血并发症的风险。因此,需要权衡每种诊断方式的潜在风险和获益,并且在严重受影响的患者中,合理的做法可能是开始经验性治疗,而非追求所有可能的诊断检查。
在患有疑似CAR T细胞相关神经毒性的患者中,可以根据临床特征考虑各种鉴别诊断。在患有脑病或神经认知症状的患者中,应仔细审查药物和实验室检查(可能伴随脑电图检查),以排除药物不良反应、代谢和内分泌异常、感染(特别是JC病毒、人类疱疹病毒6型和巨细胞病毒)、癫痫发作或精神病因。对于缓慢进展的神经认知和视觉空间功能障碍患者,应考虑由先前的氟达拉滨细胞毒性化疗引起的迟发性白质脑病综合征。对于提示中枢神经系统疾病的快速神经学恶化的患者,还应排除其他条件,包括缺血、脑实质内出血、实体或软脑膜肿瘤进展、梗阻性脑积水和感染过程。在这些情况下,非对比CT扫描可用于评估急性危及生命的事件,但对比增强MRI扫描可以更好地检测更细微的变化或肿瘤进展。在患有运动迟缓症状的患者中也应进行类似评估,并且在这些患者中还应考虑先前存在的神经退行性疾病的发作或进展。
对于接受CAR T细胞治疗后出现周围神经病变的患者,血清检测可用于评估神经病变的其他和更罕见的原因。这些检测包括全血细胞计数、综合代谢panel、糖化血红蛋白A1c、促甲状腺激素、维生素B12、红细胞沉降率、丙型肝炎血清学、HIV筛查(或,如果患者已知感染,则为病毒载量)、血清蛋白电泳、血清游离轻链比率和抗核抗体。对于高度不确定的的特定患者,可能建议进行抗Ro和抗La抗体、IgA抗麦胶蛋白酶抗体(如果怀疑患有乳糜泻)、补体C3和C4、莱姆抗体、冷球蛋白、吡哆醇、铅和汞水平、抗dsDNA抗体和抗Smith抗体检测。
治疗
当前的治疗策略
一般考虑:鉴于症状的急性性质以及临床迅速恶化的巨大可能性,ICANS和TIAN患者需要密切观察。必须通过实验室检测进行连续监测,目前美国临床肿瘤学会指南建议进行静脉水化和预防吸入的措施,如抬高头部。如果出现高级别症状(3-4级)、进行性精神状态变化或反应能力受损,应将患者转移到ICU进行密切监测。如果临床上怀疑或通过脑电图确认有癫痫发作,应提供抗癫痫药物,并且TIAN引起的症状(如梗阻性脑积水)可能需要放置外部脑室引流。在并发CRS的情况下,建议使用IL-6抑制剂托珠单抗进行治疗,以减低全身促炎细胞因子水平(否则可能会转化为毒性脑病)。然而在没有CRS的情况下,不建议使用托珠单抗治疗孤立性神经毒性,因为此时其无效(可能是因为它无法穿过血脑屏障),甚至可能与神经症状的恶化有关。例如,在ZUMA-1试验中,预防性使用托珠单抗治疗的患者接受抗CD19 CAR T细胞治疗后ICANS风险增加。
ICANS:尽管有合理的担忧认为类固醇可能会削弱循环CAR T细胞的抗肿瘤活性,但目前糖皮质激素仍然是治疗ICANS的主要药物。然而尚未确认其对临床结局有任何显著影响,虽然在回顾性队列中生存率与类固醇治疗持续时间之间存在明显关联,但可能因以下事实而产生偏差:患有高级别毒性的患者本身已经面临增加的死亡风险,并倾向于接受长期的皮质类固醇治疗。
鉴于IL-1在ICANS发病机制中的作用,IL-1抑制剂anakinra越来越多地用于治疗难治性ICANS,并在小病例系列中显示出有希望的结果。Strati及其同事报告了6名3-4级ICANS患者,其中4名对anakinra治疗有反应,在3例中症状降至0-1级。其他文章也报告了类似的有利结果,在末次anakinra给药后的1天内ICANS峰值降低,且治疗相关死亡率降低。
关于其他方法,除了单一病例外,尚无相关证据支持使用鞘内类固醇(或化疗)或IFNγ阻断抗体emapalumab治疗ICANS。然而IL-6抑制剂司妥昔单抗在一项纳入45名ICANS和/或CRS患者的回顾性多中心研究中取得了有利结果,获得60%的ICANS特异性缓解率。一项针对该药物在ICANS和/或CRS患者中的前瞻性试验(NCT04975555)正在进行中。在最严重的情况下,治疗选择可能包括抗CD20 B细胞耗竭、大剂量环磷酰胺、静脉免疫球蛋白或血浆置换。其他可以改善ICANS的方法包括T细胞靶向药物,如抗胸腺细胞球蛋白或酪氨酸激酶抑制剂达沙替尼和芦可替尼,这些药物可以减少CAR T细胞分泌促炎细胞因子。此外,他汀类药物可能通过稳定内皮和抗炎特性来降低ICANS的发生率。正在进行的临床试验总结于表2。
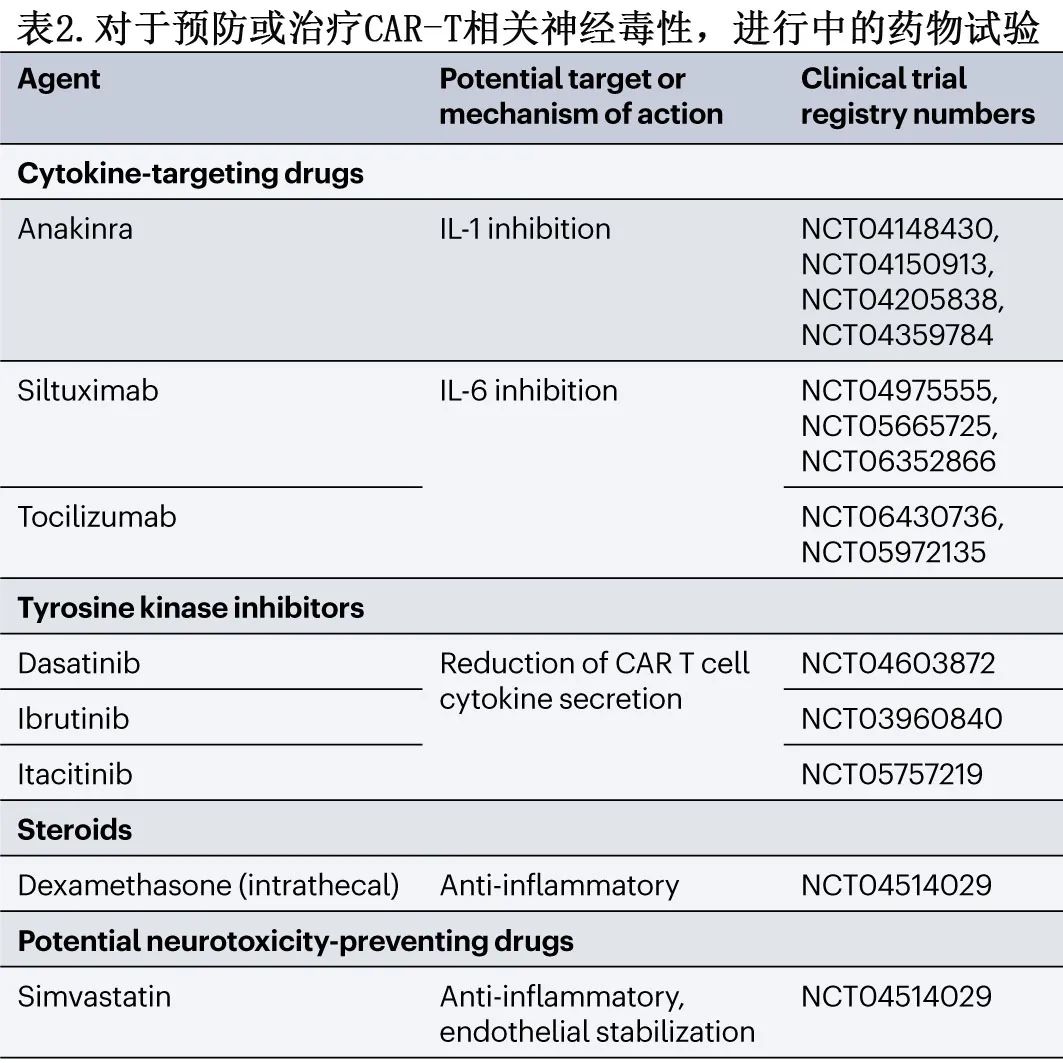
非ICANS神经毒性:鉴于其症状与经典帕金森病的相似性,接受BCMA CAR T细胞治疗后出现非ICANS运动迟缓性运动障碍的患者或可接受左旋多巴联合外周脱羧酶抑制剂治疗;然而并未观察到有说服力或一致的获益。除了皮质类固醇之外的免疫抑制,如使用anakinra、鞘内甲氨蝶呤、阿糖胞苷或大剂量环磷酰胺,已在部分出现运动或神经认知障碍的患者中显示出症状稳定的效果。在一个单一病例中,使用大剂量环磷酰胺耗竭循环CAR T细胞可导致帕金森病样症状的逆转,表明高循环CAR T细胞计数与运动迟缓症状之间存在因果关系。人们很容易推测,环磷酰胺可以通过消除CAR T细胞的扩增和持续存在,从而减轻BCMA CAR T细胞治疗后对类固醇难治性非ICANS神经毒性的影响。
对于非常罕见的神经毒性的最佳治疗策略甚至更不清楚,尽管有案例报告指向用于治疗这些神经紊乱的特发性形式的药物。这些药物可能包括用于震颤的普奈洛尔、用于急性脱髓鞘性多神经病变的静脉免疫球蛋白,或其他周围神经病变的类固醇。
预防措施
尽管改进的监测策略和预先定义的机构治疗方案使得在专业中心对低危患者进行门诊CAR T给药成为可能,但尚未为神经毒性建立预防性药物干预。抗癫痫药物通常预防性地给予有癫痫发作风险的患者,但似乎并不能降低ICANS的风险。在一项II期研究中,预防性使用anakinra治疗接受CD19 CAR T细胞治疗的淋巴瘤患者,可降低ICANS发生率(31名接受治疗的患者中有19%),并且似乎不影响对CAR T细胞治疗的疾病反应。另一项纳入20名淋巴瘤患者的I期试验也显示,anakinra对CAR T细胞的抗肿瘤活性没有不利影响,尽管报告的ICANS发生率略高(35%)。其他试验正在进行中(NCT04359784、NCT04150913、NCT04205838和NCT04148430);然而这些试验缺乏对照组,从而限制了不同机构队列之间的比较。另一项前瞻性I期试验(NCT05665725)正在探索IL-6抑制剂司妥昔单抗在非霍奇金淋巴瘤患者接受CD19 CAR T细胞治疗中的预防性作用。
新型CAR设计
一种突然减少循环CAR T细胞数量的方法是在CAR的设计中加入“自杀开关”或可靶向受体(例如,由rimiducid激活的诱导型caspase 9),可在无法控制的ICANS或TIAN的情况下人为诱导凋亡。其他CAR设计利用截短的可靶向受体(例如,全长CD20或CD20模拟表位),如果遇到难治性毒性,可可以被单克隆抗体如利妥昔单抗靶向。然而,抗体介导的CAR T细胞耗竭的起效可能相对较慢,从而限制了在需要立即逆转严重和急性毒性期间的患者中的疗效。此外,任何自杀策略都将突然终止CAR T细胞的抗肿瘤活性。
除了共刺激域之外,其他旨在减少毒性的CAR设计修改旨在调节细胞因子分泌。例如,对CD19 CAR-T中的CD8α衍生铰链和跨膜氨基酸序列的修改导致细胞因子释放水平降低和CAR T细胞增殖减少,在临床上转化为淋巴瘤患者中极低的ICANS率。小分子调节或物理刺激调节的抗原受体转录控制是调节输注后CAR活性的另一潜在路径。
结论和未来展望
CAR T细胞过继免疫疗法可能会产生显著的急性或迟发性神经毒性,已经确定了多种关键机制,这些机制根据患者固有的特征、疾病负担、靶抗原和应用的CAR结构来驱动神经并发症。尽管ICANS的病理机制越来越得到很好地描述,但通过对照研究建立具有临床价值、以机制为驱动的干预措施仍有待完成。幸运的是,通过目前的治疗流程和监测方案,致命的ICANS病例很少遇到。相比之下,对于不太常见的毒性(如TIAN或帕金森病样症状)的精确分子和细胞机制仍然知之甚少,并且尚未制定用于标准化临床管理的基于证据的指南。对于CAR T细胞治疗的神经毒性预防或治疗干预措施的前瞻性安慰剂对照试验存在未满足的临床需求。深入了解驱动神经并发症的基本机制对于为接受CAR T细胞治疗的癌症患者提供缓解神经毒性的新治疗策略至关重要。
参考文献
Karschnia, P., Dietrich, J. Neurological complications of CAR T cell therapy for cancers. Nat Rev Neurol (2025). https://doi-org.ctust.aliya.filescenter.top/10.1038/s41582-025-01112-8
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)