首页 > 医疗资讯/ 正文
在肿瘤微环境中(TME),免疫细胞的存在对于肿瘤的发展、转移以及对免疫治疗的反应具有至关重要的作用。作为外周血和骨髓中最常见的先天免疫细胞,中性粒细胞在癌症中扮演着复杂且关键的角色。它们构成了多种癌症类型免疫浸润的关键部分。中性粒细胞通过促进血管新生、肿瘤细胞的运动、迁移和侵袭,以及影响其他免疫细胞作为免疫抑制机制的一部分,协助肿瘤的转移过程。
“益气活血”的药物组合是中医治疗肿瘤的传统疗法,人参与丹参作为典型的配伍药材,具有显著的抗肿瘤效果,对于气滞血瘀型转移性癌症患者而言,是一种有效的治疗手段。人参皂苷及丹参酮等活性成分,不仅能够提升免疫细胞对肿瘤的攻击能力,还通过多维度的免疫调节机制,抑制肿瘤的增殖与扩散,为肿瘤治疗领域开辟了新的途径,并提供了潜在的辅助治疗方案。
近日,一篇发表在《Journal of Advanced Research 》杂志,名为“Synergistic potentiation of the anti-metastatic effect of a Ginseng-Salvia miltiorrhiza herbal pair and its biological ingredients via the suppression of CD62E-dependent neutrophil infiltration and NETformation”的文章为人参-丹参的临床研究提供了理论基础。

图1 论文首页
人参和丹参的抗肿瘤作用与中性粒细胞相关的肿瘤免疫微环境(TIME)有关
为评估人参及丹参单独或联合应用的抗肿瘤效果,研究构建了一种实验性肺转移模型,通过静脉注射LLC细胞实现(图2A)。相较于模型组,人参组与丹参组在治疗第四周时,显示肿瘤转移有所减少(图2B)。此外,人参和丹参组在肿瘤面积(图2C、D)、肺淋巴结数目(图2E)及转移率(图2F)方面均显著低于模型组。相较于人参或丹参的单独治疗,联合治疗在抗肿瘤转移方面展现出更佳的效果。为揭示人参和丹参抗肿瘤转移作用的潜在机制,研究对癌旁组织进行了RNA测序分析。
基因本体生物学过程(GOBP)分析显示,大多数显著的生物过程与炎症免疫调节相关(图2G)。相较于其他免疫细胞,中性粒细胞的趋化性显著富集。基因集合富集分析(GSEA)揭示,模型组中与嗜中性粒细胞迁移相关的基因显著富集(图2H)。中性粒细胞标记物Ly6G的染色结果进一步证实了模型小鼠肺部中性粒细胞的聚集,而人参和丹参联合给药后,中性粒细胞数量减少(图2I-J)。在多种肿瘤类型中,中性粒细胞浸润的增加与肿瘤进展密切相关。基于此,研究推测人参和丹参联合治疗可能通过改善与中性粒细胞相关的肿瘤免疫微环境,发挥其抗肿瘤作用。
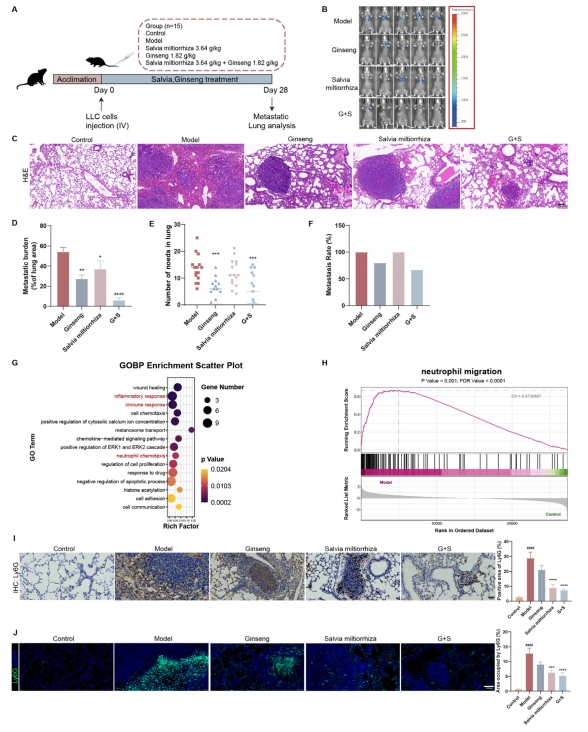
图2 人参和丹参可调节肺中中性粒细胞相关的组织内环境
通过CD62E介导的中性粒细胞粘附,发现了丹参活性成分CPT
进一步的GSEA揭示,模型组中“白细胞与血管内皮细胞的粘附”过程显著富集(图3A)。在给予人参和丹参处理后,一组粘附分子的表达发生了变化,特别是CD62E水平显著降低(图3B)。CD62E是一种关键的细胞受体,参与白细胞和癌细胞的黏附作用,鉴于LLC细胞中缺乏CD62E配体,这引发了对它在中性粒细胞招募至转移部位作用的探讨。免疫组化染色结果表明,人参和丹参处理后CD62E表达受到抑制,且丹参组的抑制效果强于人参组(图3C)。
为探究丹参化合物降低CD62E表达的潜力,研究采用促炎介质TNF-a刺激CD62E表达。对丹参中五种已知的生物活性化合物(包括亲水性部分的LA和RA以及亲脂性部分的Tan I、Tan IIA和CPT)进行了测试。TNF-a诱导CD62E的mRNA(图3D)和蛋白水平(图3E)显著升高,而CPT和LA预处理可降低这些水平。使用5、10、15μM CPT或RA进行检测时,CPT对CD62E的抑制作用优于15μM浓度下的LA(图3F)。HUVECs的免疫荧光检测进一步证实了这些发现(图3G)。综上所述,表明丹参显著降低了关键细胞粘附分子CD62E的表达,其中其活性成分CPT的作用尤为显著。
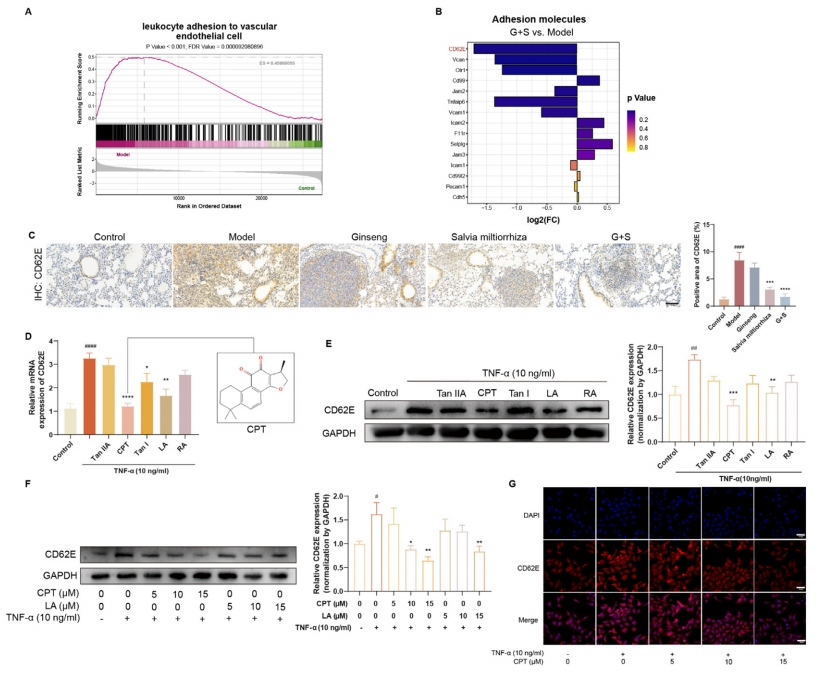
图3 人参和丹参降低CD62E的表达,并筛选丹参中有效物质
基于嗜中性粒细胞释放NETs,发现了人参的活性成分Rg1
鉴于在肺转移瘤中观察到的中性粒细胞浸润现象以及中性粒细胞在癌症免疫调节中的已知作用,研究对从肺部分离的中性粒细胞进行了RNA测序分析(图4A)。并深入探讨了与中性粒细胞相关的特定基因子集,揭示了在模型小鼠中富集的独特基因组,该基因组随后在人参和丹参处理后下调(图4B)。通过KEGG对中性粒细胞中这些基因的分析,揭示了在中性粒细胞前转移功能中起关键作用的NET形成机制。
GOBP分析进一步发现了ERK1/2和MAPK级联的额外富集,这些已知调节NET生成的途径(图4D)。同时,对NETs、中性粒细胞和肺癌之间的联系分析结果显示,肺癌组织中HIST3H3的表达水平明显高于正常组织(图4E)。此外,HIST3H3、ELANE和MPO的拷贝数变异与中性粒细胞浸润水平之间存在显著的相关性(图4F、H)。进一步分析表明,中性粒细胞浸润以及HIST3H3、ELANE和MPO水平与患者生存率呈负相关(图4I)。
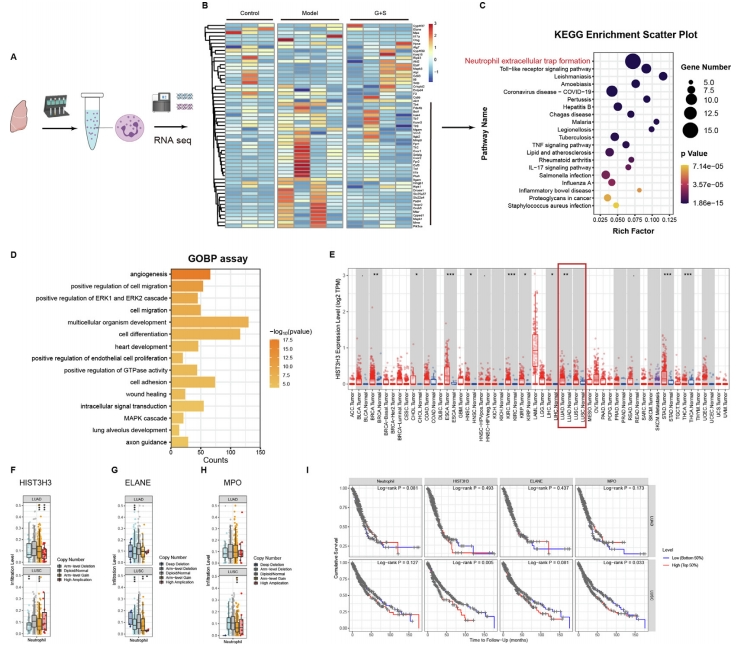
图4 中性粒细胞RNA测序分析与肺癌相关分析
基于前述结果,研究进一步探讨了中性粒细胞胞外陷阱(NETs)在生物体内的形成机制。通过MPO、H3cit和NE的染色技术,观察到人参组肺转移组织中NETs的含量显著低于丹参组(图5A-E)。随后,研究对人参成分是否具有抑制NETs形成的潜在作用进行了测试。蛋白激酶C激活剂PMA被用于诱导NETs的形成,而DNase I作为阳性对照。结果显示,使用50μM人参皂苷Rg1、Rg3和DNase I处理中性粒细胞后,能够减弱PMA诱导的MPO释放(图5F)。
此外,通过使用细胞不渗透性染色质染料共绿色监测DNA释放,研究发现除PPD外,所有测试的人参成分均对NETs的形成具有不同程度的抑制活性。尤其是Rg1展现了显著的抑制NETosis的能力(图5G)。综合以上发现,研究强调了NETs在塑造与中性粒细胞相关的肿瘤微环境中的关键作用,并揭示了人参及其活性成分对NETs潜在的抑制效应。
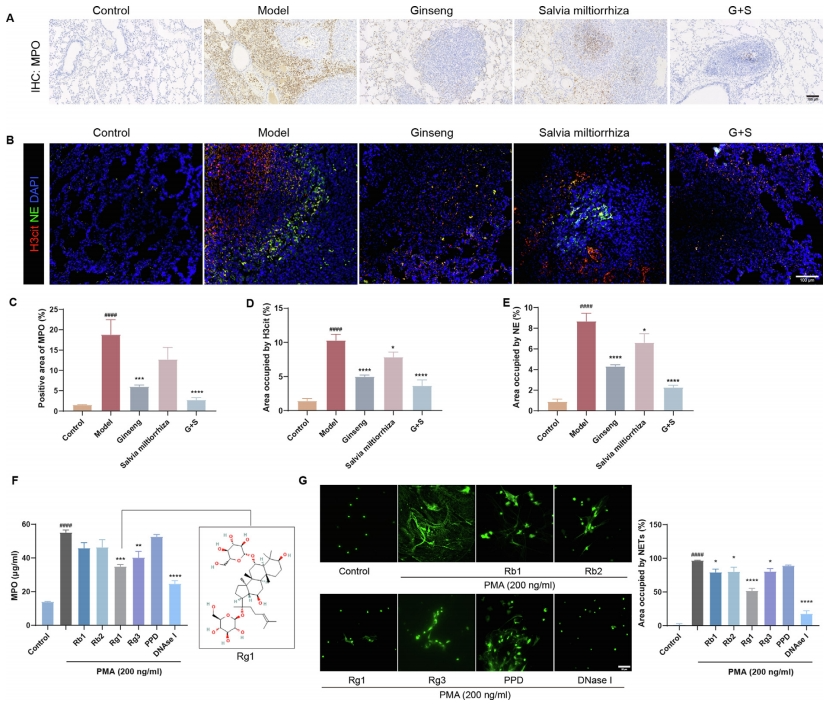
图5 人参和丹参减少肺组织中NETs的生成,筛选人参的有效物质
结论
总之,研究表明人参与丹参的联合应用能够共同调节与中性粒细胞相关的肿瘤微环境,为将人参和丹参应用于临床治疗提供了理论支持,并提出了联合使用这两种药材进行抗肿瘤治疗的创新思路。
参考文献:
Lu K, Xia Y, Cheng P, Li Y, He L, Tao L, Wei Z, Lu Y. Synergistic potentiation of the anti-metastatic effect of a Ginseng-Salvia miltiorrhiza herbal pair and its biological ingredients via the suppression of CD62E-dependent neutrophil infiltration and NETformation. J Adv Res. 2024 Oct 30:S2090-1232(24)00490-9. doi: 10.1016/j.jare.2024.10.036
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)