首页 > 医疗资讯/ 正文
3型先天淋巴样细胞(ILC3s)调节粘膜部位的炎症和组织修复,但这些功能是否适用于其他组织,如肾脏,尚不清楚。
2024年5月29日,中山大学附属第一医院周怡、陈崴及哈佛医学院布莱根妇女医院Joseph V. Bonventre共同通讯(梁州、唐子雯及朱昌健为论文共同第一作者)在共同通讯在Immunity 在线发表题为“Intestinal CXCR6+ ILC3s migrate to the kidney and exacerbate renal fibrosis via IL-23 receptor signaling enhanced by PD-1 expression”的研究论文,该研究表明肠道CXCR6+ ILC3s通过PD-1表达增强的IL-23受体信号迁移到肾脏并加剧肾纤维化。
该研究观察到人类肾纤维化与肾脏和血液中ILC3s的增加有关。在小鼠中,CXCR6+ ILC3s迅速从肠粘膜迁移,并通过损伤小管释放的CXCL16在肾脏中积累。在纤维化肾脏中,ILC3s增加程序性细胞死亡-1 (PD-1)的表达和随后的IL-17A的产生,直接激活肌成纤维细胞和纤维化生态位的形成。ILC3表达PD-1抑制IL-23R的内吞作用,从而扩增JAK2/STAT3/RORgt/IL-17A通路,这是ILC3促纤维化作用所必需的。因此,该研究揭示了迄今为止未被认识的ILC3s从肠道到肾脏的迁移途径,以及ILC3s在促进肾纤维化中的PD-1依赖性功能。

先天淋巴样细胞(ILCs)是异质淋巴细胞,缺乏重排抗原受体,通过细胞因子的产生对损伤作出反应,启动关键的免疫反应和组织修复。ILC3s需要表达类视黄酮相关孤儿受体γt (RORγt),产生白细胞介素(IL)-17A和/或IL-22,在小肠等粘膜屏障部位大量存在(SI) 1ILC3s也存在于肝、肾等实质器官中。ILC3s在生理和病理过程中都起作用,包括维持粘膜稳态、组织修复、抵抗细菌感染和肿瘤免疫监视。ILC3s可以通过IL-17A/IL-22的产生促进沙门氏菌感染的肠道纤维化和四氯化碳(CCl4)诱导的小鼠肝纤维化,表明其在纤维化重塑中的作用。然而,ILC3s是否参与肾纤维化仍不清楚。
肾纤维化是几乎所有类型的慢性肾脏疾病(CKD)的共同命运。在多种刺激下,免疫细胞在很早的阶段就浸润肾脏,产生促炎介质,直接诱导成纤维细胞凋亡分化为表达α-平滑肌肌动蛋白(α-SMA)的肌成纤维细胞。这最终导致异常细胞外基质(ECM)沉积和不可逆的结构和功能损伤。鉴于IL-23、IL-1β和IL-17A是CKD22-24中重要的促炎细胞因子,是ILC3s的主要调节介质和效应因子,假设ILC3s可能参与肾纤维化。
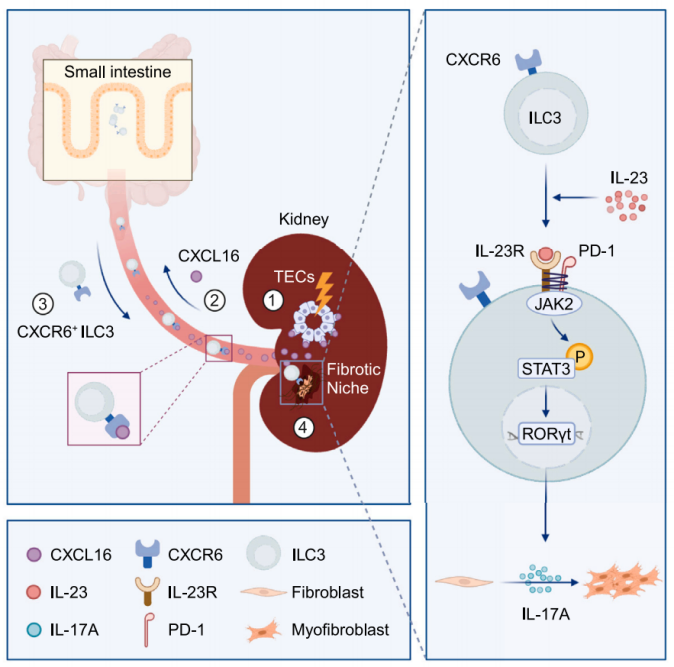
机理模式图(图源自Immunity )
该研究发现ILC3s通过C-X-C基序趋化因子受体6/C-X-C基序趋化因子配体16 (CXCR6/CXCL16)信号传导从SIs迅速募集到肾脏,并通过激活成纤维细胞和启动纤维化生态位形成来促进肾脏纤维化。在机制上,ILC3s的促纤维化作用依赖于IL-23/IL-1β在肾纤维化微环境中诱导的程序性细胞死亡-1 (PD-1)的表达。
PD-1与IL-23R结合,抑制IL-23R的内吞噬,从而维持IL-23R在ILC3s表面,并放大下游细胞内janus kinase 2 (JAK2)/signal transducer and activator of transcription 3 (STAT3)/RORgt信号传导和随后的IL-17A分泌。最终,增加的IL-17A驱动肾成纤维细胞产生ECM。在CKD患者中也检测到类似的模式,支持这些发现的转化潜力。该研究显示ILC3s在肾纤维化中的独特贡献可能通过肠肾连接,靶向ILC3的肠肾迁移或肾ILC3s中的PD-1具有预防CKD的治疗潜力。
原文链接:
https://www.cell.com/immunity/abstract/S1074-7613(24)00255-3
猜你喜欢
- 专科医院医保定点医院癫痫病医院">贵阳脑癫医院专科医院医保定点医院癫痫病医院
- 中山医院院长博士论文被指抄袭学生硕士论文:连致谢也抄
- 防疫顺口溜为孩子健康保驾护航
- 2022年08月27日每日养生小知识健康简报,星期六!健康是一种生活态度!
- 鲜香暖胃的胡萝卜炖羊蝎子~0~选对肉——吃肉也能吃得清淡的做法-咸鲜味炖菜谱
- 冬季需当心季节性眼病
- 香港城市大学史鹏教授《Biomaterials》:真“电子皮肤”,猪皮加电路,快速促进愈合伤口又祛疤
- 亚洲房颤患者该怎么治?权威专家解读最新共识
- 明晚18:00 直播 医学教育创新与实践交流系列会—人血白蛋白在围术期的应用&一例急性化脓性梗阻性胆管炎的诊治分享
- 视力下降要注意,6种食物多吃
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)