首页 > 医疗资讯/ 正文
呼吸困难是呼吸急促或呼吸不适的主观感受,其给患者带来的痛苦往往超出了疾病本身,严重影响患者的生存质量和社会心理健康。此外,呼吸困难是疾病预后不良的独立因素,是晚期癌症患者最常见的致残性症状之一[1-2]。目前,中国晚期癌症伴呼吸困难患者的照护负担远超全球平均水平,因此及时评估和有效处理与呼吸困难相关的痛苦症状至关重要。
然而,临床一直缺乏针对晚期癌症患者呼吸困难处理的循证建议,为此,美国临床肿瘤学会召集多学科专家组,对现有循证医学证据进行整理归纳并进行严格评审[3-4],最终制定了“晚期癌症呼吸困难处理实践指南”,包括急慢性呼吸困难评估及分级干预策略(图1)。本文对该指南重点内容进行详细解读,并结合中国国情进行分析,以期为指导中国临床实践提供参考。
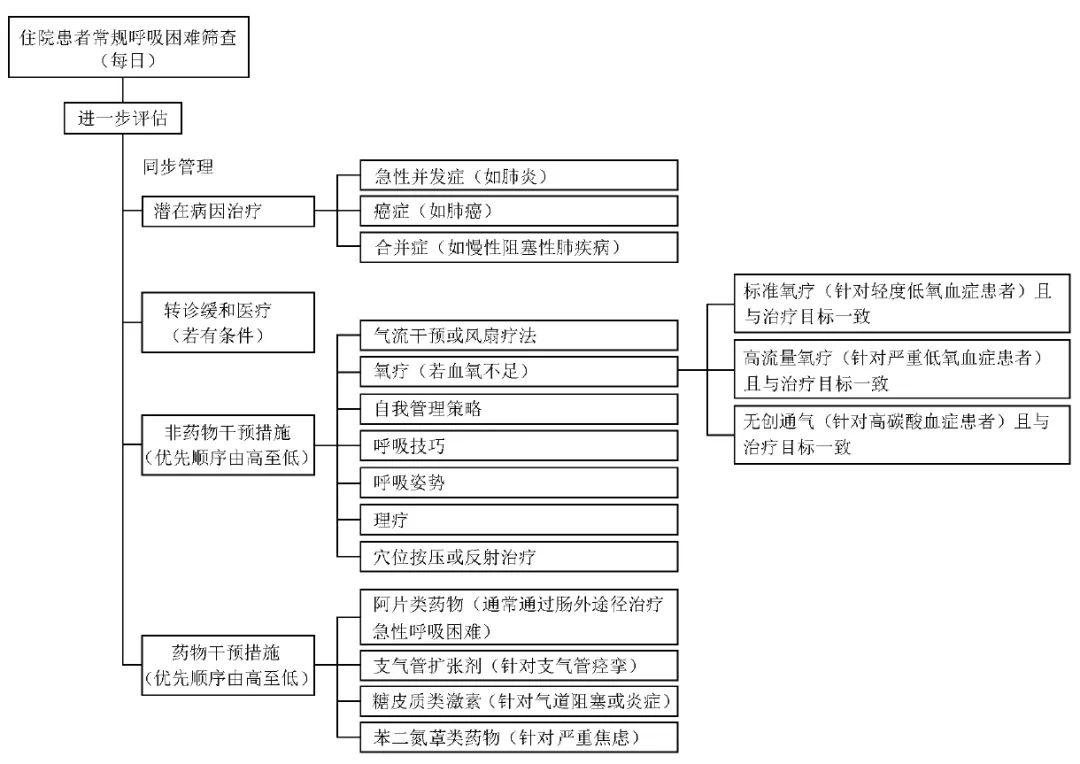
图1 晚期癌症患者急慢性呼吸困难分级干预策略
1 呼吸困难的筛查和评估
与美国胸科学会的指南和建议[2]一致, 本指南也强调呼吸困难是一种主观感受,患者可能伴有呼吸窘迫的生理标志(如呼吸急促)及生物标志(如低氧血症),但也可能并无相关指征。因此,呼吸困难及其严重程度评估的金标准应为患者主诉。
类似于疼痛的最佳评估,呼吸困难的评估应结合病史采集、有效的患者报告工具(如埃德蒙顿症状评估量表)和个性化目标的确定。如果患者因谵妄或其他原因无法准确表达呼吸困难的感受,此时临床医生应依据有效的呼吸窘迫观察量表或临床监测指标进行评估。伴随症状(如焦虑、抑郁、喘息)和客观检查(如影像学检查)均有助于确定引起呼吸困难的根本原因和潜在可逆原因。
值得注意的是,目前中国临床工作中,医生更习惯于直接依据指标(如指氧饱和度)判断患者是否存在呼吸困难,而忽略了患者的主诉,对此应引起重视。
2 根据病因治疗呼吸困难
由于呼吸困难具有诱因多且复杂的特点,指南推荐临床医生应制定一份鉴别诊断清单,其中包括常见可逆病因、癌症相关病因和其他合并症。
对于呼吸困难的常见急性病因(如肺炎、贫血和胸腔积液),应根据相应诊疗规范进行处理。对于癌症相关病因(如气道阻塞性疾病)引起的呼吸困难,全身治疗(systemic therapy)或放疗可能有助于缓解症状,但选择治疗方案前应仔细权衡患者获益与风险。对于慢性疾病(如慢性阻塞性肺疾病)患者,积极治疗原发病有助于改善患者呼吸困难感受。
由于病因与患者生理机能之间存在复杂的作用机制,特别是在患者预期寿命有限的情况下,要求主管医生应与专科医生合作制定呼吸困难照护的最佳方案。
3 转诊至缓和医疗服务团队
缓和医疗(palliative care)是为重症患者提供的专门医疗服务,重点是缓解令人痛苦的症状,提高患者及其家属的生活质量[2]。与美国胸科学会的建议一致,本指南亦建议及时筛查并将患者转诊至跨学科缓和医疗服务团队,通过专业的诊疗服务以有效改善症状,提高患者自我效能和整体生活质量。结合系统评估和纵向监测指标,缓和医疗团队可针对症状实施个性化治疗干预和人文关怀服务,满足患者的社会心理需求。
然而,目前缓和医疗的重要性在中国尚未被广泛认识,绝大多数地区和医院并未配备缓和医疗团队,因此转诊在绝大多数情况下尚不可行,期待未来随着缓和医疗理念的深入践行,更多患者可实现转诊并从转诊中获益。
4 非药物干预措施
指南对癌症晚期呼吸困难患者的非药物干预主要包括气流干预、氧疗、无创通气、穴位按压等综合干预措施。
4.1 气流干预
刺激三叉神经可降低化学反射对过度呼吸的敏感度,从而缓解呼吸困难感受[5]。针对这一生理效应,多项随机对照试验研究结果显示,通过风扇或医用换气系统向面部送风可显著缓解呼吸困难症状[6-8]。风扇疗法简单易行且成本较低,已成为治疗呼吸困难的一线非药物干预措施。临床实践中,医护人员应耐心指导患者及其家属正确使用该方法,以达到最佳疗效。
4.2 标准氧疗
对于静息时出现呼吸困难和低氧血症(即SpO2<90%)的患者,建议通过鼻导管方式提供标准氧疗(2~6 L/min);对于因活动而出现低氧血症的患者,则仅需在活动前或活动期间进行氧疗。由于呼吸困难的发生存在多种诱因,在决定采用氧疗前,临床医生应告知患者氧疗也可能无法完全缓解呼吸困难症状。
在治疗过程中,应参照低氧血症以及姑息性氧疗相关规范进行操作,并积极评估血氧饱和度的变化。值得注意的是,临终前最后时刻出现的低氧血症是一种正常且不可逆的生理现象,临床医生应对此类情况加以辨别,并跟患者及其家属做好解释工作,以减轻其焦虑和担心。
在无低氧血症(即SpO2≥90%)的情况下,本指南不建议为呼吸困难患者提供标准氧疗,而应积极评估潜在病因,将风扇疗法作为一线治疗方案。在查找病因的同时,呼吸困难感受强烈的患者可采用低流量(1~2 L/min)限时氧疗。目前中国临床仍然将标准氧疗作为所有呼吸困难患者的优先干预手段,结合本指南推荐意见,应调整为将风扇疗法作为无低氧血症患者的一线治疗方案,当患者伴有低氧血症时方采取标准氧疗。
4.3 高流量鼻导管氧疗
对于特定患者,由于氧气流量、温度和湿度的限制,标准氧疗可能无法缓解其呼吸困难症状。此时,高流量(60~80 L/min)鼻导管氧疗可能有效,因其能进一步打开上呼吸道死腔,刺激三叉神经,增加气道正压,减少患者呼吸做功。但高流量氧疗也可能给患者带来不适反应(如恶心呕吐等),因此在决定采用高流量鼻导管氧疗时需考虑患者病情、个人意愿以及护理条件等多方面因素。当决策发生矛盾时,限时试验(time-limited trial,例如氧疗时间<1 h)可作为有效的折中方案。
限时试验是临床医生与患者/家属之间的协议,即在规定时间内使用某些疗法,并根据商定的临床结果观察患者病情是否好转,其出发点是避免患者接受无限期的无效治疗。限时试验包含5个关键要素:定义患者病情、明确目标和价值、确定临床状态的客观指标、确定重新评估的时间框架以及限时试验结束时可能采取的措施[9]。
阻碍实施限时试验最常见的原因是对临床重新评估的时间框架无法达成共识,这要求肿瘤专业、缓和医疗专业、呼吸专业团队与患者/家属就限时治疗的目标和具体实施细节进行探讨,以迅速达成让患者/家属以及医疗团队都能理解和接受的方案。
4.4 无创通气
是否采用无创通气改善晚期癌症呼吸困难患者的氧合和通气,需注意的事项与高流量鼻导管氧疗类似。临床医生必须权衡无创通气相关的风险、不良事件(如幽闭恐惧症、食物相关的困扰)及其获益,同时考虑患者的疾病轨迹、经济状况和个人意愿,必要时采用限时试验的方法以达成最佳决策[10]。决策过程中,疾病轨迹尤其值得大家关注,因为不同疾病的发展轨迹是不同的,通过疾病轨迹可以探寻各种疾病的内在规律,有助于协助临床决策的合理制定。
4.5 其他非药物干预措施
虽然呼吸技巧训练、理疗和音乐疗法等的证据并不一致(主要来自对慢性阻塞性肺疾病患者的研究),但由于这些干预措施的成本和风险均较低,因此指南仍推荐尝试使用。此外,两项随机对照临床试验研究结果显示,穴位按压疗法对癌症相关呼吸困难具有良好疗效[11-12],因此本指南亦推荐采用该疗法。护士、理疗师和呼吸治疗师团队共同配合,有助于呼吸技巧训练等非药物干预措施的有效实施,帮助患者缓解呼吸困难不适症状。
研究发现,肺康复治疗可改善慢性阻塞性肺疾病患者的呼吸困难和生活质量[13]。但由于晚期癌症伴呼吸困难患者的存活时间均较短,目前尚无相关证据支持肺康复治疗在晚期癌症患者中具有积极作用,因此指南未作出推荐。
5 药物干预措施
在临床团队评估和处理癌症晚期呼吸困难患者的潜在可逆病因时,应考虑同时采用药物和非药物干预疗法缓解呼吸困难引起的痛苦症状。
5.1 阿片类药物
尽管在癌症患者中进行的临床试验发现,阿片类药物在改善患者呼吸困难方面并不比安慰剂更有效[13-16]。但解读这些发现时,应考虑到研究样本量小、研究持续时间短以及结局测量指标存在差异等因素。
此外,这些发现与已证实的阿片类药物对慢性阻塞性肺疾病患者呼吸困难有效的药理作用相矛盾。考虑到晚期癌症患者伴呼吸困难往往承受巨大痛苦,迫切需要处理,且阿片类药物产生疗效的可能性大于不使用此类药物伴随的风险,因此本指南支持当非药物干预不足以缓解呼吸困难时使用阿片类药物治疗呼吸困难。
因晚期癌症患者使用阿片类药物治疗呼吸困难的证据有限,这意味着无法确定最佳的阿片类药物治疗方案(即阿片类药物的选择、给药途径和持续时间)。指南推荐应根据患者的临床轨迹(如数小时至数天、1个月至数月)、临床环境(如医院、家庭)、合并症(如肝功能衰竭、肾功能不全、心脏病)和药物获取情况(如阿片类药物的获取途径、经济成本)选择阿片类药物。
为指导临床实践,指南推荐了不同临床环境下3种阿片类药物的治疗方案(表1)。
表1 根据临床环境和呼吸困难严重程度建议的阿片类药物治疗方案*
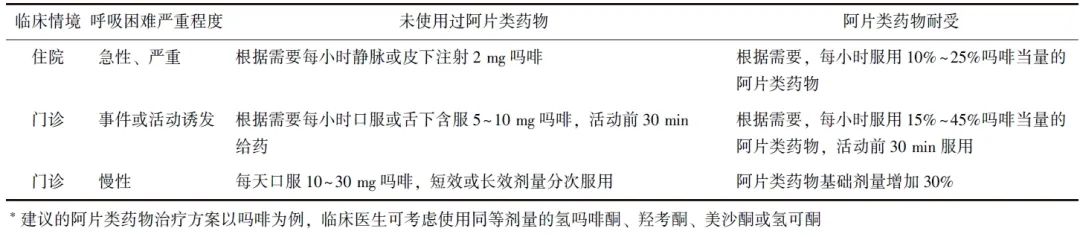
需注意的是,仅当使用非药物干预措施不足以改善患者症状的情况下,才推荐使用阿片类药物;其次,重要的给药原则是“低剂量开始,缓慢进行”,用药时还需结合患者预计生存时间和药物可及性等具体问题进行适当调整。
阿片类药物常见的严重不良反应包括恶心、嗜睡、便秘、瘙痒以及神经毒性[17]。临床医生应及时向患者/家属普及相关知识,同时预防性治疗便秘、密切监测阿片类药物引起的恶心和神经中毒症状(如肌阵挛)。
在监测阿片类药物相关不良反应的同时,临床医生还应根据患者癌性爆发痛(BTcP)和呼吸困难症状是否稳定积极调整阿片类药物的剂量。门诊患者的阿片类药物剂量应每3~4天调整一次,住院患者应每天调整一次。临床医生应清楚地认识到,与BTcP不同,低强度(数字评价量表为4分)呼吸困难即可严重影响患者基本日常活动的能力[18],因此,有必要积极主动治疗呼吸困难,最大限度减轻呼吸困难的致残性影响。此外,药物使用后应积极调整剂量,并确保尽快调整至有效剂量的同时,减少不良反应的发生。
5.2 糖皮质类激素/支气管扩张剂
本指南不鼓励常规采用地塞米松等糖皮质类激素治疗癌症晚期呼吸困难,原因包括证据尚不足且其短期和长期不良反应显著。最近一项针对149例晚期癌症患者的随机对照试验显示,与安慰剂相比,大剂量地塞米松并不能改善患者呼吸困难,且严重不良事件(如感染、失眠)发生率较高[19]。只有患者患有气道阻塞或炎症,且其可能是导致呼吸困难的主要原因时,方推荐使用糖皮质类激素。
因此,糖皮质类激素仅适用于特定患者,其主要适应证可能是缓解症状(如疼痛、疲劳)或占位效应(如中央气道阻塞)。若患者有慢性阻塞性肺疾病和哮喘等基础疾病,或出现支气管痉挛迹象时,建议给予支气管扩张剂,并根据患者病情调整剂量[20]。
5.3 苯二氮类药物
晚期癌症患者使用苯二氮类药物可增加谵妄和呼吸抑制风险(尤其是与阿片类药物或其他精神药物同时使用时),这些额外风险使其不太可能成为呼吸困难的一线治疗药物。然而,若患者伴有潜在焦虑症(如呼吸困难相关焦虑),或在接受阿片类和非药物干预治疗后仍持续感到呼吸困难,可尝试限时使用苯二氮类药物治疗。合理的起始治疗方案为皮下或静脉注射2 mg咪达唑仑,根据需要每4小时一次。
5.4 持续缓和镇静
缓和镇静涉及使用镇静类药物(如苯二氮类、抗精神病药物)抑制患者的意识水平,目的是减轻患者痛苦。如果患者的预期生存时间仅为数天,且其他干预措施均无效时,可考虑给予持续缓和镇静。指南建议由缓和医疗团队参与持续缓和镇静措施的实施,因其不仅熟悉相关药物的滴定,且在平衡治疗目标与患者预后等方面更为专业。缓和镇静的使用需满足如下3个条件:(1)患者经正规治疗,呼吸困难症状不能缓解;(2)患者预期生存时间仅为数天;(3)患者本人申请缓和镇静(需签署缓和镇静使用知情同意书)。
5.5 其他药物
目前尚无充分证据证明抗抑郁药、神经抑制剂或吸入速尿对治疗呼吸困难有效,加之该类药物具有较大副作用,因此,指南建议临床医生酌情考虑是否使用此类药物。
6 小 结
晚期癌症照护中的呼吸困难研究面临较多挑战,包括患者流失、呼吸困难分类标准不一、研究人群存在差异以及评价指标不够客观等,导致专门针对晚期癌症呼吸困难的研究较匮乏,证据基础受到了一定限制。即便如此,本指南仍然基于现有最新循证医学证据并结合临床经验,为晚期癌症伴呼吸困难患者提供了宝贵的治疗指导策略,并强调了根据患者个体预后和治疗目标量身定制治疗方案的重要性。
为提高癌症晚期呼吸困难患者的生存质量和社会心理健康,未来需多学科协同努力,共同探索呼吸困难的病理生理学、定义呼吸困难类型、优化多模式疗法并为患者量身定制干预措施,同时积极开展相关研究,进而为优化指南推荐方案提供高质量的循证医学证据。
考虑到在患者器官衰竭情况下治疗呼吸困难的复杂性,笔者建议应将本指南作为患者与临床医生之间高质量沟通的补充,而非取而代之。此外,在沟通的同时,应及时做好全面、详实的书面记录。
参考文献
[1]Solano J P, Gomes B, Higginson I J. A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease and renal disease[J]. J Pain Symptom Manage, 2006, 31(1): 58-69.
[2]Sullivan D R, Iyer A S, Enguidanos S, et al. Palliative care early in the care continuum among patients with serious respiratory illness: an official ATS/AAHPM/HPNA/SWHPN policy statement[J]. Am J Respir Crit Care Med, 2022, 206(6): e44-e69.
[3]Dy S M, Gupta A, Waldfogel J M, et al. Interventions for breathlessness in patients with advanced cancer: comparative effectiveness review, No. 232[R]. Rockville, MD: Agency for Healthcare Research and Quality, 2020.
[4]Gupta A, Sedhom R, Sharma R, et al. Nonpharmacological interventions for managing breathlessness in patients with advanced cancer: a systematic review[J]. JAMA Oncol, 2021, 7(2): 290-298.
[5]Aucoin R, Lewthwaite H, Ekstrm M, et al. Impact of trigeminal and/or olfactory nerve stimulation on measures of inspiratory neural drive: Implications for breathlessness[J]. Respir Physiol Neurobiol, 2023, 311: 104035.
[6]Kako J, Morita T, Yamaguchi T, et al. Fan therapy is effective in relieving dyspnea in patients with terminally ill cancer: a parallel-arm, randomized controlled trial[J]. J Pain Symptom Manage, 2018, 56(4): 493-500.
[7]Ting F I, Estreller S, Strebel H M J. The FAFA trial: a phase 2 randomized clinical trial on the effect of a fan blowing air on the face to relieve dyspnea in Filipino patients with terminal cancer[J]. Asian J Oncol, 2020, 6(1): 3-9.
[8]Wong S L, Leong S M, Chan C M, et al. The effect of using an electric fan on dyspnea in Chinese patients with terminal cancer[J]. Am J Hosp Palliat Care, 2017, 34(1): 42-46.
[9]Quill T E, Holloway R. Time-limited trials near the end of life[J]. JAMA, 2011, 306(13): 1483-1484.
[10]Loewenstein G. Hot-cold empathy gaps and medical decision making[J]. Health Psychol, 2005, 24(4S): S49-S56.
[11]Dogǧan N, Taşci S. The effects of acupressure on quality of life and dyspnea in lung cancer: a randomized, controlled trial[J]. Altern Ther Health Med, 2020, 26(1): 49-56.
[12]Wyatt G, Sikorskii A, Rahbar M H, et al. Health-related quality-of-life outcomes: a reflexology trial with patients with advanced-stage breast cancer[J]. Oncol Nurs Forum, 2012, 39(6): 568-577.
[13]McCarthy B, Casey D, Devane D, et al. Pulmonary rehabilitation for chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev, 2015, 2015(2): CD003793.
[14]Hui D, Kilgore K, Frisbee-Hume S, et al. Effect of prophylactic fentanyl buccal tablet on episodic exertional dyspnea: a pilot double-blind randomized controlled trial[J]. J Pain Symptom Manage, 2017, 54(6): 798-805.
[15]Cuervo Pinna M Á, Bruera E, Redondo Moralo M J, et al. A randomized crossover clinical trial to evaluate the efficacy of oral transmucosal fentanyl citrate in the treatment of dyspnea on exertion in patients with advanced cancer[J]. Am J Hosp Palliat Care, 2015, 32(3): 298-304.
[16]Charles M A, Reymond L, Israel F. Relief of incident dyspnea in palliative cancer patients: a pilot, randomized, controlled trial comparing nebulized hydromorphone, systemic hydromorphone, and nebulized saline[J]. J Pain Symptom Manage, 2008, 36(1): 29-38.
[17]Benyamin R, Trescot A M, Datta S, et al. Opioid complications and side effects[J]. Pain Physician, 2008, 11(2 Suppl): S105-S120.
[18]Reddy S K, Parsons H A, Elsayem A, et al. Characteristics and correlates of dyspnea in patients with advanced cancer[J]. J Palliat Med, 2009, 12(1): 29-36.
[19]Hui D, Puac V, Shelal Z, et al. Effect of dexamethasone on dyspnoea in patients with cancer (ABCD): a parallel-group, double-blind, randomised, controlled trial[J]. Lancet Oncol, 2022, 23(10): 1321-1331.
[20]Nici L, Mammen M J, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline[J]. Am J Respir Crit Care Med, 2020, 201(9): e56-e69.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)