首页 > 医疗资讯/ 正文
能够自我更新和多谱系分化的癌干细胞(CSCs)在早期肺癌微病变形成中发挥着关键作用。在促肿瘤微病变中,CSCs和浸润性免疫细胞之间的相互通讯提供了一个免疫抑制微环境,通过直接的细胞接触和代谢产物交换促进肺部肿瘤的生长和治疗耐药性。其中,CSCs和肿瘤相关巨噬细胞(TAMs)之间的相互作用最为典型,具有相互依赖但相互抗性的特征。CSC可以通过趋化因子如C−C基序趋化因子2(CCL2)和巨噬细胞集落刺激因1(CSF1)的介导,导致促肿瘤巨噬细胞水平升高。而M2型TAMs又可通过包括白细胞介素-6(IL-6)、表皮生长因子(EGF)转化生长因子-β(TGF-β)和WNT配体介体等生物介质增强CSC干性。因此,通过干扰CSC-TAM通信,调节免疫细胞识别和有效清除肿瘤细胞在肿瘤免疫治疗中具有重要意义。研究表明,在肿瘤微环境中,TAMs被认为在满足CSCs或肿瘤细胞的高铁需求方面发挥着“铁供体”作用。具有铁成瘾特征的CSCs中生物标志物CD44的高表达可以通过CD44/透明质酸(HA)-Fe途径以及经典的转铁蛋白受体1(TfR1)/TF-Fe途径提高细胞内铁的摄取。过量的游离铁催化活性氧(ROS)的产生,具有一定的细胞毒性。因此,铁稳态和铁介导的细胞死亡可能对肿瘤原位中的TAM-CSC通信具有潜在的药物作用。
近日,中科院上海硅酸盐研究所施剑林院士、胡萍研究员研究团队开发了一种由铁掺杂的介孔二氧化硅纳米颗粒并负载柠檬酸盐和葡聚糖的纳米平台(DFHC),用来调节TAM的铁代谢诱导CSC的铁死亡,最终通过雾化给药抑制早期癌症的发生和发展。使用雾化输送,DFHC的肺滞留期可以显著延长,导致DFHC有效地积聚肺癌微病灶中。纳米颗粒将根据葡聚糖和CD206受体之间的相互作用被内化到TAM中,然后定位在溶酶体中。由于柠檬酸盐对Fe(III)的强螯合强度,−Si−O−Fe−杂化框架响应溶酶体酸性环境降解,将导致Fe(III/II)和柠檬酸盐的共释放,并随后形成Fe(III/II)-柠檬酸盐复合物。在CSC和TAM共存的促肿瘤微病变中,铁代谢水平显着升高。由于CD44介导/增强的铁吞噬作用和葡萄糖-6-磷酸(G6P)引起的氧化还原失衡,CSC发生铁死亡。体内外结果表明,通过DFHC介导的TAMs调节铁代谢可以有效抑制CSCs的增殖和干性,最终抑制早期肺癌的发生,延长早期肺癌小鼠的生存期。
该研究以题为“Nebulized Therapy of Early Orthotopic Lung Cancer by Iron-Based Nanoparticles: Macrophage-Regulated Ferroptosis of Cancer Stem Cells”发表在《JACS》期刊上。


图1. DFHC调节TAMs,诱导早期原位肺癌雾化治疗中CSCs的铁死亡示意图。
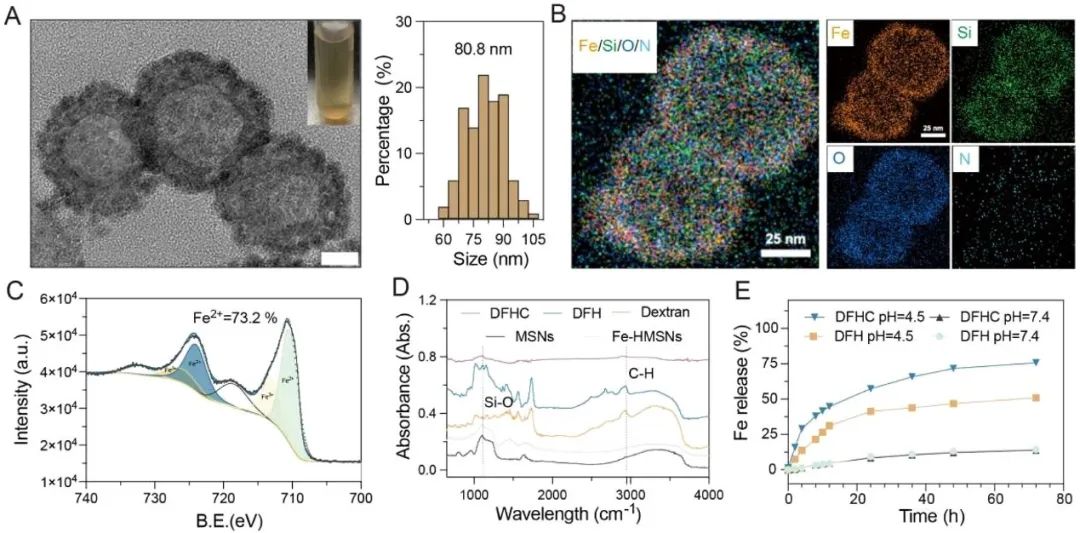
图2. DFHC表征。
首先,研究者采用典型的溶胶-凝胶法合成了直径为79.2 nm的介孔二氧化硅纳米颗粒(MSN)模板。在弱碱性水热环境下,MSNs进一步水解,释放出二氧化硅低聚物,该低聚物与Fe前体(Fe(acac)3)结合,在MSNs表面形成Fe掺杂的二氧化硅层。当达到结合平衡时,产生具有−Si−O−Fe−杂化框架的中空Fe-HMSNs(Fe-HMSNs)。然后,将柠檬酸盐负载到Fe-HMSNs中形成Fe-HMSNs@Ct。最后,Fe-HMSNs@Ct经葡聚糖-聚乙二醇硅烷修饰形成Dex@Fe-HMSNs@Ct(DFHC)。DFHC为80.8 nm的均匀中空多孔结构(图2)。通过元素图谱和能量色散光谱(EDS)、X射线光电子能谱(XPS)及傅里叶红外光谱(FTIR)表征,证明DFHC合成成功。
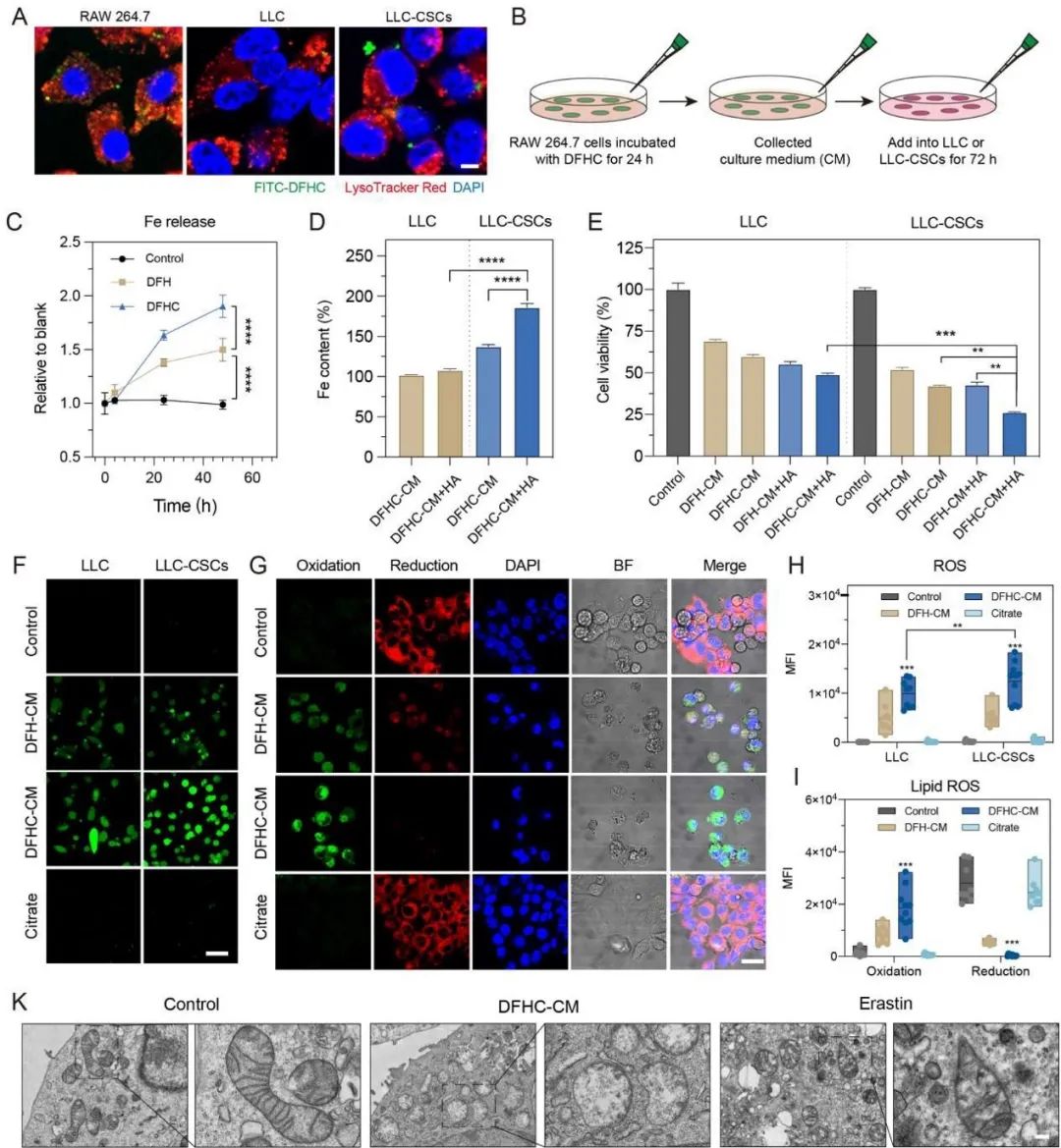
图3. DFHC调节TAMs,介导铁代谢触发CSC铁死亡。
研究者采用巨噬细胞系RAW 264.7用来研究DFHC介导的铁代谢的效率。用IL-4预处理的RAW 264.7细胞用于模拟肿瘤微环境中的M2型巨噬细胞。由于葡聚糖和CD206之间的配体-受体相互作用,使得DFHC能够有效靶向肿瘤微病变中表达CD206的M2型TAM。相比小鼠肺癌细胞(LLC)及LLC-CSCs (LCC癌细胞在特定补充剂下诱导获得), FITC-DFHC在M2型RAW 264.7细胞中的内吞作用显著增强。接下来研究者探究了DFHC-CM(RAW 264.7细胞与DFHC共孵育后的上清) 对诱导CSC铁死亡的影响。当细胞在HA存在下,与DFHC-CM一起孵育时,LLC-CSC的铁吸收将通过CD44/HA-Fe途径显着增加(图3D)。在HA存在的情况下,DFHC-CM对LLC-CSCs表现出比LLC细胞更强的毒性,且DFHC-CM对LLC-CSC的细胞毒性高于在不存在HA的情况(图3E),证明表明DFHC-CM通过CD44/HA-Fe途径增强了CSC的杀伤作用。此外,DFHC-CM能有效刺激脂质过氧化,抑制谷胱甘肽过氧化物酶 (GPX4) 表达从而引发 LLC细胞的铁死亡, 造成比商品化铁死亡诱导剂erastin孵育更明显的线粒体形态变化。综上所述,细胞上清液中大量铁的存在,能有效引发LLC-CSC肺癌细胞的铁死亡。

图4. DFHC-CM中的G6P下调协同促进铁死亡。
为了进一步探讨DFHC-CM增强CSC铁死亡的机制,研究者DFHC-CM 进行了涉及3635种代谢物的代谢组学分析。通过数据分析(图4 A),6-磷酸葡萄糖 (G6P)引起了研究者的关注。G6P是磷酸戊糖途径 (PPP) 的主要底物。G6P下调抑制PPP并依次抑制烟酰胺腺嘌呤二核苷酸磷酸氢化物(NADPH)和谷胱甘肽(GSH)的产生(图4C),从而削弱细胞对活性氧(ROS)的抵抗力,从而协同促进LLC的铁死亡。将LLC-CSC和LLC细胞与添加或不添加G6P的DFHC-CM共孵育,分析NADPH、 GSH、氧化应激及GPX4水平,发现 G6P-NADPH-GSH-GPX4轴在铁增强的过氧化环境下防止CSCs铁死亡中发挥重要作用,而G6P的下调将有利于铁诱导的铁死亡。
综上,研究者开发了一种雾化治疗策略,通过使用DHFC的铁基纳米颗粒治疗早期肺癌癌症,通过这种策略,DHFC调节的TAMs能够通过铁代谢调节在肿瘤微组织中特异性触发CSC铁死亡。与静脉给药相比,雾化给药显示出比静脉给药高得多的治疗效果。DFHC可以通过靶向TAMs,在微小的肿瘤病变中有效积累,为CSC和TAMs共存的促肿瘤生态位提供潜在的治疗方法。此外,通过响应特定的细胞生物信号,如酸性环境和柠檬酸盐螯合,DFHC调节的TAMs中的溶酶体在促进局部肿瘤部位的铁代谢中发挥铁工厂的作用。由此产生的铁积累和抗氧化代谢产物(G6P)的减少提供了CSC铁死亡和干细胞抑制的最大协同功效,从而抑制早期癌症的发生和发展。
原文链接:
https://doi.org/10.1021/jacs.3c08032
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)