首页 > 医疗资讯/ 正文
3月24日,Pharming宣布FDA已经批准Joenja(leniolisib)上市,用于治疗12岁及以上患有磷脂酰肌醇3-激酶δ综合征(APDS)的成人/青少年患者。Joenja是一款选择性靶向磷脂酰肌醇3-激酶δ(PI3Kδ)的口服抑制剂,是FDA批准的首款针对APDS的疗法。该疗法最初由诺华开发,Pharming在2019年获得了开发权益。
APDS是一种罕见的原发性免疫缺陷,每百万人中约有1至2人受到影响。它是由调节白细胞成熟的PIK3CD或PIK3R1两个基因中的任何一个变异引起的。这些基因的变异导致PI3Kδ(磷酸肌醇3-激酶δ)通路的过度活跃。PI3Kδ通路中的平衡信号传导对生理免疫功能至关重要。当这种通路过度活跃时,免疫细胞无法成熟和正常运作,导致免疫缺陷和失调。
APDS的特点是严重的复发性鼻窦炎、淋巴增生、自身免疫和肠病。由于这些症状可能与多种疾病有关,包括其他原发性免疫缺陷,APDS患者经常被误诊,诊断延误平均为7年。由于APDS是一种进行性疾病,随着时间的推移,这种延迟可能导致损伤的累积,包括永久性肺损伤和淋巴瘤。确诊这种疾病的唯一方法是通过基因检测。
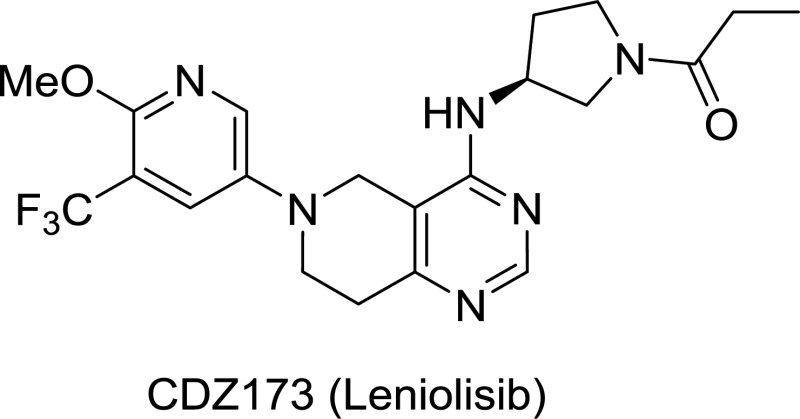
leniolisib分子结构式(图片来源于文献PMID 28947947)
APDS是由PIK3CD或PIK3R1基因突变引起的罕见的原发性免疫缺陷,症状包括严重的复发性窦肺感染、淋巴增生、自身免疫疾病和肠病。
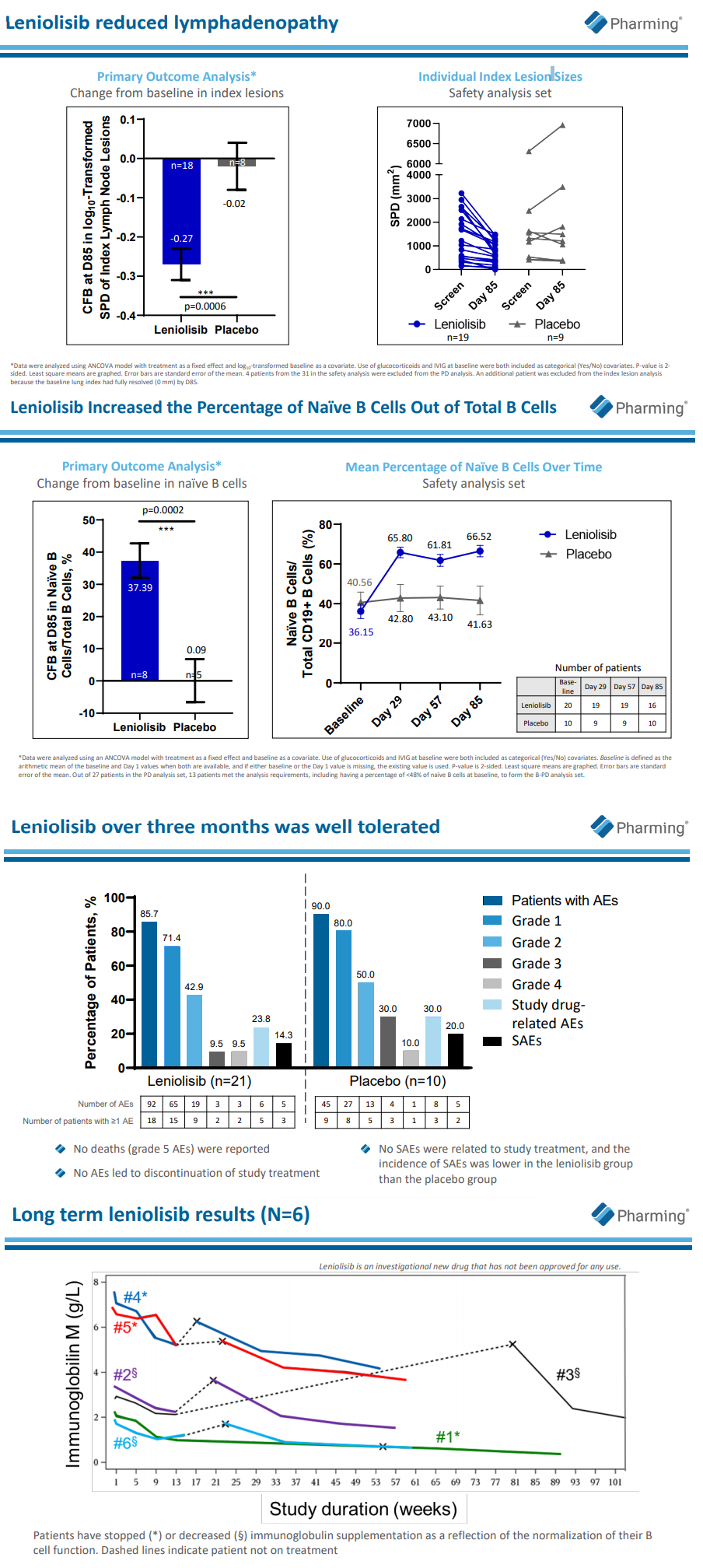
为期12周的随机对照研究显示,该研究达到了淋巴结减小和免疫缺陷纠正的共同主要终点。与安慰剂相比,接受Joenja治疗的患者淋巴结大小指标降低0.25(P=0.006),外周血中的初始B细胞(naïve B cells)比例差异为37.30%(P=0.0002)。安全性方面,临床试验中最常见的不良事件为头痛、鼻窦炎和特应性皮炎。
APDS的临床特征包括显著的淋巴增殖和免疫功能障碍,以及淋巴瘤风险增加。数据显示,接受leniolisib治疗的患者,与APDS相关的疾病标记物减少。此外,研究的安全性数据表明,患者对leniolisib具有良好的耐受性。作为申请的一部分,Pharming还提交了一项长期、开放标签扩展临床试验的数据,该试验包括38名接受leniolisib长期治疗(中位时间:102周)的APDS患者。
PI3K抑制剂种类很多,根据作用机制,大致可分为广谱型PI3K抑制剂(pan-PI3K)、亚型特异性PI3K抑制剂和靶向PI3K/mTOR双重抑制剂三大类。
除Joenja外,全球总共批准5款PI3K抑制剂,即吉利德的Zydelig、拜耳的Aliqopa、Verastem公司的Copiktra、诺华的Piqray和TG Therapeutics的Ukoniq。
PI3K被认为是肿瘤治疗的有效靶点而受到MNC关注。然而,由于安全性问题,PI3K抑制剂的研发遭遇了诸多挫折,仅在去年就有多款PI3K抑制剂遭遇“不测”。比如,吉利德将上市六年的PI3Kδ抑制剂IZydelig撤出市场;Incyte宣布将撤回PI3Kδ抑制剂Parsaclisib在美国的新药上市申请;FDA要求MEI Pharma针对Zandelisib再进行一项试验;TG Therapeutics自愿撤回其Ukoniq联合Briumvi治疗慢性淋巴细胞白血病和小淋巴细胞淋巴瘤成人患者的生物制剂许可申请/补充新药申请。
参考资料:
- 上一篇:一文读懂:骶髂关节错位的诊断
- 下一篇:IL-4R靶点相关研发新药进展
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)