首页 > 医疗资讯/ 正文
肿瘤坏死因子α抑制剂英夫利昔单抗(ifliximab,IFX)是一种能与可溶性和跨膜型的肿瘤坏死因子α结合的单抗,从而中和肿瘤坏死因子α的生物学活性。自1998年和1999年分别在美国(美国)和欧盟(EU)首次获得批准后,IFX已成为治疗风湿性和其他炎症性疾病的中流砥柱。
SB2是英夫利昔单抗(IFX)的生物类似物,被批准用于治疗类风湿性关节炎(RA)、强直性脊柱炎(AS)、成人和儿童克罗恩病(CD)、成人和儿童溃疡性结肠炎(UC)、银屑病关节炎(PSA)和斑块型银屑病(PSO)。韩国的药品审批程序包括上市后监测(PMS)研究,以重新审查已批准的新药的安全性和有效性。
生物仿制药是与已获批准的参考产品高度相似的生物制品。生物仿制药的开发和批准遵循严格的监管路径,欧盟于2004年实施,美国于2010年实施,以确保生物仿制药与其参考产品在质量特征、生物活性、有效性和安全性(包括免疫原性)方面没有临床上有意义的差异。一般说来,生物相似物与其参考产品的可比性是在由广泛的体外质量研究组成的逐步过程中评估的,以证明在与检测生物相似物与其参考产品之间的任何潜在差异相关且最敏感的研究人群中,在物理化学性质、非临床比较和临床正面临床数据方面具有很高的相似性。

在韩国,上市后监督(PMS)研究是韩国食品和药物安全部(MFDS)药品审批程序的一部分,允许在指定期限(4-6年)内重新审查已获批准并上市的新药的安全性和有效性结果。这项经前综合征研究的目的是评价Remaloce的安全性和有效性。(以下简称“SB2”)在韩国的实际临床实践中。此外,对服用ı或从其他IFX产品改用SB2的患者进行了SB2的安全性和有效性分析。
方法:这是一项前瞻性、多中心、开放标签、观察性的4期经前综合征研究,研究对象为ı患者或在所有批准的适应症上与SB2相似的IFX-NA患者或其他IFX-生物相似患者。主要终点是评估SB2的安全性,报告为不良事件(AEs)和药物不良反应(ADRs)。第二个终点是评估作为调查人员总体有效性评估衡量的有效性,将其分类为改善、稳定或恶化。此外,还收集了每个适应症的疾病特异性活动评分[RA的28关节改良疾病活动评分(DAS28),韩国巴斯强直性脊柱炎疾病活动指数(KBASDAI),克罗恩疾病活动指数(CDAI),UC的完整Mayo评分。
基线人口统计和疾病特征
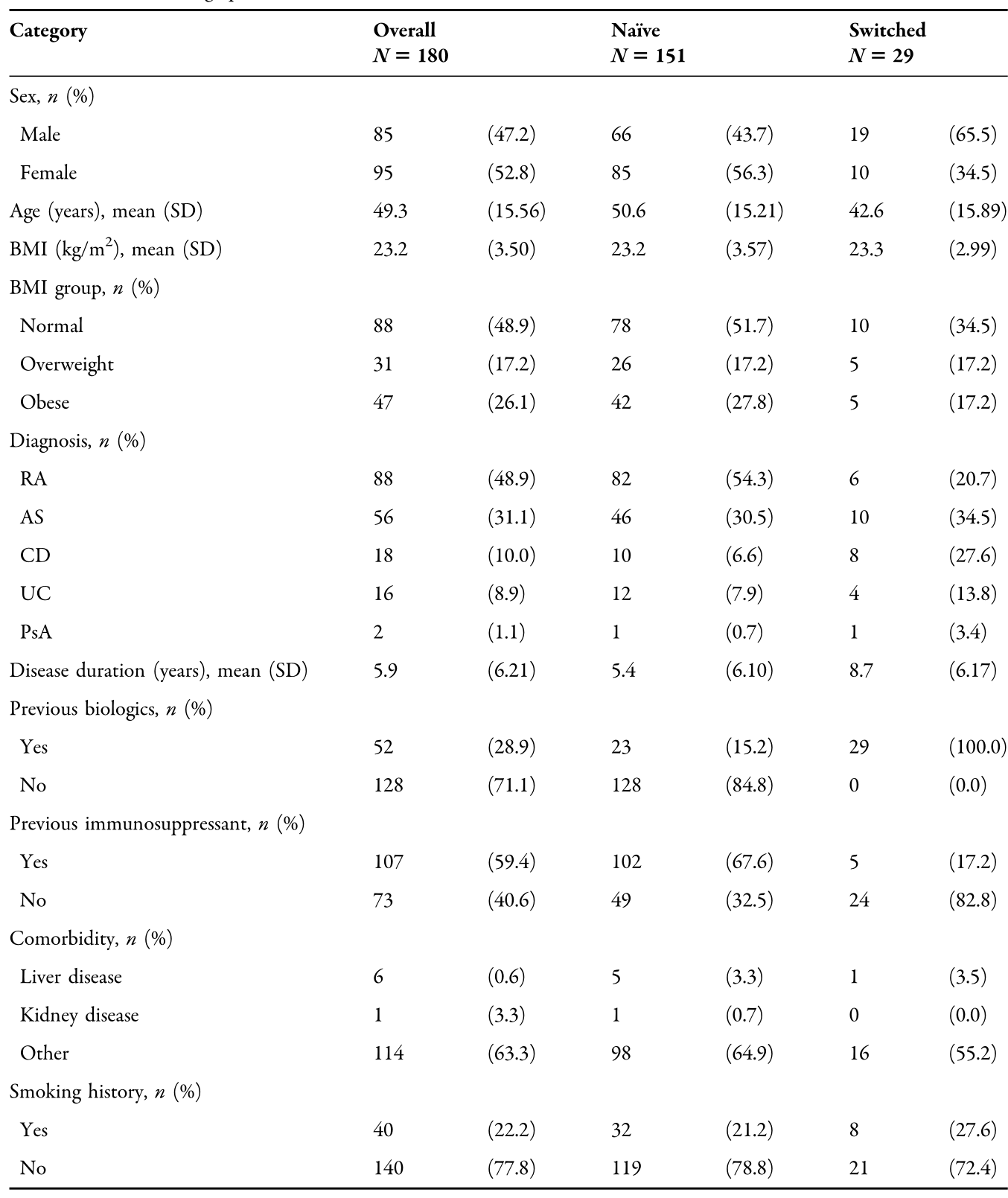

NAı:a RA、b AS、c CD、d UC患者的平均(SD)疾病活动评分。*配对t检验;Wilcoxon符号等级检验。强直性脊柱炎、CD克罗恩病、CDAI克罗恩病活动性指数、DAS28改良疾病活动性评分、KBASDAI韩国巴斯强直性脊柱炎疾病活动性指数、类风湿性关节炎、溃疡性结肠炎
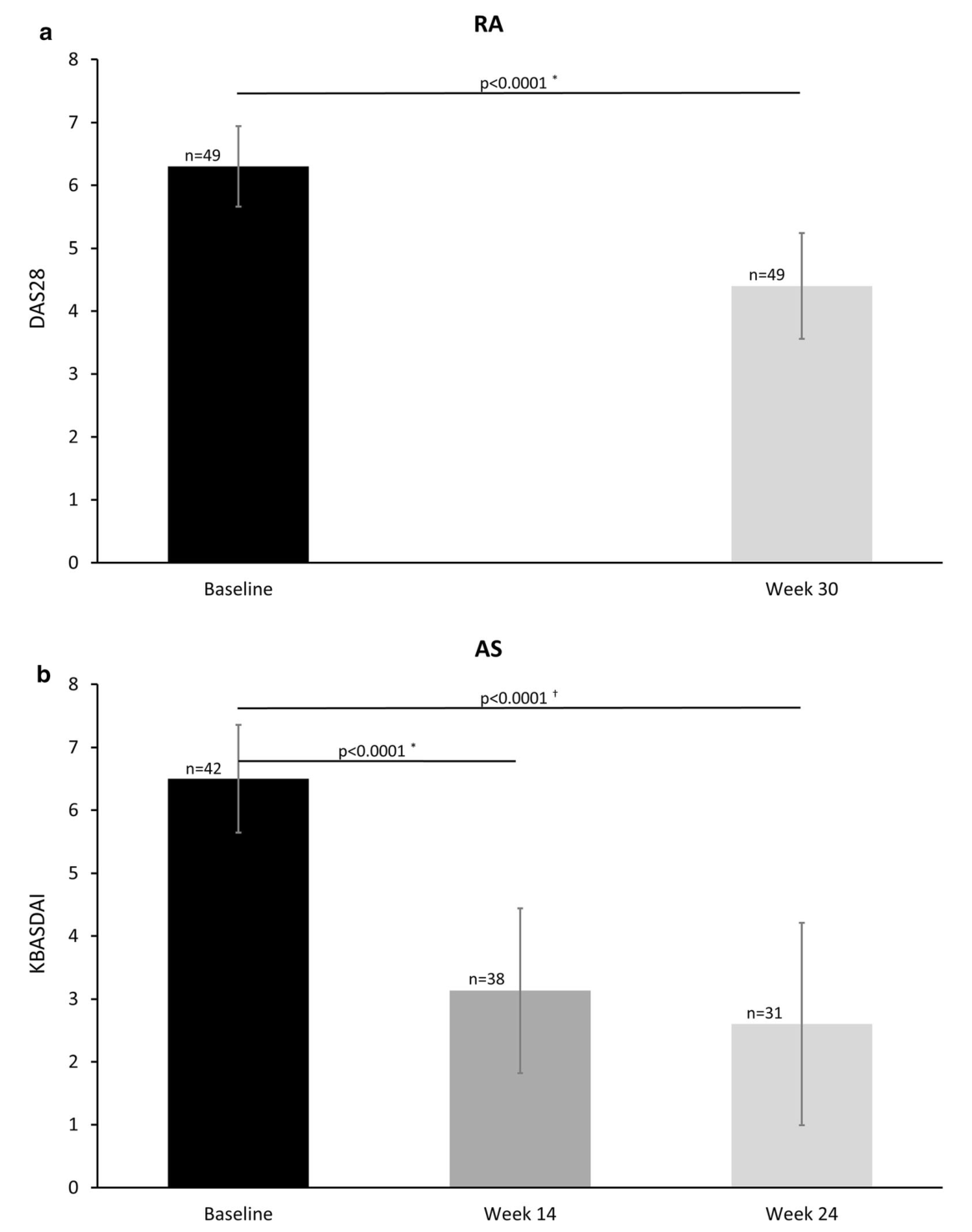
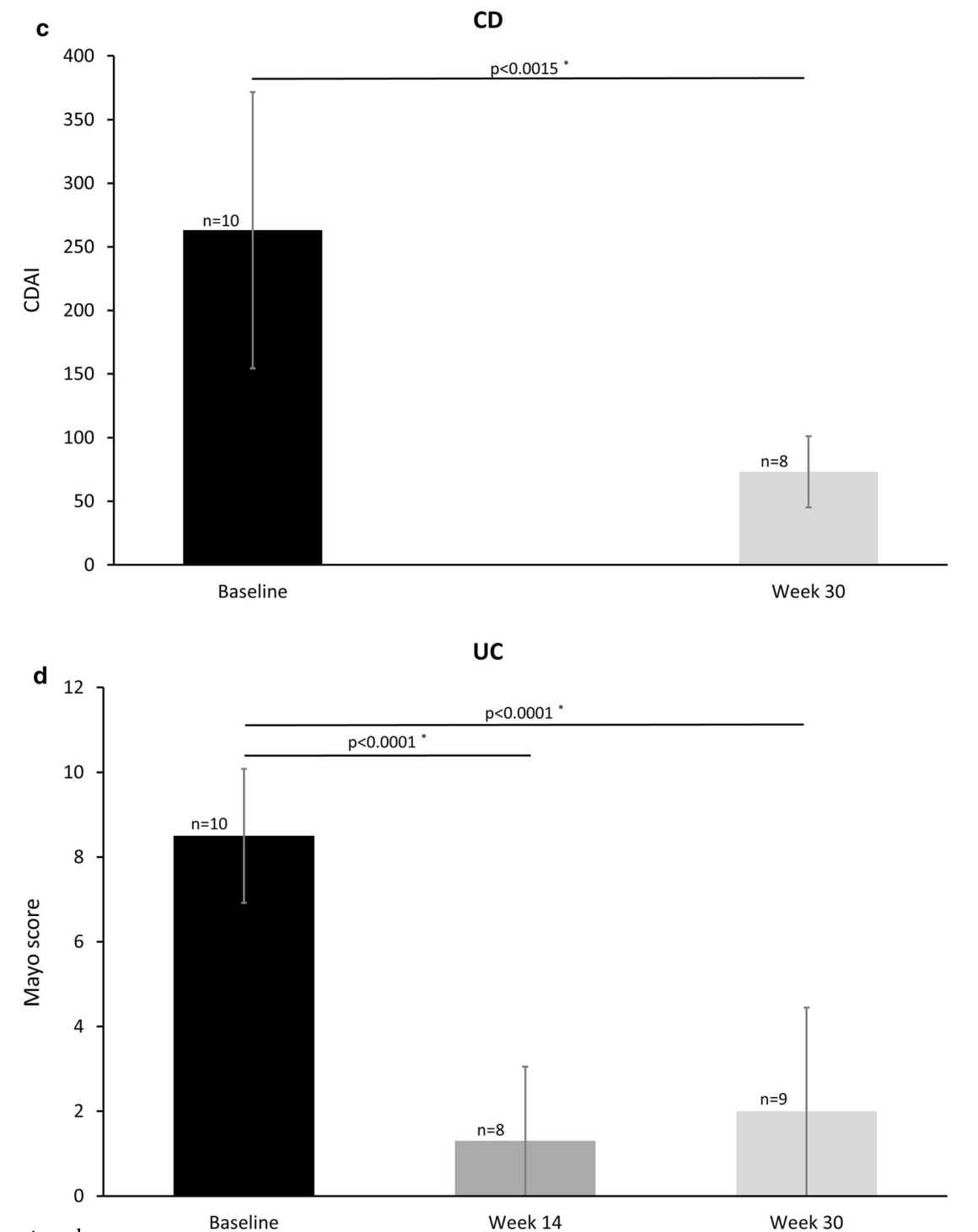
结果:进入安全性和有效性分析的患者分别为180例和128例。大多数患者(83.9%)是IFX患者,16.1%是转换型患者。RA(48.9%)和AS(31.1%)是最常见的指征。总体而言,23例(12.8%)患者报告了不良反应,14例(7.8%)患者报告了不良反应。严重不良事件(SAE)3例(1.7%)。根据研究人员的总体疗效评估,SB2在94.6%(105111)的IFX-NAı?ve患者和82.4%(14/17)的转换患者中有效。在IFXNAı患者中,疾病活动性评分从基线到第30周(AS患者24周)显著下降;每个指征的疾病评分平均(SD)变化分别为:RA 28-1.9(0.79),KBASDAI-3.8(1.68),CD-200.4(112.47),UC满分-6.6(2.92)。SB2治疗的持续率为88.3%,中位治疗时间为30.1周。
结论:韩国IFX生物类似物SB2的PMS研究证实了SB2在主要适应症中的安全性和有效性。
文献来源:
Kim DW, Lee Y, Kim G,Safety and Effectiveness of SB2 (Infliximab Biosimilar) in Adult Patients with Immune-Mediated Inflammatory Diseases: A Post-Marketing Surveillance in Korea.Adv Ther 2023 Jan 10;
- 上一篇:中药材进入欧盟市场的关键质量因素
- 下一篇:孕妇感染新冠应该怎么做
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)