首页 > 医疗资讯/ 正文
为了适应自身能量需求,肿瘤表现出独特的代谢特征,可通过有氧糖酵解的形式产生ATP,为细胞活动供能。相比线粒体呼吸,有氧糖酵解的效率大大降低。因此,肿瘤细胞会从机体中摄取大量的葡萄糖,为其生长、侵袭和转移提供能量。
棕色脂肪组织是哺乳动物中对维持体温起重要作用的特异性产热组织,其高表达解偶联蛋白1(UCP1)。当受到寒冷刺激或药物干预时,成年人体内的棕色脂肪组织可被激活。受交感神经信号控制,棕色脂肪细胞可通过UCP1,将氧化传递呼吸链中的电子传递过程与ATP的生成解偶联,从而将线粒体跨膜质子梯度转化为热能释放,这一过程被称为非颤抖性生热(Non-shivering thermogenesis,NST)。
与肿瘤细胞类似,棕色脂肪细胞会迅速高效地利用葡萄糖等营养物质,作为产热的关键代谢底物。基于这一机制,棕色脂肪激活及产热已成为调节血糖,治疗肥胖、2型糖尿病等代谢性疾病的潜在疗法,并在临床研究中取得一定进展。但在其他重大疾病领域,棕色脂肪的治疗潜力仍尚待探索。值得一提的是,棕色脂肪和肿瘤均具有大量摄取葡萄糖的共同点,但学界对于棕色脂肪组织及其和肿瘤的关系仍知之甚少。
2022年8月3日,瑞典卡罗林斯卡医学院曹义海(Yihai Cao)教授课题组与复旦大学、山东大学、温州医科大学等高校的科研人员合作,在 Nature 期刊发表了题为:Brown-fat-mediated tumour suppression by cold-altered global metabolism 的研究论文。
该研究提出了寒冷通过激活棕色脂肪抑制肿瘤生长的全新理念,并给出了相应的治疗思路。

为探索寒冷对肿瘤发生发展的影响,研究团队首先通过构建小鼠结直肠癌、胰腺癌、黑色素瘤等多种移植瘤模型、以及结直肠癌自发成瘤模型、乳腺癌自发成瘤模型等不同实体瘤模型,应用不同温度干预,发现与热中性的30℃处理组相比,4℃冷暴露显着抑制小鼠肿瘤生长,并延长荷瘤小鼠生存期。通过使用核心体温仍为37℃的非体表肿瘤模型,研究团队排除了寒冷对体表肿瘤的直接影响,并发现肿瘤内部的微血管密度下降,细胞凋亡增加。
研究团队进一步观察到,在寒冷暴露下,小鼠的棕色脂肪显着激活。PET-CT结果显示,冷暴露显着促进荷瘤小鼠棕色脂肪的葡萄糖摄取,相反明显抑制肿瘤的葡萄糖摄取。更进一步,棕色脂肪移除术可有效逆转寒冷抑制肿瘤生长的现象。基因富集分析及代谢组分析均显示:冷暴露导致棕色脂肪组织葡萄糖代谢显着上调。而肿瘤组织葡萄糖代谢则被显着抑制,且其中的PI3K及mTOR信号均下调。
该研究结果说明寒冷激活棕色脂肪组织,通过血糖竞争机制,从降低葡萄糖的来源及削弱肿瘤摄取葡萄糖能力两方面有效抑制肿瘤生长。研究团队随后使用了高糖饲养荷瘤小鼠模型,及Ucp1基因敲除荷瘤小鼠模型验证了这一机制。
最后,研究团队小规模招募了健康志愿者及肿瘤患者,进行了前瞻性的临床观察。结果证明,健康志愿者和肿瘤患者具有足量的棕色脂肪并可被寒冷激活。与此同时,肿瘤患者接受一周的温和的冷暴露治疗后,体内棕色脂肪组织显着激活并增加葡萄糖摄取,相反,患者的肿瘤组织中葡萄糖摄取降低,提示了应用寒冷干预治疗肿瘤的临床可行性。
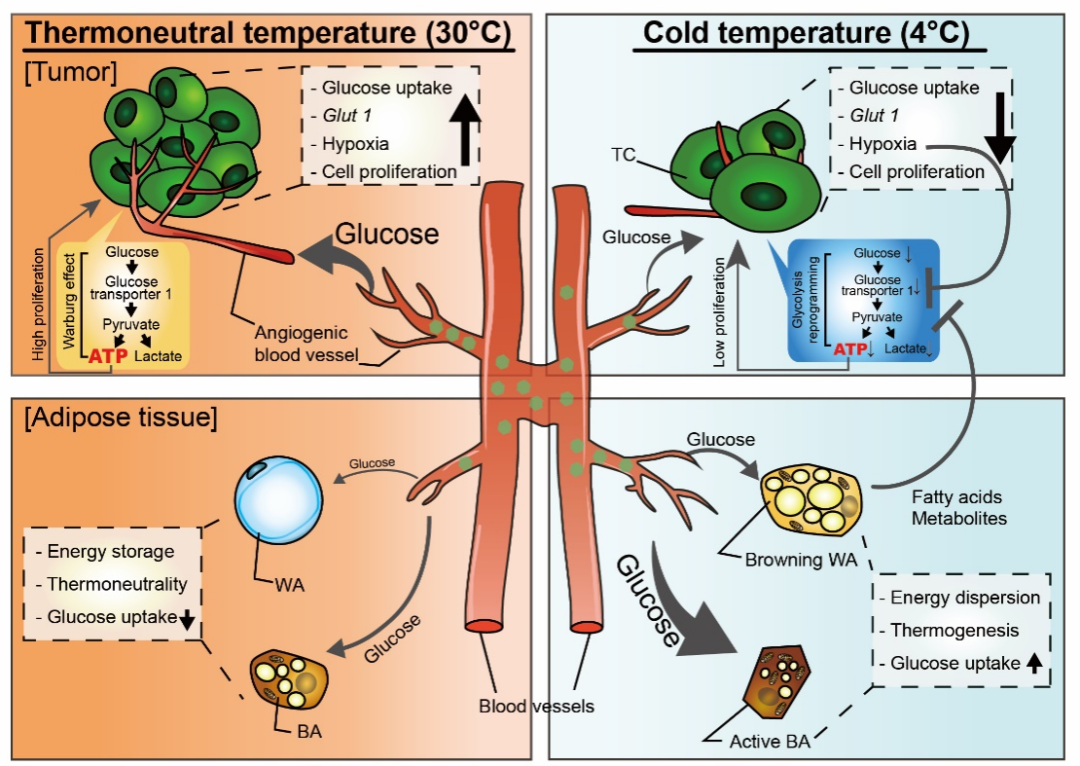
综上所述,该工作首次发现,冷暴露促进棕色脂肪组织葡萄糖摄取,并抑制肿瘤细胞的葡萄糖摄取,进而抑制其生长。这一发现巩固了糖代谢在肿瘤发展中的重要作用,揭示了冷暴露对于肿瘤组织的影响及其潜在机制,并提出了抗肿瘤的“寒冷疗法”。
中国工程院外籍院士、瑞典卡罗林斯卡医学院曹义海教授为该论文的通讯作者。瑞典卡罗林斯卡医学院Takahiro Seki博士和复旦大学基础医学院杨云龙研究员为共同第一作者。
原始出处:
Seki, T., Yang, Y., Sun, X. et al. Brown-fat-mediated tumour suppression by cold-altered global metabolism. Nature (2022). https://doi.org/10.1038/s41586-022-05030-3.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)