首页 > 医疗资讯/ 正文
随着人类寿命的显著延长,心血管疾病、神经退行性疾病(NDDs)及癌症已成为主要的老年疾病。尽管癌症和NDDs似乎表现为相反的细胞命运——肿瘤为细胞过度增殖,NDDs则表现为神经元凋亡和功能丧失,但流行病学研究表明两者呈现显著的逆相关性:即大多数患有癌症的患者较少罹患NDDs,反之亦然。这种倒置现象促使科学家探索其背后的分子机制,重点聚焦于细胞内的关键能量和代谢调节器——线粒体,特别是其质量控制机制Mitophagy。
线粒体自噬(Mitophagy)作为选择性清除受损线粒体的自噬过程,保证了线粒体的稳态与功能,对于控制细胞内氧化应激水平、能量代谢平衡及细胞命运决定至关重要。癌细胞通过调节Mitophagy实现代谢重编程、促进生存和疗效抵抗;而NDDs中的Mitophagy缺陷则导致线粒体积累、氧化应激过度和神经元病变。深入剖析Mitophagy在两类疾病中的差异与共性,有望推动精准医疗的发展,并为两类疾病寻找共同或特异性的治疗靶点。

近期,发表在Journal of Hematology & Oncology一项综述,系统归纳了目前Mitophagy在癌症与神经退行性疾病(如阿尔茨海默病、帕金森病、亨廷顿病和肌萎缩侧索硬化症)中的作用机制及其临床意义。作者综合了流行病学、分子生物学及临床研究,提出Mitophagy在两种疾病间的逆相关现象中处于枢纽地位,是解释其发病机制及发展治疗策略的关键因素。文章不仅详细揭示了Mitophagy的Ub依赖及非依赖途径和调节机制,还探讨了疾病相关的线粒体功能障碍、细胞命运调控与代谢重编程,以及靶向Mitophagy的前沿药物和基因治疗进展。
1. 癌症与神经退行性疾病流行病学证据
- 阿尔茨海默病(AD)与癌症风险呈负相关,患AD者罹患癌症的风险下降42–50%,患癌者罹患AD风险下降35–37%。
- 特殊癌种如肺癌、白血病和乳腺癌与AD的风险降低有不同幅度的相关。
- 有趣的是,尽管吸烟增加肺癌风险,却可能因尼古丁的神经保护作用而降低AD风险。
- 帕金森病(PD)患者大多也显示降低的癌症发生率,其机制与遗传突变相关联,提示生物机械路径的重叠。
2. 线粒体与Mitophagy:癌症与NDDs的交汇点
- 线粒体是能量代谢中心,调节生物合成、ROS生成、钙平衡及细胞信号转导。
- 癌症细胞利用Mitophagy调节代谢重编程(典型Warburg效应),维持干性以及适应微环境压力。
- NDDs中遗传因子引起线粒体功能障碍,导致ROS增加、钙稳态紊乱及细胞死亡,Mitophagy缺陷加剧疾病进展。
- 线粒体核之间的信号转导、线粒体DNA(mtDNA)的变异及核线粒体DNA片段(NUMTs)的积累等,均影响肿瘤发生和神经退行。
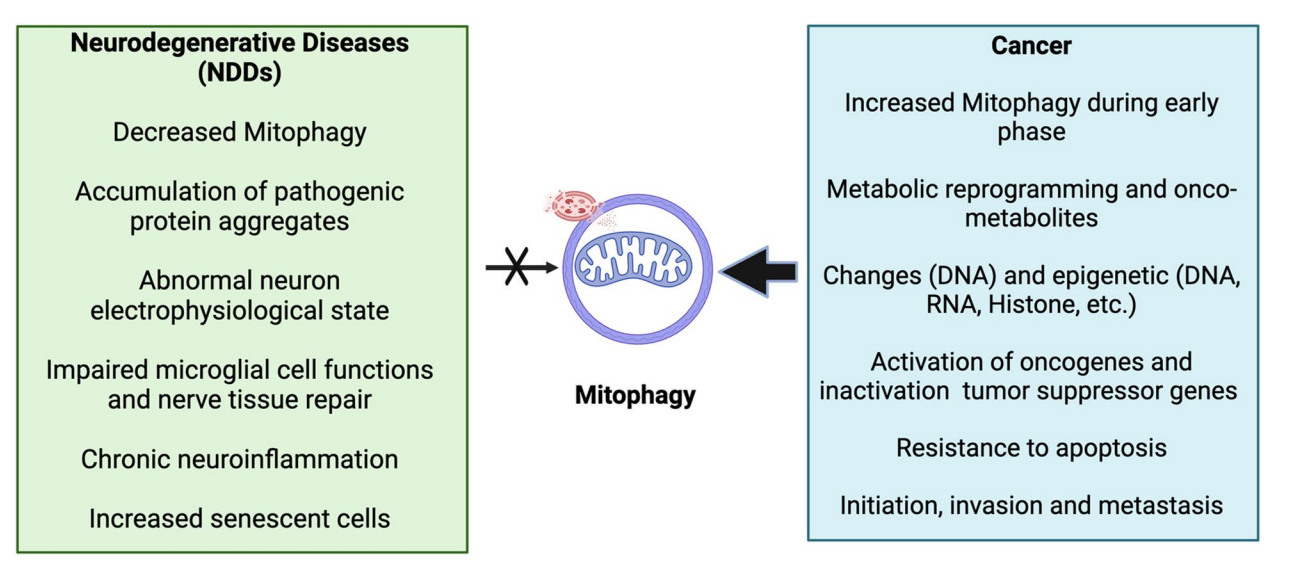
图:NDDs与癌症中线粒体自噬的比较分析
3. Mitophagy机制及其调控途径
- Ub依赖通路:以PINK1/Parkin为核心,受损线粒体的PINK1积累激活Parkin,诱导外膜蛋白泛素化,招募自噬适配器如OPTN、p62等,促进自噬体形成。
- Ub非依赖通路:受损线粒体蛋白直接作用自噬相关蛋白LC3,如BNIP3、NIX、FUNDC1介导。
- 脂质介导:如心磷脂、神经酰胺参与Mitophagy调控。
- Mitophagy通路在癌症与NDDs中的具体参与调节存在差异,PINK1/Parkin缺陷与PD、AD相关,BNIP3/NIX介导的途径则在癌症中更为关键。
4. Mitophagy在癌症中的角色
- Mitophagy既可作为肿瘤的抑制机制(去除ROS产生的受损线粒体,减少基因组不稳定),也可能在肿瘤进展中促进生存、侵袭及免疫逃逸。
- 癌细胞通过Mitophagy调节免疫细胞代谢,提高存活率,干扰免疫治疗效果。
- 多种小分子药物及靶点(USP30、PINK1、Parkin)显示出调控Mitophagy,影响癌症治疗的潜力。
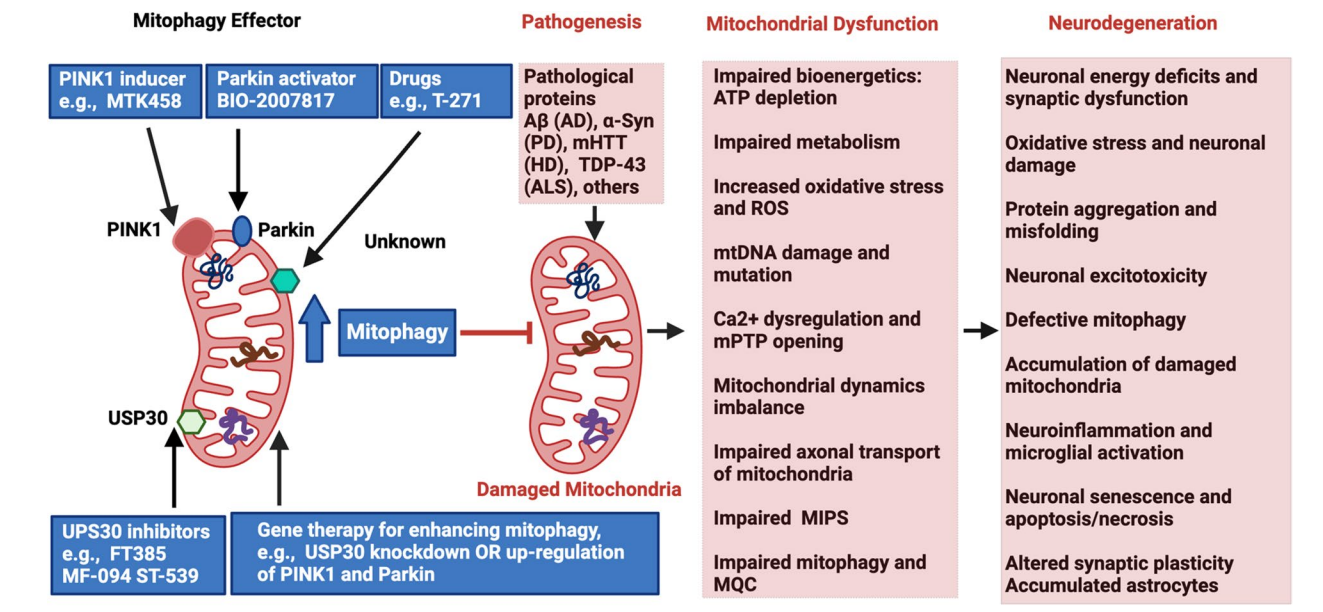
图:靶向线粒体自噬在NDDs中的治疗潜力
5. Mitophagy在神经退行性疾病中的作用
- 脑部高能耗依赖线粒体稳态,Mitophagy作为质量控制系统,维持神经元及胶质细胞的功能。
- AD、PD、HD和ALS均表现出Mitophagy缺陷,导致受损线粒体积累、氧化应激加重及神经炎症,最终促使神经元死亡。
- AD中,Aβ,tau蛋白及APOEε4均影响Mitophagy通路,恢复Mitophagy功能可减轻认知障碍。
- PD家族遗传基因PINK1/Parkin突变直接导致Mitophagy受损,Ca²⁺离子稳态紊乱为早期病理标志。
- HD与ALS由于特定致病蛋白(mHTT、TDP-43、SOD1)干扰Mitophagy过程,引发神经退行。
6. 疾病中Mitophagy失调的共性与特异性
7. Mitophagy调控的潜在治疗策略
- 神经退行性疾病:促进Mitophagy以清除受损线粒体,保护神经元。代表药物包括Ferulic Acid、Melatonin、Urolithin A、Metformin、Dimethyl Fumarate等。USP30抑制剂的临床试验即将开启,为精确激活Mitophagy提供新途径。
- 癌症治疗:抑制Mitophagy,增加ROS蓄积,破坏肿瘤细胞代谢适应,提升化疗/放疗敏感性。药物如Liensinine阻断自噬体-溶酶体融合,Mdivi-1抑制线粒体裂变,以及针对MCU的Ca²⁺调控等策略逐渐显现潜力。
- 精准调控Mitophagy路径具挑战性,因为其在不同肿瘤类型及疾病阶段表现出双向作用。
研究价值与意义
本综述分析了Mitophagy在癌症与神经退行性疾病中的分子与细胞机制,包括流行病学证据、细胞命运调控、代谢重编程及免疫调节,为解释两种病理看似截然不同但却逆相关的现象提供了统一框架。识别Mitophagy在两大疾病谱系中的双重作用,不仅深化了我们对细胞质量控制的理解,也极大拓展了治疗策略的可能性。
尤其重要的是,此文强调了Mitophagy作为一个“分水岭”角色,介导线粒体健康与细胞存亡,对细胞命运产生深远影响。未来药物设计中精准调控这一机制,将有望实现神经退行性疾病的病理阻断及癌症的治疗突破。文章还配套详尽罗列了多种Mitophagy活性调节剂与新兴靶点,为临床转化提供方向。
此外,文中图表对Mitophagy在两类疾病内的表达与功能差异作了清晰对比,有助于临床和基础研究人员理解其复杂性并指导个性化药物开发。
原始出处
Huang J et al. Mitophagy’s impacts on cancer and neurodegenerative diseases: implications for future therapies. J Hematol Oncol. 2025;18:78. https://doi.org/10.1186/s13045-025-01727-w
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)