首页 > 医疗资讯/ 正文
急性髓系白血病 (AML) 中位诊断年龄为68岁,超过2/3的患者≥60岁。通常不建议对高龄、体能状态较差或有显著基础器官功能障碍的患者采用 AML 强化诱导方案,因为该人群的发病率和早期死亡率较高。自20世纪80年代以来,阿糖胞苷和蒽环类药物的标准强化诱导方案仍是基石,但多种新的靶向药物的出现彻底改变了新诊断 AML 患者的治疗,特别是对于不适合强化化疗 (IC) 的患者,分子靶向治疗可为提供更多治疗选择。
所有新诊断 AML 患者均需要评估fitness并检测细胞遗传学和分子学畸变,以便做出初始治疗决策。是否适合IC需要由治疗医生在权衡多种因素(如年龄和合并症)后确定,Ferrara标准通常用于临床试验确定fitness,可作为客观定义临床相关器官功能障碍和衰弱(frailty)的有用工具(表1)。
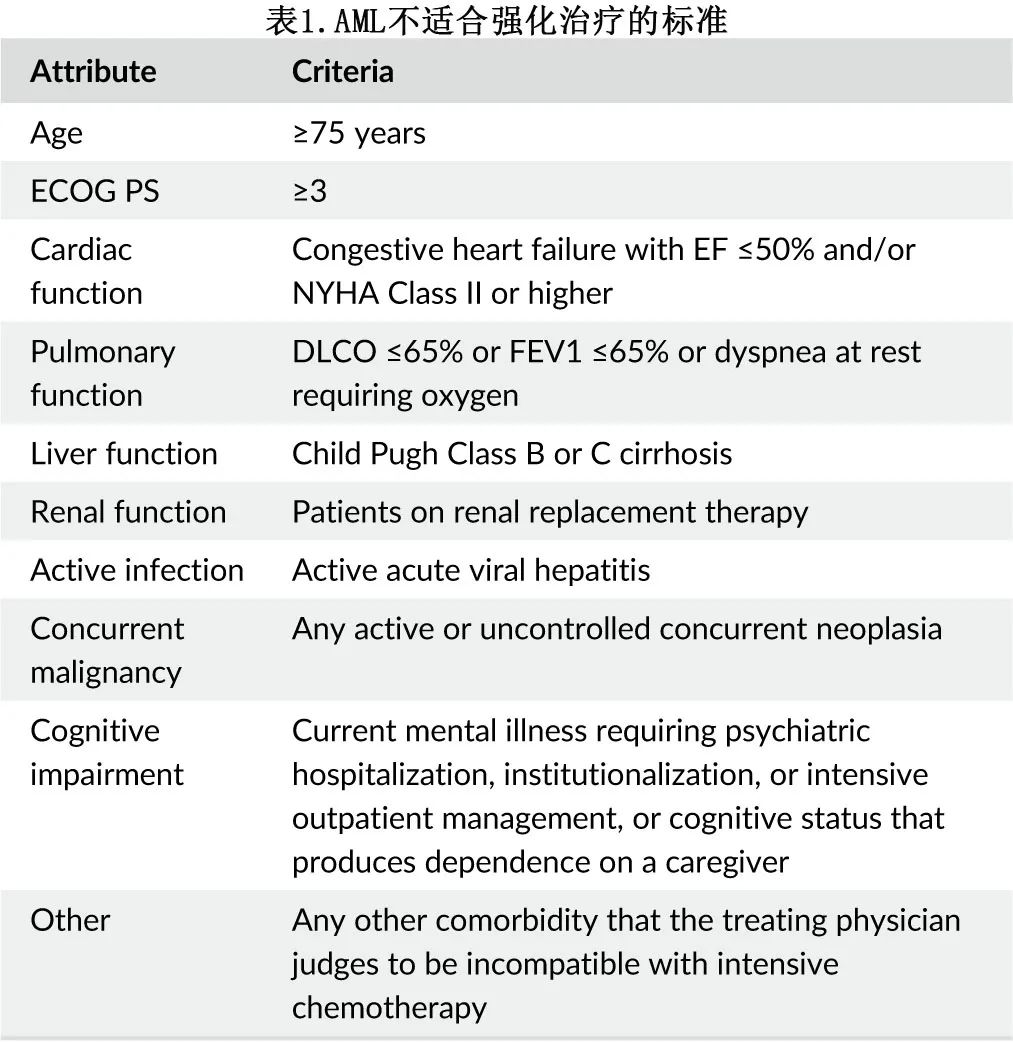
使用标准临床和实验室变量(例如年龄、血小板、纤维蛋白原、乳酸脱氢酶)的其他经验证的评分系统也有助于预测老年患者的早期死亡率和对标准 IC 的低反应率。对于不适合 IC 或IC治疗早期死亡风险高的患者,可根据是否存在某些突变(例如IDH1)提供不同的减低强度治疗 (LIT)。AML靶向治疗的出现和发展改变并扩大了 LIT 的选择,使得及时进行细胞遗传学和分子学检测以指导最佳治疗决策变得越来越必要。
《American Journal of Hematology》近日发表综述,讨论了一线治疗中的减低强度方案和对这些治疗耐药的潜在机制,还对一些有前景的试验性减低强度药物和联合方案进行了综述。现整理主要内容供参考。

减低强度治疗的标准方案
初始减低强度方案
直至过去十年,不适合 IC 的患者的治疗选择仅限于羟基脲、去甲基化药物 (HMA) 和/或低剂量阿糖胞苷 (LDAC)。LDAC结合不同药物的尝试多数失败,直至开发出维奈克拉和glasdegib(新型hedgehog 通路抑制剂),以及靶向 CD33 的单克隆抗体药物偶联物gemtuzumab ozogamicin (GO)(表2)。GO 相关的生存获益主要见于细胞遗传学低危/中危患者,且骨髓和肝毒性限制了其在该患者人群中的使用。

维奈克拉为基础的方案
维奈克拉(VEN)联合LDAC或HMA(包括阿扎胞苷[AZA]和地西他滨[DAC])均有获益(表2)。且HMA + VEN联合治疗似乎对广泛的分子学和细胞遗传学亚型均具有疗效(图1),NPM1和 IDH2 突变也获得高缓解率和持久缓解。
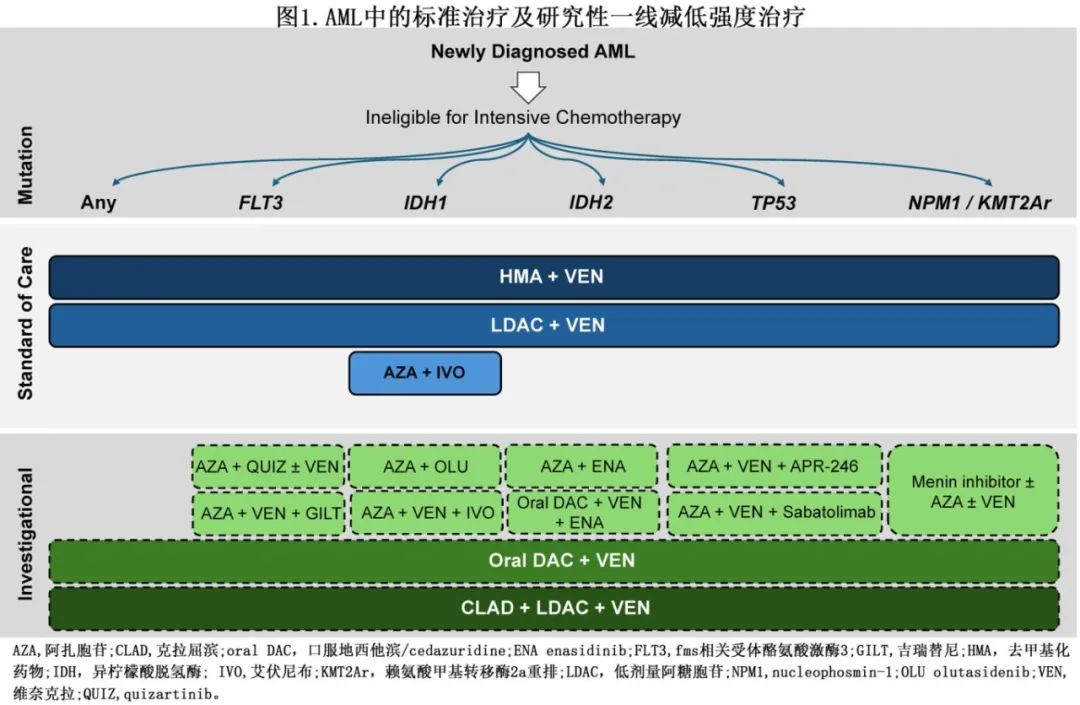
维奈克拉耐药和应答机制
分析对VEN为基础方案的耐药模式和机制至关重要,因为 VIALE-A研究中仅41%的患者通过多参数流式细胞术 (MFC) 可获得可测量残留病灶 (MRD) 阴性,但部分患者更有可能通过HMA+VEN获得 MRD 阴性,例如NPM1 突变患者MRD阴性率高于FLT3 突变、IDH1/2 突变和TP53 突变。与 MRD 阳性患者相比,MRD阴性患者的缓解持续时间、EFS和 OS 更长。此外,在≥12个月后选择停止VEN为基础的治疗的患者中,MRD阴性、NPM1和 IDH2 突变可独立预测持续无治疗缓解。DDX41 突变患者也对含 VEN 方案反应极佳。未来的前瞻性研究需要确定是否、合适以及哪些患者可以在MRD 阴性缓解后停止治疗。
HMA+VEN后复发很常见,预示着预后极差,mOS仅2-6个月。HMA+VEN后复发的 AML 克隆似乎富集信号通路的激活突变,如 FLT3 和 K/N RAS 或TP53。尽管采用新疗法,TP53突变 AML 患者的临床结局仍极差,且与年龄、治疗强度或 TP53 变异等位基因频率无关。除突变外,其他抗凋亡蛋白(如 MCL-1 和BCL-XL)的上调也与 VEN 耐药相关,并且在单细胞AML中似乎上调。许多单核细胞分化的 AML 患者表现出更大的 VEN 耐药性,且单核细胞亚克隆在含VEN治疗后复发时也更容易扩增、缺乏 BCL2 表达。更好地了解原发性或获得性 VEN 耐药的通路,对开发新的治疗和/或指导后续治疗线至关重要。
AML 对 HMA+VEN具有独特的耐药和反应模式,因此需要修改风险分层模型,以更好地预测该人群的结局。最近的ELN建议主要是基于接受 IC 治疗的年轻患者的数据进行验证,无法预测接受HMA+VEN治疗的患者的结局,从而导致一种称为分子预后风险特征 (mPRS) 的新分层模型的创建和验证,该模型根据N/KRAS、FLT3-ITD和 TP53 突变对接受 HMA/VEN 治疗的患者进行分层。该模型将患者分为高、中和低获益组,可准确反映HMA+VEN治疗人群的不同缓解率、mOS、EFS和复发。另一项研究确定了预测HMA+VEN缓解的基因型特征,CR/CRi的良好预测因子为NPM1、IDH2和 DDX41 突变,而TP53、FLT3-ITD、和 RUNX1 为不良因素;携带不良突变且无良好突变的患者 CR/CRi 率为36%,携带良好突变且无不良突变的患者 CR/CRi 率为91%。
艾伏尼布用于IDH1突变AML
对于 IDH1 突变患者,艾伏尼布(IVO)已获批联合AZA用于一线治疗。6%-10%的 AML 患者存在IDH1突变,并导致产生肿瘤代谢产物2-羟基戊二酸 (2-HG),从而导致 DNA 超甲基化和分化抑制。除AZA+IVO外,IVO单药治疗也可考虑用于新诊断不适合IC的 IDH1 突变患者。
试验性减低强度治疗
其他含VEN的方案
ASTX727(DAC和cedazuridine)是一种口服制剂,为地西他滨联合增效剂,已获批用于治疗骨髓增生异常综合征,其曲线下面积与IV DAC相似。基于一项 II 期研究,ASTX727 +VEN可能是期望全口服方案的患者的合适选择(表3)。正在对维奈克拉和阿扎胞苷口服制剂开展类似研究 (NCT05287568;NCT04887857)。
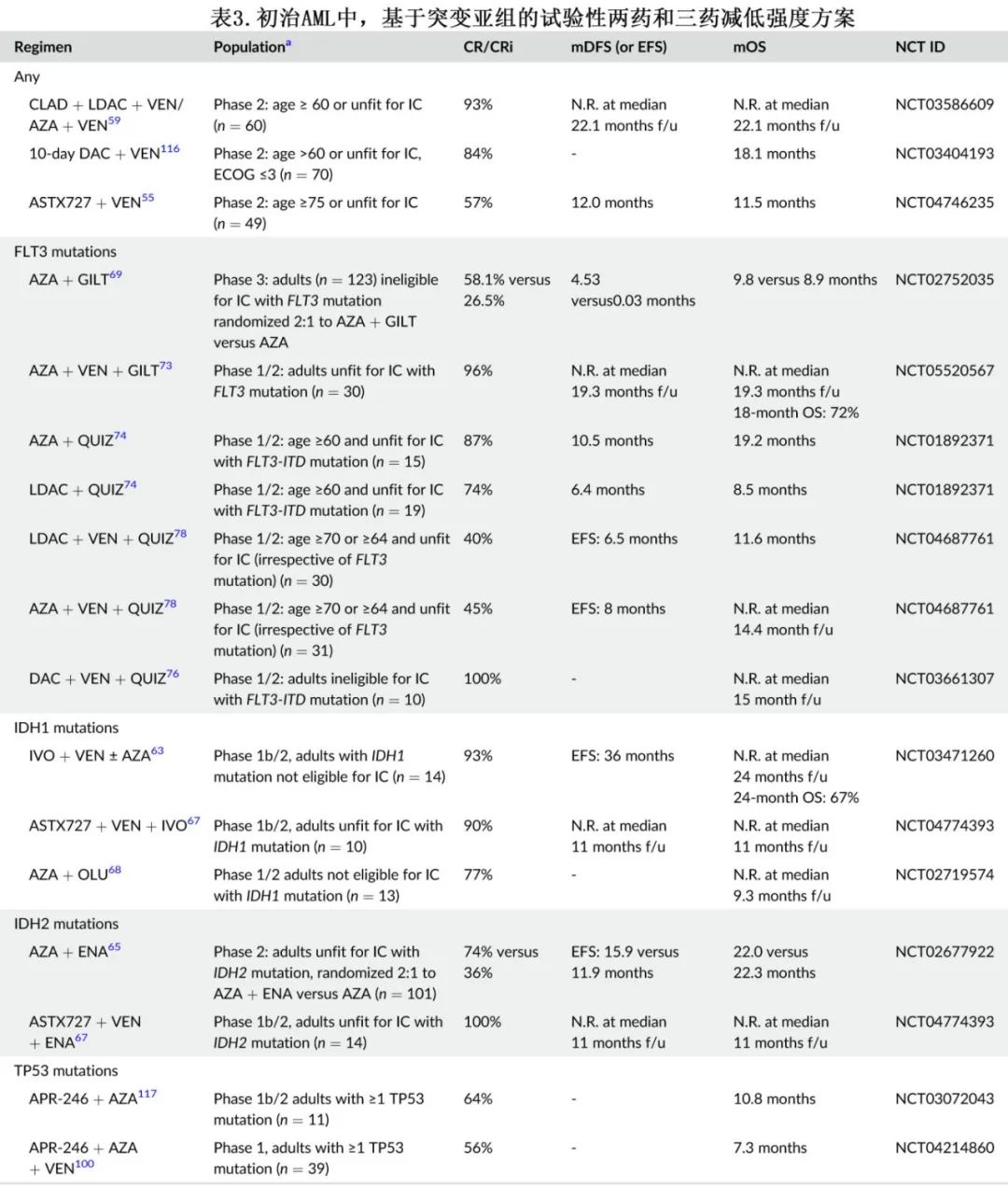
在LDAC/LDAC +VEN骨架中添加克拉屈滨与HMA +VEN交替给药在改善结局方面也显示出显著前景。CLAD + LDAC + VEN交替AZA + VEN可获得一线 LIT 的最高 CRc 率之一(表2的参考文献59)。CLAD + VEN + LDAC可能是单核细胞疾病或 RAS 突变的临界fit合患者的更好 LIT 选择,这些患者HMA +VEN治疗的缓解时间较短。
IDH1和IDH2突变
含HMA + VEN + IDH抑制剂的方案目前正处于临床试验阶段,以探索三药治疗是否可以克服固有和/或获得性耐药机制。临床前模型表明,IDH抑制剂可以与 VEN 协同作用。肿瘤代谢产物 2-HG 的积累增加促凋亡激活蛋白表达,增加对 BCL-2 的依赖性。因此IDH抑制剂可增强对 VEN 的易感性。
一项 1b 期研究评估了VEN + IVO±AZA治疗IDH1 突变髓系肿瘤,证实三药方案可改善OS。由于信号传导(例如RAS)和 IDH 突变分别是维奈克拉和单药 IVO 耐药的最常见机制,因此三药联合治疗可能是规避耐药通路的策略。
对于新诊断IDH2 突变 AML 患者,enasidenib(ENA) 联合治疗时观察到相似结果,包括ENA + AZA。此外还报告了VEN + ENA + AZA三联治疗小部分复发性/难治性 (R/R)AML 患者。
ASTX727 联合 VEN 和 IVO 或 ENA 的全口服三药方案试验正在一线和 R/R 中进行,10%的患者发生分化综合征。还前需要更长时间的随访来确定缓解持续时间和生存期。
一种新的 IDH1 抑制剂 olutasidenib(OLU) 单药或联合AZA治疗AML 和 MDS的首次人体 I 期研究也显示可喜结果。随着新一代药物的开发,需要进一步的研究来评价 IDH 抑制剂之间的其他临床差异。
FLT3突变
虽然目前尚未证实 FLT3 抑制剂在不适合 IC 患者的一线治疗中的作用,但仍有正在研究的联合治疗。吉瑞替尼(GILT) + AZA对比 AZA 治疗未经治疗的 FLT3 突变 AML 成人患者的随机 III 期试验因无效而提前关闭。GILT + AZA组的 CRc 率更高 (59.1%vs. 26.5%)但未转化为 OS 改善(9.8 vs. 8.9个月,p=0.753);但当按 FLT3 等位基因比率 (>0.5) 分层时,两药方案具有6.3个月的 OS 获益。鉴于AZA + VEN治疗的 FLT3-ITD 突变 AML 患者的 mOS 为9.9个月,这重新激发了人们对AZA + VEN + GILT三联治疗方案的兴趣,特别是 FLT3 驱动的复发在含 VEN 治疗中很常见;一项 I/II 期研究中AZA + VEN + GILT治疗的 CRc 率高达96%,中位随访19.3个月时未达到中位无复发生存期和OS。该本研究使用第14天骨髓活检确定 VEN 持续时间以减轻骨髓抑制,但感染和发热性中性粒细胞减少症仍极为常见(分别发生率为62%和38%),因此需要持续评估和确认三药方案的给药方案。
奎扎替尼 (QUIZ) 是二代2型 FLT3 抑制剂,现已获批作为 FLT3-ITD 突变患者的一线 IC 联合治疗。早期研究探索了LDAC+QUIZ或AZA+QUIZ。对含 QUIZ 的三药方案的兴趣也在增长,作为对抗耐药机制的潜在机制。含VEN + DAC的 QUIZ 三药方案的CRc 率>90%,中位 OS 未达到。比较 FLT3 两药和三药方案的回顾性分析也证实三药方案的 CR 率、CRc率、FLT3阴性率更高,mOS更长。需要更多的时间来了解如何调整剂量和给药方案,以优化治疗获益并将骨髓抑制降至最低。
NPM1突变、KMT2A重排和menin抑制剂的未来
高达30%和5%的成人 AML 患者存在 NPM1 突变和赖氨酸甲基转移酶 2a 重排 (KMT2Ar),这两种基因改变可通过同源盒 (HOX) 基因的异常表达驱动白血病转化,导致分化受阻。Menin是 KMT2A 与 HOX 基因启动子结合的必需致癌辅因子。临床前研究表明,在 KMT2Ar 和 NPM1 突变的白血病模型中,阻断 Menin-KMT2A 相互作用可下调 HOX 并诱导分化。
目前正在对至少7种不同的小分子 menin 抑制剂进行临床研究,用于 R/R患者中的单药治疗或与 IC 或 LIT联合治疗。其中两种 menin 抑制剂revumenib(SNDX-5613)和ziftomenib(KO-529)是开发中最靠后的,已获得 FDA 指定用于 R/R NPM1 突变或 KMT2ArAML 患者的突破性疗法。AZA + VEN +revumenib和7 + 3 + ziftomenib一线治疗的CRc率均为100%。Zifotmenib联合VEN、VEN + AZA和吉瑞替尼的 I 期研究正在进行中。由于这些早期试验的结果非常有前景,menin抑制剂将可能进一步改变适合患者的治疗,尤其是预后特别差的 KMT2Ar 患者。
TP53突变AML
TP53 突变 AML 已成为特别关注的治疗靶点,由于缺乏疗效或毒性,既往许多旨在改善该人群结局的尝试均告失败。MCL-1上调是 VEN 耐药的重要机制,尤其是在 TP53 突变患者中,但MCL-1抑制剂 AZD5991 的首次人体研究因毒性和低反应率而终止。Magrolimab是一种靶向抗吞噬分子 CD47 的单克隆抗体,最初在早期试验中似乎是一种有前景的治疗选择,但在一项 III 期研究中,magrolimab + AZA + VEN与AZA + VEN相比死亡风险增加且疗效无改善,遂停止进一步开发。
Eprenetapopt(APR-246) 是一种将突变的 TP53 恢复到野生型活性的分子,可重新激活其促凋亡功能。虽然在 TP53 突变 MDS 的 III 期试验中,eprenetapopt + AZA联合给药未显著改善 CR 率,但在 AML 中使用 eprenetapopt 联合AZA + VEN三药治疗的研究可能更有前景。
其他策略试图利用免疫系统,因为 TP53 突变与白细胞浸润和炎性细胞因子增加相关。Sabatolimab是人粘蛋白结构域-3(TIM-3) 的单克隆抗体,是 T 细胞和白血病原始细胞上的抑制性受体,通过检查点调节促进免疫耐受。sabatolimab + AZA用于不适合 IC 的新诊断 AML 患者1b期研究疗效良好。Sabatolimab +VEN + AZA的三药方案正在研究,但并不只针对 TP53 突变的 AML 患者。PD-1抑制剂纳武利尤单抗联合DAC + VEN治疗新诊断TP53 突变 AML 患者的临床试验也正在进行中。总的来说,TP53突变AML仍需要更有效的疗法。
治疗持续时间
VEN 持续时间的优化是另一个关注领域,因为骨髓抑制和血细胞减少相关并发症(如中性粒细胞减少性发热和感染)仍然是其最大风险。研究证实14天、21天和28天VEN治疗的CRc率相当且中位 OS 无差异,包括ELN高危患者中。也有研究认为新诊断 AML 患者接受7天 AZA 和7天VEN(7+7方案)治疗的结果优于VIALE-A研究。
许多三药研究在第14-21天进行骨髓活检,一旦原始细胞<5%则立即停用VEN,旨在缩短 VEN 持续时间(如果达到形态学缓解),以尽量减少骨髓抑制和毒性。事后和真实世界研究未显示这些方案的劣效性。目前正在进行一项 AZA 联合28天或14天 VEN 的前瞻性随机 II 期试验,将为 VEN 的理想持续时间提供有价值的信息。
生活质量和异基因干细胞移植
与接受AZA +安慰剂治疗的患者相比,接受VEN + AZA治疗的患者的总体健康状况、身体功能和疲乏 PRO TTD 显著延长,表明添加 VEN 可带来更长的功能和总体健康状况。
保持fitness很重要,因为接受一线 LIT 治疗的患者可能仍有资格接受异基因干细胞移植 (alloSCT),且研究证实可改善OS。未来的研究需要完善哪些患者人群从一线 LIT 后alloSCT 获益最大。
结论
在过去十年中,靶向治疗药物的扩展显著改变了 AML 减低强度治疗的前景。随着继续完善这些方案并发现新的潜在靶点,了解白血病驱动突变和复发的分子机制也将变得越来越重要。三药方案(或序贯两药方案,以尽量减少毒性)可能是对抗白血病耐药和逃逸通路的一种有前景的策略。探索巩固治疗周期内给药方案和剂量调整的前瞻性研究具有重要的临床意义。尽管有许多新的有前景的试验用药物正在开发中,但某些患者人群(如 TP53 突变AML)仍非常需要有效的治疗。无论如何,在一线减低强度治疗中观察到的总体进展,例证了精准医疗如何为老年或unfit AML 患者设计有效、安全的治疗方案。
参考文献
Marvin-Peek J,et al.Frontline therapy of acute myeloid leukemia with lower intensity regimens: Where are we now and where can we go?Am J Hematol . 2024 Jul 17. doi: 10.1002/ajh.27434.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)