首页 > 医疗资讯/ 正文
心输出量监测——有创与无创
重症行者翻译组
目的
本文的目的是综述当前各种用于监测心输出量的技术及其在危重病人中的效用。
近期研究结果
基于心输出量测量的方法,监测心输出量的设备可分为有创、微创和无创三大类。所有的设备都有其优缺点,其中,肺动脉导管是监测心输出量的金标准。有创技术测量的心输出量更为准确,而其有创性可导致更多并发症。无创监测的方法则通过一些假定建立的数学模型来预测心输出量,因此在临床实际中更易出现误差。近期,肺动脉导管再次回归至临床实践中,尤其是在心脏重症监护室中。重症超声心动图是一个即将问世的工具,它不仅可以提供CO,还可以帮助鉴别诊断。缺乏适当的培训和无法获得设备是CCE广泛应用的主要障碍。
小结
通过肺动脉导管热稀释仍是测量心输出量的金标准,最适合于有心脏病的患者和有经验的操作者。重症超声心动图为热稀释法提供了一种替代方法,适用于所有的ICU;但是,需要进行系统性培训。
要点
!有创、微创和无创设备均可用于重症监护病房的心输出量的测量。
!与其他方法相比,在准确性方面肺动脉导管热稀释法仍然是金标准,是心脏监护室心输出量监测的选择。
!有创方法比无创方法更准确。
!重症超声心动图(CCE)不仅是一种无创技术外,也是准确的,但高度依赖于操作者。在未来,CCE可能成为所有ICU内心输出量监测的首选方式
引言
危重患者的心输出量(Cardiac output, CO)监测已经成为必要的诊断和管理工具,特别是在混合性休克时。不管是无创或有创,各种监测方法都有其优缺点。在重症监护室中,应用大量血管活性药物或血管受损时,毛细血管再充盈可能并不是反映全身灌注充足的良好指标。此外,如乳酸、混合静脉饱和度等实验室参数不能帮助区分不同类型的休克。此时,心输出量监测可能是有益的。
本文将综述目前可用于监测CO的技术及其在各种情况下的临床疗效。一般来说,这些方法可以分为:有创、微创和无创三类。
有创方式
肺动脉导管热稀释法
肺动脉导管(Pulmonary artery catheter, PAC)自20世纪70年代首次推出后就因其广泛多样的血流动力学数据而普遍应用。近年来,来自ICU的一些研究结果显示PAC并未在生存及报导的并发症方面获益,故PAC的受欢迎程度有所下降。
近期,PAC在ICU中的应用被重新重视,其实用价值在特定的危重病人中再次得到了体现,如右室功能障碍、肺动脉高压(pulmonary artery hypertension,PAH)、左室功能障碍和混合性休克。此外,通过增加右室开口、连续CO监测(continuous CO monitoring,CCOM)、导管尖端的混合静脉血氧饱和度(mixed venous saturation,SvO2)感受器以及临时起搏等大大增加了PAC的应用效能。导管的右心室开口使得右心室和肺动脉压力波形能够同时显示。右室舒张末压力和肺动脉舒张末压的重叠是右心室失代偿的最早期的指标。
快速CCOM监测的显著优势在于可连续监测多个高级血流动力学参数,包括每20秒测定的的CO、每搏输出量(stroke volume,SV)、SvO2、体循环阻力(systemic vascular resistance,SVR)和右室射血分数(RV ejection fraction,RVEF),同时,由于其使用了加热导丝来加热血流,并通过快速反应热敏电阻测量PAC尖端的血液温度变化,可避免过量的冰盐水的输注。PAC已经成为心脏外科ICU鉴别混合性休克的首选方法。
对所获数据的错误解读是PAC相关并发症的主要因素。应对重症监护医师进行PAC血流动力学参数和波形分析的培训。由于PAC是在右心室测得心输出量,因此当存在心内分流和三尖瓣病变时,测得的CO不能代表左室的CO。在通过注射冰盐水进行的间断CO监测时,注射液的温度、注射量以及与呼吸周期相关的注射时机是常见的误差来源。因有有肺动脉破裂的案例报道,因此不推荐对存在PAH和严重二尖瓣反流(mitral regurgitation,MR)的患者使用导管楔入。严重二尖瓣反流时,肺动脉楔压(PAWP)曲线的v波酷似肺动脉波形,如果忽略了峰压的持续时间,很可能将楔压误认为是肺动脉压(PAP)。
经肺热稀释法(Transpulmonary thermodilution,TPT)
21世纪初,两家公司引入了经肺热稀释法(Transpulmonary thermodilution , TPT)作为肺动脉导管热稀释法的替代方法:PiCCOplus(Pulsion Medical Systems, Germany)和EV1000/ VolumeView(Edwards Lifesciences, Irvine, CA, USA)。引入TPT最重要的目的是在复杂性休克的患者中通过PAC获取危重病患者的精确参数的基础上,同时兼有更简单的操作、更高的安全性和更小的创伤小。通过中心静脉注入冰盐水后,计算机软件通过放置在远端大动脉(股动脉、腋窝动脉或臂动脉)插管上的远端传感器绘制出的热稀释曲线。TPT可以测量CO、胸腔内总血容量(intrathoracic blood volume,ITBV)、全心舒张末容积(global end-diastolic volume,GEDV)、血管外肺水含量(extravascular lung water,EVLW)以及肺血管通透性指数(pulmonary vascular permeability index,PVPI)。
据报道,在ICU患者中,TPT和PAC得出的心输出量具有很好的相关性。通过至少三次的冰水注射测量,TPT可以追踪最低至12%的CO变化。与PAC测量的是右心的CO不同,TPT测量的是左心的CO。但是,当存在严重瓣膜反流、治疗性低体温、回路渗漏、体外膜式氧合(extra corporeal membrane oxygenator,ECMO)、低心排状态(CO<2L/min)时,TPT测量的CO并不准确。由于指示剂的再循环,精确评估肺水肿患者存在困难。TPT也存在其他技术限制,当中心静脉置入与动脉插管同侧的股静脉时会出现串扰现象。最后,TPT的一个重要局限是其间歇性测量,这导致它无法监测CO的短期变化。
微创监测
动脉脉搏分析
脉搏功率分析(锂稀释法)
LidCOplus(LidCO Ltd., Cambridge, UK)通过脉搏CO算法,根据脉搏功率分析以及采用锂稀释法进行初始校准和定期校准以确定连续的实时CO变化。初始校准时,从外周静脉或中心静脉注入氯化锂,通过外周动脉导管上的锂感受器监测记录锂浓度-时间曲线,构造出锂稀释曲线从而计算出CO。当有干预措施影响外周血管阻力或血流动力学发生明显变化时,则需要重新校准。锂稀释法与PAC热稀释法有良好的相关性,且创伤更小。但锂稀释法不能用于以下患者:体重<40kg、早期妊娠(前三个月)、存在主动脉阻断和开放的冠状动脉旁路移植术(coronary artery bypass grafting,CABG)期间、接受锂盐治疗、肾功能衰竭,以及大剂量去极化肌肉松弛剂可能会导致CO被高估。
脉搏波形分析(pulse wave analysis,PWA)
基于PWA方法的商业系统有自动/非校准和外部校准两种类型。VolumeView系统(Edwards Lifesciences, USA)、PiCCO系统(Pulsion Medical Systems, Germany)和FloTrac传感器(Edwards Lifesciences, USA)均为基于有创动脉脉搏波形分析CO监测系统。VolumeView系统和PiCCO使用带有热敏电阻的股动脉导管和中心静脉导管进行TPT CO测量以进行校准。FloTrac则采用另一种方法(例如:超声心动图)测量的CO值进行外部校准。在心律和呼吸模式稳定的患者中,这些方法测量的CO值与PAC相差无几,但在患者需要大量正性肌力药或血管活性药物支持时,这些方法的相关性较差。
经食道多普勒监测(Esophageal Doppler monitoring,EDM)
EDM是20世纪70年代引入的一种用于CO监测的微创技术。利用插入食道的探头发射的超声波采用多普勒原理测量速度时间积分(velocity time integral,VTI)和动脉中红细胞移动速度。因此,超声波束和血流之间的任何角度误差都是潜在的误差来源。VTI、主动脉横截面积(cross-pal area,CSA)和心率三者的乘积即为CO的测量值。CSA可直接从M型超声或年龄、身高和体重获得。
数据表明,EDM可以减少术后并发症、住院时间和中心静脉置管,因此国家健康与临床优化研究所(The National Institute for Health and Clinical Excellence,NICE)的指南支持使用EDM来评估初级、复杂和高风险外科手术中的CO。EDM的局限性包括:与操作者有关的结果变异性达10-12%、主动脉CSA可变性可能导致不正确的计算,在血流动力学不稳定的患者中,主动脉近端和远端之间血流恒定这一假设可能是错误的,并且当探头错位超过20°时,精确性较差。
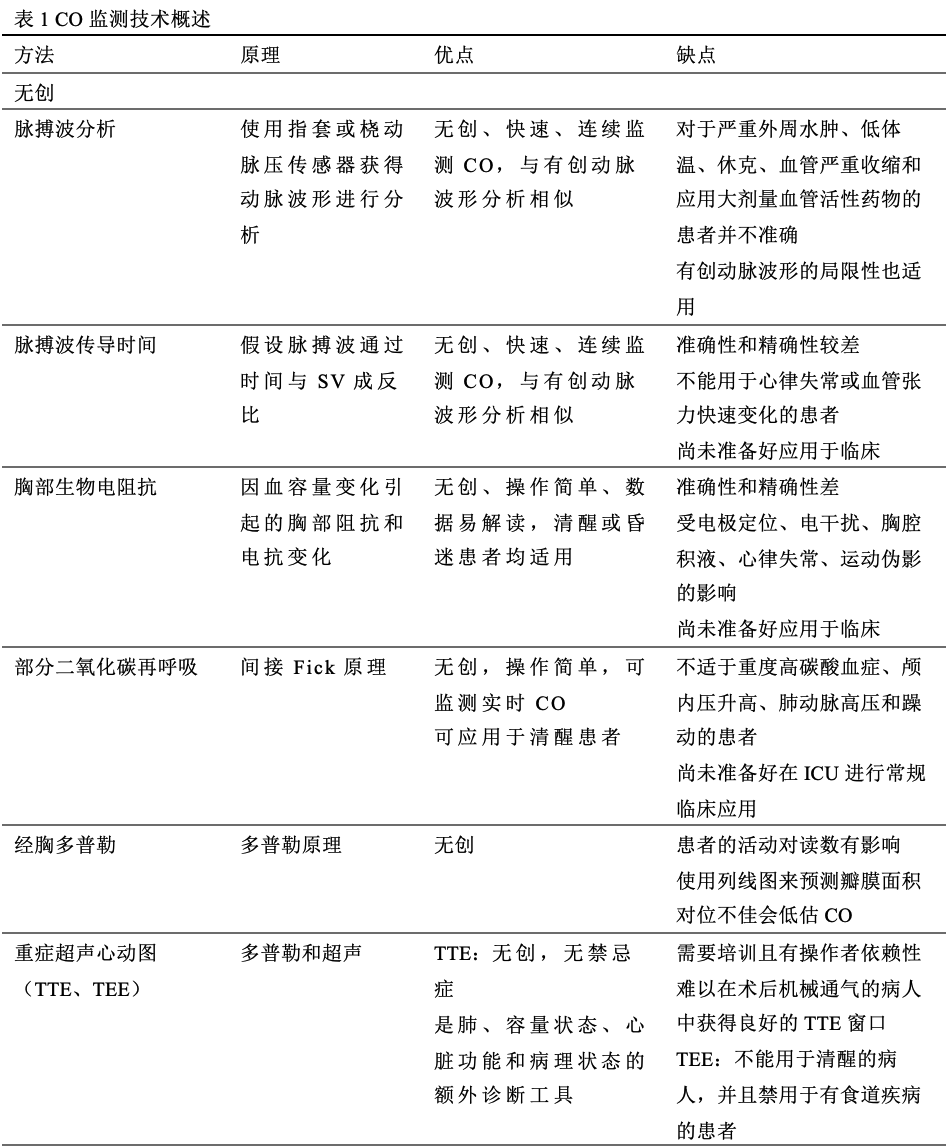
无创监测
脉搏波分析(Pulse wave analysis,PWA)
无创PWA利用体表传感器连续记录动脉脉搏波形,并像有创脉搏波形分析一样,利用基于算法的内部校准连续估测CO。无创PWA系统既可使用袖套的容积钳方法,也可使用放置于桡动脉上方皮肤上的自动桡动脉压传感器。
容积钳法
Clear- Sight系统(Edwards Lifesciences, Irvine, CA, USA)和CNAP系统(CNSystems Medizintechnik, Graz, Austria)是通过手指钳夹系统分析动脉脉搏波形,并结合生物学和人口学统计数据的算法来估测CO。使用充气式指套和红外体积描记器,间接连续构建血压波形,并使用PWA进行分析,以计算出CO。
对于严重水肿、低体温、循环休克、血管严重收缩和应用大剂量血管活性药物的患者,因其血压波形的记录并不完美,所以容量钳积法测量的CO并不准确。
自动桡动脉扁平张力法(Automated radial artery applanation tonometry)
T-Line系统(Shanshi Medical, Shangqiu,中国)和DMP-Life系统(DAEYOMEDI Co., Ansan,韩国)利用这一原理,通过可使动脉扁平的传感器(如:扁平器),从走行在骨性结构上的浅动脉获得血压波形,继而使用PWA分析由此获得的动脉压力波形,以推算CO。T-Line系统使用了一个包含在手环中的传感器,该传感器可以机械地调整传感器的位置,而DMP-Life系统使用了一组压阻式半导体传感器。CO的测量依赖于探头在动脉上的正确定位,即使是轻微的运动伪影也会导致读数错误。
最近的一项关于成人手术或危重患者使用连续无创指套技术得出的CO与推荐的有创CO测量方法的一致性的系统综述和meta分析表明,使用无创指套技术和推荐的有创方法测量得CO不能互换。在危重患者中,由于血管舒缩张力变化显著,内部校准或未校准的PWA系统测量的CO可能因此而变得不可靠。另外,危重的休克患者都会放置动脉导管,所以无创PWA系统也不被推荐。
胸部生物电阻抗
生物阻抗技术基于胸廓阻抗随时间变化与每搏量成正比的假设来计算CO。施加的高频电压和检测到的电压之间的差异被用来确定经胸阻抗的变化。生物电抗是生物阻抗的一种改进,它可以测量流经胸腔的振荡电流的相移。这些相移只发生在脉动流中,不受胸腔积液量的影响,因此提高了信噪比。
与基于热稀释的连续CO监测相比,对气管插管心脏手术的患者采用生物阻抗法进行CO测量,无法获得可接受的准确性和趋势预测能力。最近的一项荟萃分析发现,生物阻抗的一致性不高且存在高误差百分比,使其准确性受到质疑。由于误差百分比较大,完全无创CO装置与热稀释不能互换。其他设备的电干扰和肺水的增加导致这些设备无法测量危重患者的CO,以致其在ICU无法广泛应用。
在手术患者中,通过生物电抗获得的SV值与食管多普勒获得的值在临床上和统计学上均不具有可接受的一致性。NICOM研究专门评估了生物电抗在心源性休克患者中的应用,与Fick和PAC热稀释相比,彼此之间的相关性较差。生物电抗不佳的相关性可能与心源性休克患者的胸水过负荷和低流量状态有关,影响了阻抗的测量。
脉搏波传导时间(Pulse wave transit time,PWTT)
PWTT是指从心电图上的R波到脉搏血氧仪测定的脉搏波上升点之间的时间。esCCO技术(Nihon Kohden, Tokyo, Japan)通过分析心电图、脉搏血氧计导出的波形和动脉压,提供无创的连续CO读数。
在接受心脏手术和肝移植手术的患者中,尽管esCCO具有合理的趋势预测能力,但与有创TPT CO监测相比,esCCO的准确性和精度较差,在这些患者中,监测CO在临床决策中是很有价值的。同样地,在ICU患者中,esCCO不能跟踪由前负荷增加或血管舒缩性变化引起的CO变化。
二氧化碳部分再呼吸
该方法利用修正的Fick原理,以呼末二氧化碳为指标计算CO。NICO (Philips Respironics, Eindhoven, Netherlands)和INNOCOR (Innovision ApS, Glamsbjerg, Denmark)采用了这种技术。一项验证性研究和一项meta分析报告的百分比误差为40-49%,这使得它们不适合在重症监护室的临床应用。不稳定的呼吸状态(部分机械通气支持)、气道密闭不足、肺内分流、肺不张和严重的气体交换异常都会影响其测量,而这些都存在于ICU患者中。
经胸多普勒
USCOM ( USCOM Ltd., Sydney, Australia) 是一种无创的连续波多普勒监测器,可通过应用于胸骨上切迹(经主动脉血流,左心CO)或胸骨左缘(经肺血流,右心CO)的探头来测量CO。由此得到的流量曲线VTI乘以目标瓣膜的CSA,用于计算SV。该设备附带的软件包含根据高度指数回归方程估计瓣膜CSA的列线图。一项对10项研究的荟萃分析发现,与弹丸式热稀释法相比,USCOM获得的合并加权百分比误差为42.7%。与热稀释法的一致性百分比误差未达到可接受的精度标准±30%。USCOM没有达到与弹丸式热稀释法一致的±30%的百分比误差,而这是精确度是可接受的标准。在一项观察性研究中,USCOM与ICU患者的超声心动图测量的SV有很强的相关性,这意味着CO的测量可能与操作者有关。
重症超声心动图
近年来,超声心动图已成为ICU实时血流动力学监测的重要床边工具。重症超声心动图(CCE)既可作为诊断工具,也可作为CO监测仪器。经胸超声心动图(TTE)是最常用的方法,而经食管超声心动图(TEE)在插管和机械通气患者中尤为有用。CCE可用于测量CO,并可靠地跟踪其变化。但可靠地使用这些工具使用需要训练有素的临床医生。
在重症妊娠患者中,TTE的CO测量结果与PAC获得的结果有很好的一致性。在危重的机械通气病人中,TTE是估计CO的准确方法,与PAC测量的结果显著相关,误差百分比为 25%。鉴于其无创性和有效性,TTE可为为未来验证其他监测CO技术的参考。
在标准的基础TTE培训基础上,增加侧重于多普勒和VTI测定的专门培训,可使非心脏病专科的ICU医生能够对大多数机械通气的患者进行快速、可重复和准确的CO评估。与PAC相比,CCE有许多优点,但依赖于操作者。因此,对于需要高级血流动力学监测的脓毒性休克患者,CCE可以作为PAC的补充,但不是唯一。CCE认证由美国超声心动图学会提供,尽管超声在ICU的应用越来越广泛,但大多数国家缺乏正式的培训计划和明确定义的CCE资质。最近,欧洲重症医学会(ESICM)发布了关于重症超声核心能力的建议,作为多学科重症护理专业培训的一部分。
由于CO是一个动态性较高的变量,在宽泛的正常范围内迅速变化,因此各种监测CO的设备的比较复杂。因此,临床医生必须了解CO监测设备的基本原理,以了解其临床适用性和固有的局限性。此外,临床医生应认识到如何根据参考方法来评估一种新的监测技术的基础。
结论
PAC热稀释法仍然是测量CO的金标准,它正在重新回到临床实践中,特别是在心脏重症监护室。CCE是一种独特的无创方法,其准确性、无创性和鉴别诊断价值为热稀释提供了一种替代方法。另外大多数无创监测方法需要进一步证明其准确性和可靠性,以便在常规治疗中推荐
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)