首页 > 医疗资讯/ 正文
引言
在现代生物医学研究中,基因工程的技术不断进步,为我们解开生命科学的诸多奥秘提供了强大的工具。最近,一个引人注目的实验成果在Nature Communications上发表(“Tgfbr1 controls developmental plasticity between the hindlimb and external genitalia by remodeling their regulatory landscape”),研究人员成功地创造了一种六腿小鼠胚胎,这一发现不仅令人惊讶,也为我们进一步理解生物体发育过程中基因路径(gene pathway)的作用提供了宝贵的信息。这项研究由来自葡萄牙奥埃拉斯的古尔本基安科学研究所(Gulbenkian Science Institute)的发育生物学家莫伊塞斯·马洛(Moisés Mallo)及其团队领导,他们通过在发育中期关闭特定的基因Tgfbr1,观察到了小鼠胚胎脊髓发育的变化。
不同于常规的四肢小鼠胚胎,这个经过基因修改的胚胎拥有两个额外的后肢,而且这两个额外的肢体并非长在通常的位置,而是位于性器官应出现的地方。这一异常现象引发了研究人员的极大兴趣,进一步的研究发现,Tgfbr1基因通过改变胚胎原始结构中DNA的可及性来指导这些结构发育成外部生殖器(如阴茎或阴蒂)或是四肢。这一发现揭示了DNA可及性在生物体发育中的重要作用,为我们提供了一个全新的视角来理解复杂的生命过程。
此外,研究团队还希望进一步探索Tgfbr1及其相关蛋白如何在其他系统中影响DNA开放状态,比如在转移性癌症和免疫功能中的作用。他们还在研究这一机制是否同样适用于爬行动物的双头阴茎(一种在没有后肢的蛇类中形成的双重阴茎)的发育。
这一研究不仅展示了基因工程在解决复杂生物学问题上的潜力,也为未来的医学研究,如癌症治疗和再生医学等领域,提供了新的思路。通过进一步的研究,我们有望解锁更多生命科学的秘密,为治疗各种疾病提供更有效的方法。(3月28日 Nature “Scientists made a six-legged mouse embryo — here’s why”)
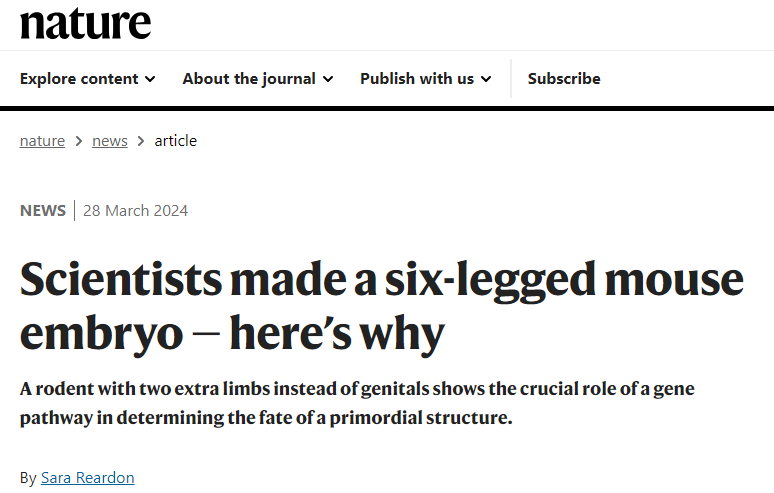
在胚胎发育过程中,后肢和外生殖器被认为是从一个共同的原基(primordium)演化而来,这个原基能够生成适应特定生态位(ecological niche)中高效运动和交配的多样化结构。研究显示,尽管从祖先条件演化而来的距离很长,但小鼠外生殖器的早期原基仍保留了采取后肢命运的能力。在没有Tgfbr1的情况下,围肛中胚层(pericloacal mesoderm)会产生额外的一对后肢,而不是外生殖器。
Tgfbr1基因与胚胎发育
Tgfbr1基因是转化生长因子β (Transforming Growth Factor Beta, TGF-β) 受体家族的一员,它在胚胎发育中扮演着至关重要的角色。Tgfbr1通过调控细胞的增殖、分化、迁移和凋亡,影响了包括神经系统、心血管系统、肌肉骨骼系统在内的多个器官和组织的形成。
在胚胎发育的过程中,Tgfbr1特别重要的一个功能是参与体节(segmentation)的形成和后体轴的延伸。研究表明,Tgfbr1通过调控神经中胚层(neuromesodermal)前体细胞的命运,影响脊柱和肢体的发育。此外,Tgfbr1还参与调控胚胎发育中的细胞命运转换(cell fate transition),如由躯干(trunk)向尾部(tail)的转变,这一过程涉及到复杂的基因调控网络。
特别地,Tgfbr1在调控后肢(hindlimb)和外生殖器(external genitalia)之间的发育塑性上发挥着重要作用。在小鼠胚胎发育的研究中发现,Tgfbr1缺失会导致周围肛门(pericloacal)中胚层产生额外的后肢而非外生殖器。这一现象揭示了Tgfbr1在通过重塑调控区域(regulatory landscape)来控制基因调控网络,从而决定细胞命运和组织发育方向的机制。
此外,Tgfbr1还与其他生理和病理过程有关,包括心脏发育(heart development)、肿瘤形成(tumorigenesis)和组织纤维化(tissue fibrosis)。了解Tgfbr1在胚胎发育中的作用不仅有助于揭示生命早期发育的基本原理,也为相关疾病的治疗提供了可能的靶点。

Highlights
该研究揭示了Tgfbr1在胚胎发育中的一个新角色,特别是在控制后肢与外生殖器(regulatory landscape of hindlimb and external genitalia)之间的发育可塑性方面。
后肢与外生殖器发育的可塑性:这项研究首次发现,Tgfbr1通过调节染色质的可及性(chromatin accessibility),在小鼠胚胎的后肢和外生殖器之间建立了一个发育上的可塑性,这一发现为理解这些结构如何在进化过程中分化提供了新的视角。
Tgfbr1的调控机制:通过ATAC-Seq技术,研究者揭示了Tgfbr1如何影响特定基因的表达,通过改变调控元件(regulatory elements)的可及性来控制细胞命运的决定。这一机制的发现为理解Tgfbr1如何在更广泛的生物学过程中发挥作用提供了新的线索。
复杂的调控网络:研究展示了一个复杂的基因调控网络,其中Tgfbr1位于核心,通过影响包括Fgf8、Shh等在内的多个关键发育信号通路的成员,从而控制胚胎发育的关键过程。这强调了在发育生物学中解析这种复杂网络的重要性。
这项研究有效地结合了多种高通量技术,如原位杂交(in situ hybridization)、活性染色(β-galactosidase staining)和ATAC-Seq等,展示了现代发育生物学研究中多技术综合应用的力量,为未来的研究提供了重要的方法学参考。
潜在的临床意义:虽然这项研究主要关注基础科学问题,但对Tgfbr1在调控胚胎发育中的作用的深入理解可能对解决一些人类发育异常病症,如尿生殖系统畸形(urogenital malformations)提供新的治疗靶点。
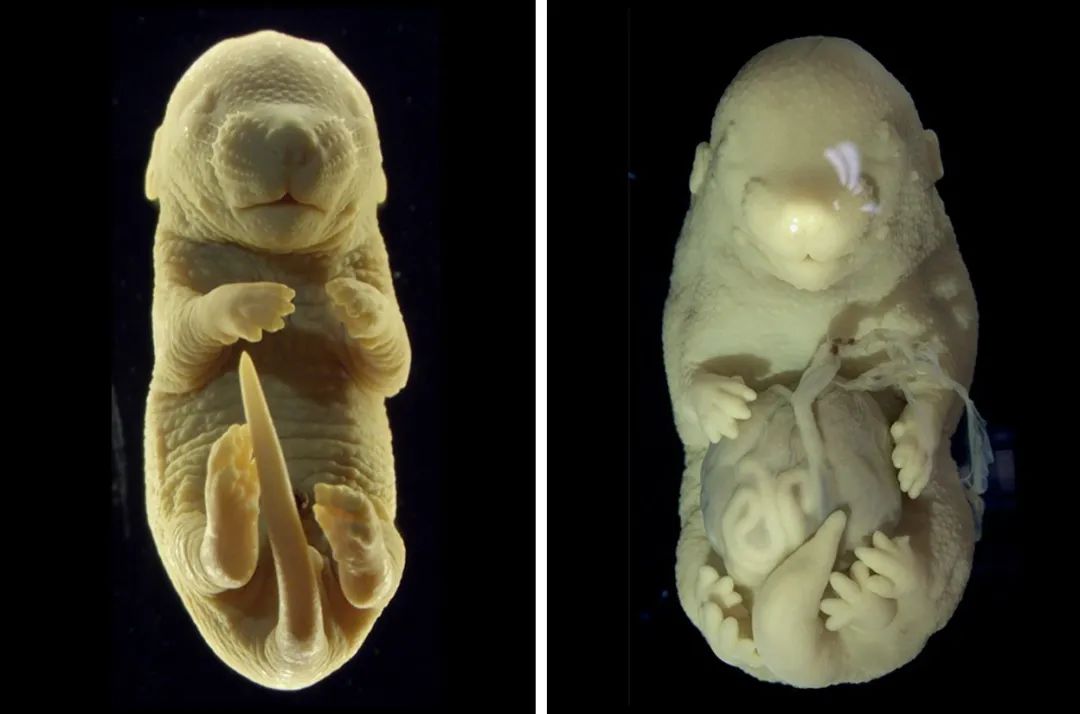
典型的小鼠胚胎有四肢,而在这项研究中,生成了一种异常的小鼠胚胎,这种胚胎具有六肢而不是常规的四肢,并且其几个内脏器官从腹部突出。(Credit: Anastasiia Lozovska et al/Nat. Comms)
Strategies
通过分析Tgfbr1对小鼠胚胎后肢和外生殖器发育的影响,探讨了Tgfbr1如何通过重塑它们的调控网络控制发育的可塑性。首先,研究人员利用条件性Tgfbr1敲除模型(Tgfbr1-cKO)来研究Tgfbr1缺失对胚胎后肢和外生殖器发育的影响。通过对这些敲除胚胎的表型进行详细的描述和分析,发现Tgfbr1的缺失导致了外生殖器区域产生额外的后肢结构。
为了更深入地理解这种现象背后的分子机制,研究人员采用了一系列分子和遗传学的技术。首先,通过原位杂交(whole mount in situ hybridization)技术检测了一系列关键发育基因在Tgfbr1-cKO胚胎中的表达情况,从而确定了Tgfbr1对这些基因表达调控的影响。接着,使用活性染色法(β-galactosidase staining)来追踪报告基因的表达,进一步验证了这些调控关系。
通过高通量染色质可及性测定(ATAC-Seq)技术,以揭示Tgfbr1缺失如何影响后肢和外生殖器发育区域染色质的开放性和调控元件的可及性。通过对ATAC-Seq数据的深入分析,研究人员能够确定那些由于Tgfbr1活动而变得开放或抑制的调控元件,揭示了Tgfbr1是如何通过改变这些调控元件的可及性来控制细胞命运决定的。
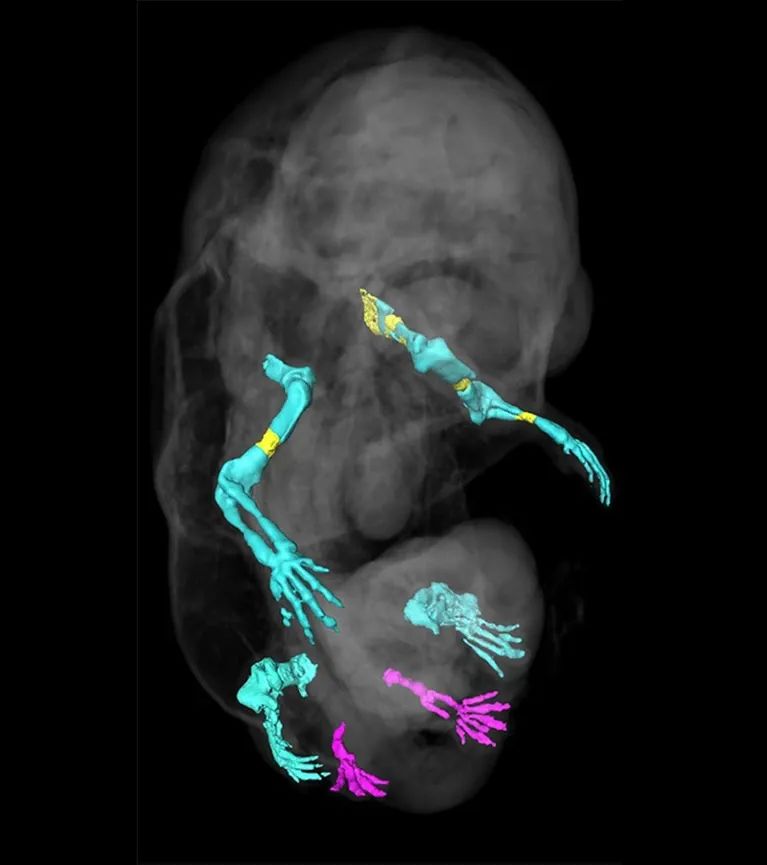
对这个遗传改变的胚胎的骨骼进行了三维重建,显示了它的额外肢体和正常肢体(分别为洋红色和绿松石色)(Credit: Anastasiia Lozovska et al/Nat. Comms
Behind the Scenes
围肛中胚层(pericloacal mesoderm)的发育可塑性
围肛中胚层的独特性
围肛中胚层(pericloacal mesoderm)是一种特殊的中胚层组织,位于小鼠胚胎的后端,紧邻未来的泄殖腔(cloaca)区域。这一组织具有生成外生殖器结构的潜力。然而,在Tgfbr1条件性敲除(cKO)的胚胎中,这一区域被观察到可以产生额外的后肢结构,而非其原本的外生殖器命运。这一现象揭示了围肛中胚层在发育过程中的显著可塑性,意味着在特定的分子和细胞环境中,这一组织能够重新获得生成肢体结构的能力。
细胞亲和性的差异
细胞亲和性(cell affinity)是指细胞间相互吸引或排斥的能力,这影响了细胞聚集和组织形成的过程。在Tgfbr1-cKO胚胎中,虽然围肛中胚层和体节后肢原基(somatopleure-derived limb field)最初似乎是被共同诱导形成一个连续的原基,但它们之间的细胞亲和性可能存在差异。这种差异可能阻碍了这两种组织的混合,导致从围肛中胚层发展出的结构保持独立于体节后肢原基形成的正常后肢,从而在Tgfbr1-cKO胚胎中形成两个独立的后肢结构。
后肢与外生殖器的发育连接
在胚胎发育中,后肢和外生殖器通常被认为是来源于共同的原基(primordium)。然而,Tgfbr1的活动可能通过改变围肛中胚层染色质的可访问性,影响到后肢和外生殖器的发育。Tgfbr1可以调节某些关键的调控元件,使得它们对于特定的发育信号变得不再敏感或过度敏感,这样就改变了围肛中胚层中的细胞命运,促使它们向后肢的方向发展,而不是形成外生殖器结构。
组织可塑性对进化的意义
围肛中胚层的发育可塑性不仅在胚胎发育中具有重要作用,也可能在物种进化中起到了关键作用。例如,在某些爬行动物,如蛇中,后肢的退化可能与这种可塑性有关;而在某些蜥蜴中,则能够保留后肢结构。Tgfbr1介导的细胞命运改变和调控元件的可访问性调节,可能在这些进化过程中发挥了关键作用,影响了后肢和外生殖器的发育和演化路径。
Tgfbr1对染色质调控景观(chromatin regulatory landscape)的影响
通过ATAC-seq(测序)分析,该研究揭示了Tgfbr1如何在小鼠的pericloacal mesoderm中改变基因调控网络,促进了后肢的形成而非外生殖器的发育。
通过主成分分析(PCA)和层次聚类分析,研究团队发现了Tgfbr1调控下的基因表达模式变化。他们发现某些染色质区域在Tgfbr1作用下开放性增加,这些区域可能是控制肢体命运的关键调控元件。另一方面,一些原本在正常情况下参与外生殖器发育的染色质区域在Tgfbr1缺失的条件下开放性降低,暗示着这些区域在控制外生殖器形成中的重要作用。
尽管Tgfbr1信号通路的典型下游效应因子Smad在这一过程中并没有直接参与染色质区域的开放性调控,但其他因子如Hoxa13、Hoxd13和Isl1在这一过程中发挥作用。特别是,Tgfbr1可能通过调节这些因子对应的染色质区域的开放性,从而间接影响基因表达和细胞命运决定。
此外,研究还提出了一个模型,其中Tgfbr1通过确定哪些增强子元件(enhancer elements)对调控因子开放或不开放,从而调控pericloacal mesoderm的细胞命运。这种调控模式在解释了后肢和外生殖器共享许多调控输入信号的同时,还能产生如此不同的成熟结构提供了一个机制。
对其他生物系统的潜在影响
Tgfbr1基因及其编码的蛋白质TGF-β受体1 (TGF-β receptor 1) 在多种生物系统中发挥着关键作用,尤其在转移性癌症(metastatic cancer)和免疫功能(immune function)中的影响备受关注。这两个领域的研究揭示了Tgfbr1在细胞信号传导(cell signaling)、组织再生(tissue regeneration)、炎症反应(inflammatory response)等多种生物过程中的重要性。
转移性癌症
在转移性癌症领域,TGF-β信号通路(TGF-β signaling pathway)被认为在癌细胞的侵袭性、迁移(migration)和转移(metastasis)中起着双重作用。一方面,TGF-β在正常组织中通常起到抑制细胞增殖(cell proliferation)的作用,有助于维持组织稳态(homeostasis)。然而,在癌症进展的后期,癌细胞往往获得了对TGF-β抑制作用的抵抗力,TGF-β信号反而促进了癌细胞的侵袭和转移。这种现象被称为TGF-β悖论(TGF-β paradox)。Tgfbr1通过激活下游的Smad蛋白质和其他信号分子,可以调节细胞外基质(cellular matrix)的降解,促进癌细胞的运动性和侵袭性,从而在癌症转移中发挥关键作用。
免疫功能
在免疫系统中,Tgfbr1通过调节TGF-β信号,对免疫细胞的分化和功能产生深远影响。TGF-β是一种多功能细胞因子,能够影响T细胞(T cells)、B细胞(B cells)、巨噬细胞(macrophages)等多种免疫细胞的行为。特别是在调节T细胞分化方面,TGF-β能够促进调节性T细胞(regulatory T cells, Tregs)的生成,这些Tregs通过抑制过度的免疫反应,帮助维持免疫耐受(immune tolerance)和免疫平衡(immune homeostasis)。此外,TGF-β也参与了炎症反应中的抗炎过程,通过抑制促炎细胞因子(pro-inflammatory cytokines)的产生,减少组织损伤。
Tgfbr1及其信号通路在转移性癌症和免疫功能中扮演着复杂而重要的角色。其作用不仅与疾病的发生发展密切相关,还与机体维持正常生理状态的能力相关。这也意味着Tgfbr1及相关信号通路的潜在治疗应用,如在某些情况下抑制TGF-β信号可能有助于抑制癌症的转移,在其他情况下则可能需要激活TGF-β信号以增强免疫调节作用。然而,由于TGF-β信号在不同组织和发展阶段的多样作用,开发针对该通路的治疗策略需要高度的精确性和选择性。
双头阴茎(hemipenes)的发育的启示
该研究中发现的Tgfbr1调控后肢与外生殖器发育的机制可能为理解爬行动物中双头阴茎(hemipenes)的发育提供了一定的启示。爬行动物中的双头阴茎是一种特殊的生殖器官,存在于一些没有后肢的物种中,如蛇类。这种器官的发育可能涉及了与哺乳动物后肢与外生殖器发育中相似的发育可塑性(developmental plasticity)和基因调控网络。
在研究中,Tgfbr1通过改造染色质调控景观(chromatin regulatory landscape),调节了pericloacal mesoderm的细胞命运,促进了后肢而非外生殖器的发育。这一机制表明,Tgfbr1及其下游信号分子能够在发育过程中重塑基因表达,从而影响特定器官的形成。
对于爬行动物双头阴茎的发育,虽然具体的调控机制可能与哺乳动物存在差异,但Tgfbr1信号通路在调节细胞命运和器官形成方面的通用作用可能同样重要。特别是在没有后肢的情况下,Tgfbr1及相关信号通路可能在调节原始器官(primitive organs)如双头阴茎的形成中起到关键作用,例如通过调控与后肢发育共享的基因表达模式,或是通过促进特定细胞群体的分化。
此外,爬行动物双头阴茎的独特发育模式也可能涉及其他特异性的调控因子和信号通路。例如,一些特定的同源框基因(homeobox genes)和生长因子可能在调控这一过程中发挥作用。进一步的研究需要揭示这些信号通路如何在不同生物系统中被共同利用和改造,以适应各自独特的发育需求和生态位。
虽然Tgfbr1调控机制在爬行动物双头阴茎发育中的适用性需要更多的实验数据来证实,但该研究提供的机制可能对理解爬行动物中类似器官的形成提供了有价值的视角。探索不同生物之间共享的调控模式不仅能增进我们对生物多样性的理解,还可能揭示进化过程中保守的发育策略。
研究的意义与影响
该研究通过探索Tgfbr1在调控小鼠后肢和外生殖器之间的发育可塑性中的作用,对遗传学(genetics)、发育生物学(developmental biology)和进化论(evolutionary theory)做出了重要贡献。
在遗传学领域,该研究揭示了Tgfbr1及其信号通路如何通过调控染色质的可访问性(chromatin accessibility)影响特定基因的表达。这种调控机制不仅展示了单个基因如何在复杂的生物学过程中发挥作用,还突显了表观遗传学(epigenetics)在调控基因表达中的重要性。此外,通过揭示Tgfbr1在不同器官发育中的特定作用,该研究也为理解基因如何在特定组织和发育阶段中发挥功能提供了见解。
在发育生物学领域,该研究提供了一个关于Tgfbr1如何通过改造染色质调控景观影响组织发育的案例。这不仅增强了我们对于哺乳动物肢体发育的理解,还揭示了器官发育的深层调控机制。特别是,该研究表明,即使在进化上距离较远的器官(如后肢和外生殖器)之间也存在发育可塑性,这种可塑性由共享的调控网络支持。此外,该研究还强调了调控因子在维持发育稳定性和允许器官多样性中的重要作用。
从进化论的角度看,该研究提供了一个示例,说明单个调控因子如Tgfbr1如何在不同物种和器官中保持其功能的同时,也支持了形态的多样性和适应性。这种调控因子的保守性和可塑性是理解进化过程中形态多样性演化的关键。特别是,该研究通过揭示哺乳动物器官发育中的调控机制,为比较进化发育学(comparative evolutionary developmental biology,简称“evo-devo”)提供了新的见解,有助于理解不同生物之间共享的发育策略和适应性演化。
新的研究方向
发育生物学与表观遗传学结合: 通过揭示Tgfbr1如何通过改变染色质可及性(chromatin accessibility)来影响细胞命运,这项研究强调了发育过程中基因表达调控的复杂性。这开启了一个将发育生物学(developmental biology)与表观遗传学(epigenetics)结合起来的新研究方向,尤其是在研究染色质结构如何影响特定发育阶段和组织中基因表达的过程。
比较进化发育生物学("Evo-Devo"): 该研究还为比较不同物种中相同调控因子的作用提供了新的视角,尤其是在形态发育的可塑性和进化上。研究Tgfbr1在不同生物体中的作用,可以揭示进化过程中保守信号通路如何适应不同的生态和生物学需求,促进形态多样性。
再生医学和组织工程: 了解Tgfbr1及其信号通路在组织和器官发育中的具体作用,为再生医学(regenerative medicine)和组织工程(tissue engineering)提供了潜在的新策略。例如,通过调控Tgfbr1活性来促进受损组织的再生或在体外培养中引导特定细胞类型的分化。
可能的应用领域
疾病治疗: Tgfbr1及其信号通路在许多疾病中起着重要作用,包括癌症、纤维化(fibrosis)和炎症性疾病。通过更好地了解这一通路如何在疾病中被误调控,可以为开发针对性的治疗方法提供线索,例如设计小分子抑制剂或拮抗剂来调节TGF-β信号传导。
生殖健康: Tgfbr1在外生殖器发育中的作用提示,这一信号通路可能与某些生殖系统发育异常有关。研究Tgfbr1在生殖系统发育中的作用,可能有助于理解和治疗与性器官发育相关的先天性疾病。
个性化医学: 通过研究Tgfbr1信号通路在不同个体中的变异,可以为个性化医学(personalized medicine)提供重要信息。了解患者Tgfbr1信号通路的特定变异如何影响疾病风险和治疗反应,有助于定制更有效的治疗策略。
Q&A
Tgfbr1基因在胚胎发育中的作用是什么?
Tgfbr1基因是一种编码受体蛋白的基因,该蛋白质在多种细胞信号传递路径中起着至关重要的作用。在胚胎发育过程中,这些信号传递路径对于细胞的增殖、分化和定位至关重要。具体而言,Tgfbr1参与的信号通路在调节胚胎各部位的形成中起着关键作用,包括但不限于脊髓的发展和四肢的形成。通过精确调控这些信号通路,Tgfbr1帮助确保胚胎能够正确地发展成一个具有完整器官和功能的个体。
如何解释六足鼠胚胎的形成?
六足鼠胚胎的形成是由于在胚胎发育的关键时期内部分禁用了Tgfbr1基因。这种基因操作干预了正常的信号传递路径,导致了原本应该发展为生殖器官的原始结构转而形成了额外的后肢。这一现象揭示了Tgfbr1在确定原始结构命运中的关键作用,即通过调节细胞内DNA的折叠和基因表达模式,来指导这些结构发展为特定的器官或肢体。因此,当Tgfbr1的功能受到抑制时,这种精细的调控失衡,从而导致了异常的肢体发育,即在鼠胚胎中形成了两个额外的后肢。
研究对理解人类遗传疾病有何意义?
遗传学在人类疾病的研究和治疗中扮演着核心角色。本研究通过揭示Tgfbr1基因在胚胎发育中的关键作用,为我们提供了一扇窗口,让我们得以窥见基因如何影响生物形态的发展及其可能的异常。许多遗传性疾病都与基因缺陷有关,通过了解基因在正常发育中的作用,研究人员能够更好地识别导致疾病的基因异常。此外,这项研究还有助于推动再生医学和组织工程领域的发展,可能为治疗各种先天性缺陷、创伤后恢复乃至器官再生提供新的策略和方法。
爬行动物的双生殖器发育机制与这项研究有何关联?
爬行动物,特别是蛇类的双生殖器发育,是生物学中一个令人着迷的现象。本研究中的六足鼠胚胎提供了一个独特的模型,帮助我们理解爬行动物双生殖器的发育机制。在爬行动物中,双生殖器(双生殖腔)可能源自于在演化过程中未分化成肢体的原始结构。这项研究揭示了Tgfbr1基因在决定原始结构发育命运中的作用,为我们提供了线索,或许可以用来解释爬行动物双生殖器是如何从相似的原始结构中演化而来的。这不仅增进了我们对特定生物形态发展机制的理解,也为进一步探索生物演化过程中的形态变化提供了重要的理论基础。
参考文献
Lozovska A, Korovesi AG, Dias A, Lopes A, Fowler DA, Martins GG, Nóvoa A, Mallo M. Tgfbr1 controls developmental plasticity between the hindlimb and external genitalia by remodeling their regulatory landscape. Nat Commun. 2024 Mar 20;15(1):2509. doi: 10.1038/s41467-024-46870-z. PMID: 38509075; PMCID: PMC10954616.
Reardon S. Scientists made a six-legged mouse embryo - here's why. Nature. 2024 Mar 28. doi: 10.1038/d41586-024-00943-7. Epub ahead of print. PMID: 38548980.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)