首页 > 医疗资讯/ 正文
椎间盘病变
椎间盘(IVD)是相邻椎体之间的关键连接器,在维持人体运动(如站立,跳跃和弯曲)的稳定性方面起着不可或缺的作用。髓核(NP)是IVD的关键组成部分,可提供机械支撑以缓冲压力并保持脊柱柔韧性。然而,由于衰老或过度活动,NP的水合能力和蛋白聚糖含量降低,这可能导致早期椎间盘退变(IVDD),更严重的会使纤维环(AF)中胶原纤维紊乱甚至被破坏,最终导致脊神经病变。为了治疗IVDD,椎间盘切除术(即切除突出的NP组织)被认为是临床上减轻患者生理疼痛的标准做法。然而,NP切除可能会损害IVD的正常功能,导致各种术后并发症。因此,在椎间盘切除术后恢复功能并促进NP组织的再生意义重大。
细胞疗法的局限
近年来,细胞疗法已被用于许多临床试验,即使用NP细胞或间充质干细胞(MSC)来治疗IVDD并促进NP再生。然而,给药细胞的失巢凋亡(anoikis)对IVDD治疗的临床疗效提出了重大挑战。此外,退化的IVD中的恶劣环境因素(包括炎症,缺氧和酸性微环境)进一步加剧了治疗难度。在IVDD的早期阶段,过量的活性氧(ROS)可引起进一步的损伤,包括程序性细胞死亡,炎症和神经侵袭。上调的促炎细胞因子还会进一步引起细胞外基质的降解并损害NP的水合能力,从而导致IVD微环境的进一步恶化。因此,为了确保IVDD的治疗效果,必须开发一种可以注射并安全保留在IVD中以恢复NP功能的细胞递送系统。此外,该细胞递送系统还应该能够调节退化IVD的微环境,以维持补充细胞在损伤部位的活力,最终促进NP再生并增强IVDD治疗的功效。
新型可注射水凝胶递送体系
受核碱基可形成多氢键能力的启发,天津大学刘文广教授、杨强主任医师和Ziyang Xu等人提出了一种核碱基驱动的自凝胶策略,用于将核碱基(例如胸腺嘧啶)掺入透明质酸(HA)链中,以通过增强的分子间氢键相互作用触发凝胶形成。胸腺嘧啶修饰的HA(HAT)超分子聚合物的水溶液显示出自凝胶行为、可注射性、组织粘附性和水合能力(与25岁成年人NP组织中的相当)。这些特征使得能够在IVD中注射和填充HAT水凝胶系统,整合分离的NP组织,恢复退化IVD的生物力学功能,并将包封的细胞固定在NP部位。掺入HAT系统(HATMn)中的二氧化锰(MnO2)纳米颗粒可调节退化IVD中的氧化应激和缺氧微环境,确保包封细胞的活力。12周的体内研究结果表明,施用载有MSCs的HATMn系统(HATMn-MSCs)可有效恢复退化IVD的结构和功能。相关工作以“A Nucleobase-Driven Self-Gelled Hyaluronic Acid-Based Injectable Adhesive Hydrogel Enhances Intervertebral Disc Repair”为题发表在Advanced Functional Materials。

【文章要点】
一、经典HA水凝胶体系的局限
为了有效复制NP的功能,模拟NP中糖胺聚糖的水合能力至关重要。为此,各种水合聚合物已被用于IVDD治疗,其中透明质酸(HA)因其优异的水合性能和优异的生物相容性而被认为是最佳候选者。更重要的是,在100例中度IVDD患者(NCT01290367)中已经进行了一项涉及椎间盘内注射MSCs联合HA的II期临床试验。然而,HA的液体性质可能导致包封细胞的泄漏,最终导致骨赘形成。也就是说,基于HA的水凝胶不适用于IVDD治疗中的有效细胞递送,因为它们缺乏对IVD组织的粘附性,同时目前这类水凝胶的注射性以及生物相容性还有待提升。这些限制可能导致水凝胶容易从IVD中移位或挤出,或损坏包封的细胞。另外,通过冻融过程形成HA物理凝胶需要酸性环境,这对细胞包封是有害的。尽管透明质酸-醛(HA-ADH)对组织具有良好的粘附性,并且可以通过席夫碱反应形成水凝胶,但过量的醛可能会引起细胞毒性和副作用。因此,迫切需要在HA系统中引入动态交联机制,以构建具有适当水合性质和组织粘附性的可注射水凝胶,从而能够包封和递送细胞,以及以生物相容的方式安全粘附于IVD。
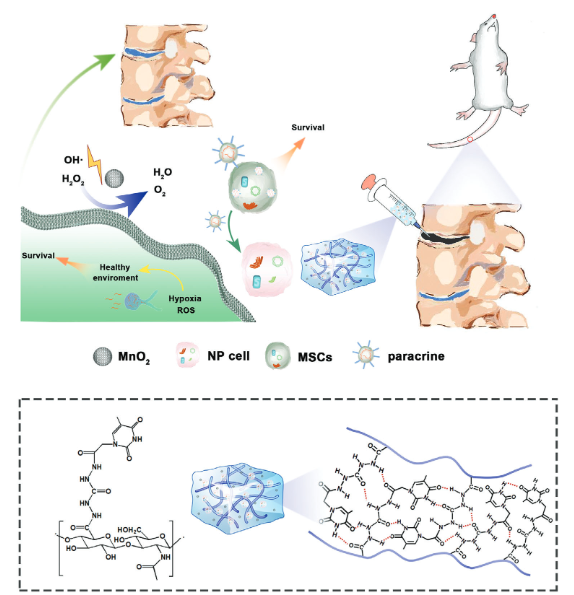
图1 新型自胶凝水凝胶及其在治疗IVDD中的应用
在自然界中,核碱基广泛存在于脱氧核糖核酸(DNA)和核糖核酸(RNA)中,并作为氢键受体和供体,以形成强氢键(H键)相互作用。因此,核碱基的这种固有性质可作为驱动HA自凝胶化的动态交联机制。最近,核碱基已被报道用于增粘水凝胶。然而,大多数基于核碱基的粘合剂水凝胶主要由不可降解的合成聚合物组成,使其不适合细胞递送和组织再生。受核碱基形成多个氢键的固有能力的启发,作者在此提出了一种核碱基驱动的自凝胶化策略,即将核碱基掺入HA链中,通过增强聚合物链之间的氢键相互作用来触发凝胶形成,用于IVDD治疗中的细胞保留和递送(图1)。
二、设计HAT水凝胶系统
为此,作者通过将胸腺嘧啶接枝到HA链上合成了胸腺嘧啶核碱基修饰的透明质酸。然而,由于存在额外的D-核糖或D-脱氧核糖,通常使用的水溶性核碱基衍生物,即核苷,会表现出比核碱基更大的空间位阻和更大的结构复杂性。这可能会影响聚合物的取代程度,并在材料合成中引入不必要的复杂性和不确定性。因此,作者选择使用结构更简单的反应物,特别是与核碱基非常相似的反应物,以确保合成后核碱基结构的完全暴露。最终,作者选择使用水溶性胸腺嘧啶衍生物胸腺嘧啶-1-乙酸,其结构与胸腺嘧啶非常相似。通过EDC催化的偶联反应,作者将胸腺嘧啶与酰肼修饰的透明质酸(HA-HYD)接枝,得到胸腺嘧啶-1-乙酸修饰的HA(HAT),其具有良好的自凝胶性、可注射性、组织粘附性和水合作用(图2)。
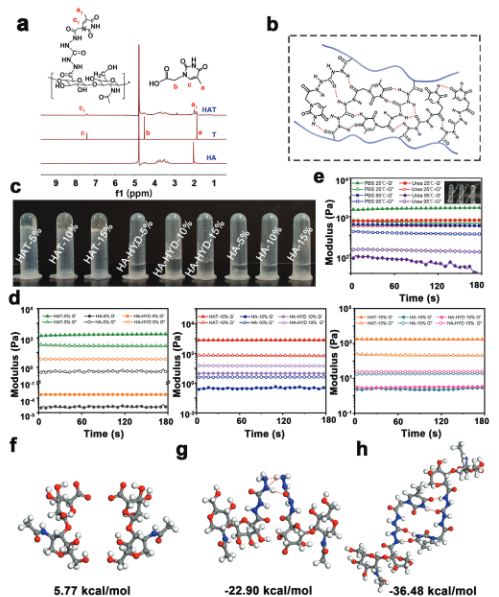
图2 HAT
三、HAT的性能和治疗效果
研究显示,当HAT溶解在PBS中时,凝胶化行为是自发的,并且在粘附之前不需要额外的催化剂。为了调节退化IVD的不利环境以促进NP再生,作者还选择将二氧化锰(MnO2)纳米颗粒加载到超分子HAT水凝胶(HATMn)中。二氧化锰具有类过氧化氢酶活性,可赋予HATMn以抗炎和抗氧化能力,从而清除ROS和缓解缺氧情况。最后,作者还将外源性干细胞(即MSCs)包封在HATMn系统(HATMn-MSCs)中,使用其治疗大鼠尾侧椎间盘退变模型,验证了HATMn-MSCs系统在促进NP再生和改善退化IVD条件方面的功效(图3)。
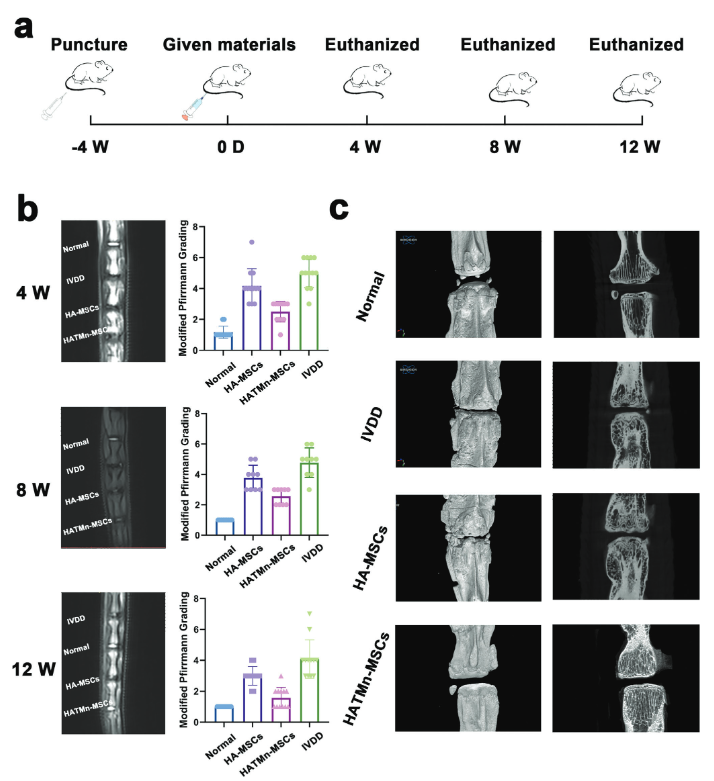
图3 治疗大鼠IVDD
结论与展望
源自胸腺嘧啶的强化分子间氢键使HAT水系统能够自发形成具有所需可注射性、安全的组织粘附性和优异的水合性质的水凝胶,使其成为IVDD治疗中细胞递送系统的潜在候选者。HAT有效地恢复了退化IVD的压缩破坏应力和松弛应力,这在维持IVD的功能和延缓IVDD过程中起着重要作用。HAT的组织粘附能力确保了包封细胞在NP部位的安全固定。大鼠尾侧椎间盘退变模型的体内给药表明,HATMn-MSCs系统有效改善了退变IVD的状况并促进了NP再生,这为构建基于HA的可注射水凝胶提供了一种新方法,有望扩展它们在细胞递送系统中的应用前景。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202401232
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)