首页 > 医疗资讯/ 正文
炎症性肠病 (Inflammatory bowel disease,IBD),包括溃疡性结肠炎和克罗恩病,是一种慢性消化道炎症性疾病,可以导致危及生命的并发症发生,影响着数百万人的生命健康。虽然全基因组关联分析已经确定了许多与炎症性肠病相关的遗传变异,但炎症性肠病的确切病因仍然存在未知,阻碍了炎症性肠病的治疗和生物分子疗法的发展。虽然小分子药物和生物制剂都可用于改善炎症性肠病,但目前仍然没有很好的治愈方法。因此,仍然需要针对炎症性肠病而发现新的靶点并开发更有效的治疗方法。
Sirt2是NAD+依赖性蛋白赖氨酸去乙酰化酶Sirtuin家族的成员,它可以从蛋白赖氨酸残基中去除乙酰基团或者长链脂肪酰基,从而抑制靶蛋白的乙酰化修饰或者脂肪酰化修饰。目前,人们已经发现Sirt2可以作用于许多不同的底物蛋白,且其抑制剂对癌症和神经退行性疾病的治疗展示出积极效果。但是,在硫酸钠葡聚糖 (Dextran Sodium Sulfate, DSS) 诱导的小鼠结肠炎模型中,先前的两项研究分别发现Sirt2特异性小分子抑制剂Thiomyristoyl(TM)在DSS诱导的结肠炎中提供了保护作用,而Sirt2敲除的小鼠在DSS诱导的结肠炎模型中并不产生保护效果。这些报告相互矛盾,且没有令人信服的分子机制来解释Sirt2在结肠炎中的具体作用,这阻碍了Sirt2抑制剂在该疾病中的深入研究及进一步应用,也说明我们对Sirt2在其中的生物学功能和作用分子机制的认知仍然不是非常完善。
近日,美国霍华德休斯医学研究所(HHMI)、康奈尔大学林合宁教授团队通过结肠炎模型以及分子生物学和生物化学分析,发现Sirt2基因敲除和Sirt2抑制剂在结肠炎模型中的差异表现主要因为小分子抑制剂具有底物特异性抑制功能:Sirt2抑制剂通过底物特异性改善肠道上皮屏障完整性并保护小鼠免于结肠炎,而Sirt2基因敲除抑制了Sirt2的所有酶活及其影响的所有底物。虽然Sirt2基因敲除不保护结肠炎的发生,该项研究表明Sirt2小分子抑制剂仍然是IBD治疗的一种潜在策略。

图1. 康奈尔大学林合宁团队揭示Sirt2抑制剂通过底物特异性改善肠道上皮屏障完整性并保护小鼠免于结肠炎的独特优势。
首先,研究人员发现Sirt2基因敲除小鼠在结肠炎模型中并没有与野生型小鼠表现出明显区别。而且,利用一种Sirt2蛋白降解靶向嵌合体(Proteolysis Targeting Chimera,PROTAC)TM-P4-Thal分子(林合宁团队开发)在体内降解Sirt2的蛋白水平,研究人员发现TM-P4-Thal处理的小鼠表现出与Sirt2基因敲除小鼠相似的结肠炎表型,即Sirt2蛋白的缺失并不影响小鼠结肠炎的发生。然而,研究人员发现Sirt2的小分子抑制剂——基于机理开发的硫咪甲酰赖氨酸化合物TM(Mechanism-based Thiomyristoyl-lysine Compound,林合宁团队开发)在DSS诱导的小鼠结肠炎模型中表现出积极的改善效果,说明Sirt2的抑制剂在结肠炎中具有保护作用。此外,该团队证明TM的保护效果并不是脱靶效应造成的,因为Sirt2蛋白的另一底物竞争性抑制剂AGK2(Substrate Competitive Inhibitor)也对结肠炎表现出相同的保护效果。
随后,研究人员希望探究Sirt2抑制剂保护小鼠结肠炎的分子机制。根据林合宁教授团队先前的研究,赖氨酸豆蔻酰化转移酶NMT和Sirt2可以分别介导和去除Ras超家族小G蛋白Arf6(ADP-ribosylation factor 6)的豆蔻酰化(Myristoylation),从而通过豆蔻酰化-去豆蔻酰化循环而促进Arf6的活性(GTP结合Arf6, Arf6-GTP)。而炎症性肠病相关的C1orf106基因突变则可以通过增加Arf6的激活,从而反过来促进用于维持上皮屏障的E-钙粘蛋白(E-cadherin)的内吞作用,并最终损害肠上皮细胞的完整性。因此,研究人员假设Sirt2可以通过调节Arf6的豆蔻酰化和活性从而影响肠上皮的完整性,介导小鼠结肠炎的发生。
为了验证以上推测,研究人员利用一种经典的肠上皮细胞模型CaCo2细胞,并结合细胞通透性检测(Lucifer Yellow Permeability Assay)和跨细胞膜阻抗实验(Transepithelial electrical resistance,TEER),发现Sirt2抑制剂处理可以促进Arf6的豆蔻酰化,从而破坏Arf6的豆蔻酰化-去豆蔻酰化循环,抑制Arf6的活性(Arf6-GTP)及其介导的E-钙粘蛋白的内吞,维持上皮细胞表面E-钙粘蛋白的水平,并最终维持上皮细胞的完整性。更为重要的是,通过小鼠结肠炎模型结合原代肠上皮细胞的生化分析,研究人员发现在Sirt2抑制剂处理的结肠炎小鼠肠上皮细胞中,Arf6的豆蔻酰化明显增加,而Arf6的活性(Arf6-GTP)明显抑制。相应的,Sirt2抑制剂处理使得结肠炎肠上皮细胞表面的E-钙粘蛋白水平明显增加,维持结肠炎小鼠肠上皮的完整性,抑制小鼠肠道的通透性,从而缓解小鼠结肠炎的严重程度。因此,通过体外实验和体内炎症,研究人员证明了Sirt2可以通过调节Arf6的豆蔻酰化和活化而影响肠上皮的完整性,调节小鼠结肠炎的发生。此外,考虑到NMT对Arf6的豆蔻酰化和活性的重要调控作用,研究人员还发现NMT的抑制剂也可以缓解小鼠结肠炎的发生。
随后,考虑到Sirt2不仅具有NAD+依赖性蛋白赖氨酸去乙酰化酶的功能(底物HIF1α 、LDH-A 、GSK3β等),同时还具有去长链脂肪酰化修饰的活性(底物GTPases KRas4a 、RalB 、Arf6等),研究人员推测Sirt2抑制剂和基因敲除在结肠炎模型中的表现不同可能与Sirt2多种酶学功能和底物作用的特异性有关。该研究发现在肠上皮细胞中TM不能抑制Sirt2催化的KRas4a去脂肪酰化修饰,但却可以抑制Sirt2催化的Arf6去豆蔻酰化修饰,说明Sirt2抑制剂在肠上皮细胞中也表现出对不同底物的特异性作用。
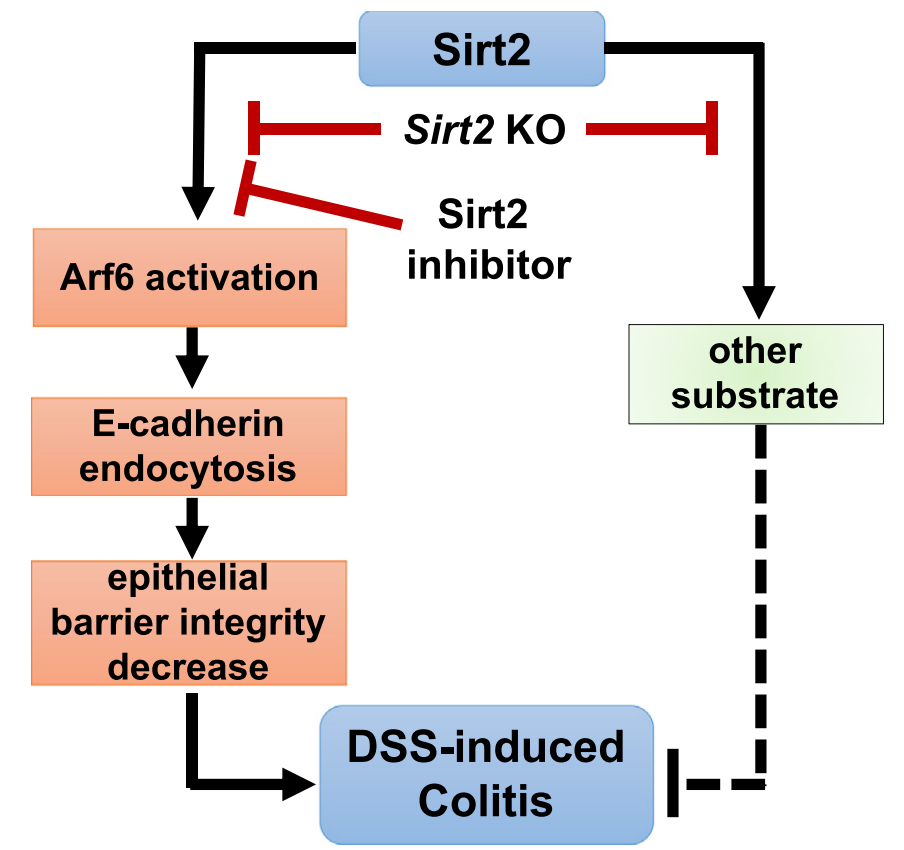
图2. Sirt2抑制剂通过抑制Arf6激活而影响E-cadherin内化并维持肠上皮屏障完整性,在DSS诱导的结肠炎模型中表现出底物依赖性的保护效果。小分子抑制剂和基因敲除的差异效应是由于Sirt2抑制剂只抑制了Sirt2的部分活性(作用于部分底物)而不是全部活性(所有底物),而基因敲除或蛋白缺失则影响了Sirt2的全部活性(影响所有底物)。
通常情况下,基因或者蛋白的遗传缺失与小分子抑制剂往往表现出相同的效果。该项研究提供了一个十分有趣的例子,即基因缺失和小分子抑制剂造成的表型和结果不一致,这更加证明了开发底物依赖性抑制剂治疗疾病的可行性和重要性。
侯丹博士(康奈尔大学博士后)是该研究论文的第一作者,于涛、吕璇、 Jun Young Hong、Min Yang、资焱琳、Thanh Tu Ho是本文的共同作者,HHMI研究员、康奈尔大学林合宁(Hening Lin)教授是文章的通讯作者。本研究受到来自美国国立卫生研究院(NIH)的经费资助,康奈尔大学各实验技术平台对本项工作提供了重要帮助,帝国理工学院Edward Tate教授对本项工作提供了大力支持。
文章链接
https://doi.org/10.1073/pnas.2319833121
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)