首页 > 医疗资讯/ 正文
肺癌已成为男性和女性癌症死亡的主要原因。大多数患者在晚期才被诊断出来,此时手术已不再是治疗选择。此时,通常使用细胞学样本进行诊断和确定预测标志物,因为其侵入性较小。本文评估了通过细胞学样本进行诊断、建立分子频谱和PD-L1表达的能力,这对于患者的治疗管理至关重要。研究纳入了 259 份疑似肿瘤细胞的细胞学样本,并通过免疫组织化学评估了确认恶性肿瘤类型的能力。文章总结了这些样本的下一代测序(NGS)和PD-L1表达的分子检测结果。最后分析了这些结果对患者管理的影响。结果显示,在 259 份细胞学样本中,189 份与肺癌相关。其中,免疫组织化学确诊率为 95%。93% 的肺腺癌和非特指型非小细胞肺癌均通过NGS进行了分子检测。75% 的患者获得了PD-L1结果。基于细胞学样本获得的结果帮助 87% 的患者做出了治疗决策。总之,通过微创技术获得的细胞学样本可以为肺癌患者的诊断和治疗管理提供足够的材料。

背 景
肺癌已成为男性和女性癌症死亡的主要原因。在过去十年中,随着酪氨酸激酶抑制剂和免疫治疗等新疗法的出现,肺癌的治疗方法不断发展。因此,患者样本必须能够用于诊断、分子检测以及PD-L1评估。由于患者常常在晚期确诊,病理医师必须仔细、适当地使用样本,因为诊断不再是患者管理所需的唯一结果。细胞学样本在肺部肿块患者的治疗中占有一席之地,尤其是那些处于疾病晚期、无法进行手术治疗的患者。这些晚期患者占肺癌患者的 45%。世界卫生组织(WHO)最新版本分类为肺癌细胞学设立了一个版块,凸显了细胞学样本在这方面的重要性。
研究方法
这项研究纳入了观察到可疑细胞的细胞学样本,并进行免疫组织化学来表征这些细胞。这些细胞学样本包括胸膜、心包和腹膜积液、支气管肺泡灌洗液、淋巴结支气管内超声引导下经支气管针吸活检(EBUS-TBNA)、纵隔或肺部肿块EBUS-TBNA、脑脊液和骨髓抽吸。样品最初未固定,保存在 4°C 直至制备载玻片(涂片或细胞离心涂片)。载玻片采用HE染色。
研究结果
常规结果
2021 年 1 月至 2022 年 9 月期间,通过免疫组织化学分析了 259 份含有疑似恶性肿瘤细胞的细胞学样本,以表征癌症的类型和起源。
免疫组织化学能够表征 248 例(95.7%)样本的癌症类型。在 59 个样本(主要是胸腔和腹腔积液)中,免疫组织化学证实了恶性肿瘤的存在,但并非来源于肺(例如卵巢癌、乳腺癌、结直肠癌或胰腺癌、间皮瘤、神经母细胞瘤、淋巴瘤或黑色素瘤)。在 189 例肺癌样本中,肺腺癌 106 例,其次是非特指型非小细胞肺癌(NSCLC NOS,44 例)、鳞状细胞癌(20 例)和神经内分泌肿瘤(19 例),其中大细胞神经内分泌癌(3 例)、小细胞肺癌(15 例)、类癌 1 例(见图1、表1)。在 11 例样本中,疑似含有恶性细胞,但免疫组织化学并未证实恶性;或样本坏死过多;或样本中肿瘤细胞数量较少(<总细胞的1%)。
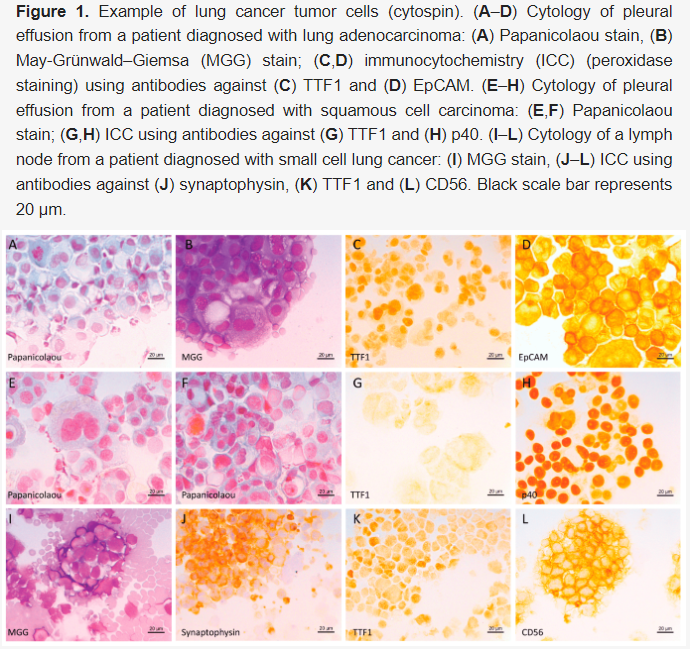
▲图1 肺癌肿瘤细胞示例(细胞离心涂片)
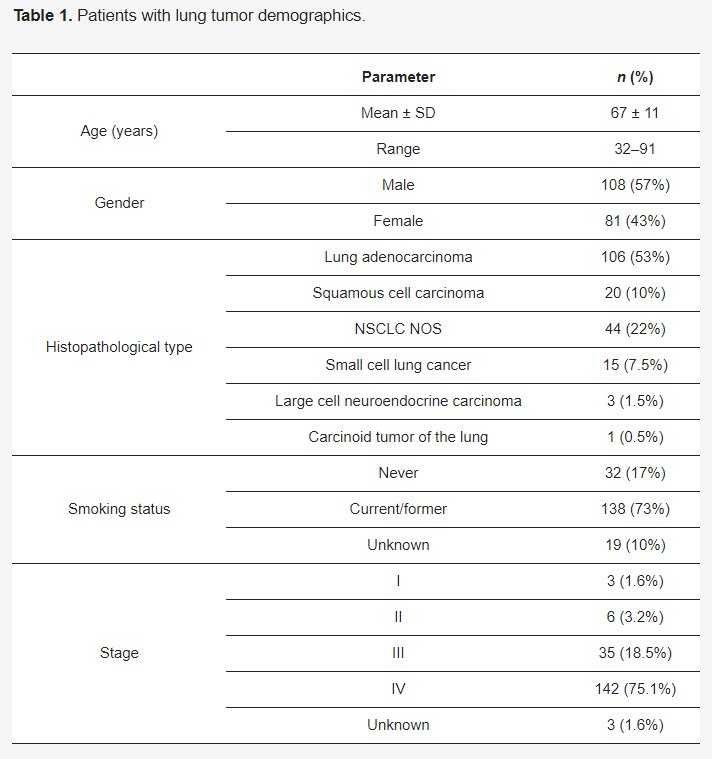
▲表1 肺癌患者的人口统计学数据
在诊断为肺癌的 189 例样本中,胸腔积液 72 例(38.1%),EBUS-TBNA采集淋巴结 71 例(37.5%),EBUS-TBNA采集纵隔或肺部肿块 29 例(15.3%),支气管肺泡灌洗液(BAL)6 例(3.2%),心包积液 6 例(3.2%),脑脊液(CSF)2 例(1.1%),腹腔积液 2 例(1.1%),骨髓 1 例(0.5%)。
大多数患者确诊时为IV期(75.1%),且为吸烟者或既往吸烟者(73%)(表1)。
分子结果和PD-L1结果
对来源于 115 个细胞学样本的细胞块进行PD-L1检测。29 例(25.2%)因肿瘤细胞少于 50 个而无法报告结果。在可分析的 86 个样本中,22 例(25.6%)PD-L1表达呈阴性(<1%),34 例(39.5%)PD-L1 表达在 1-49% 之间,30 例(34.9%)≥50%。样本检测结果如图2所示。有 35 名患者由于免疫组织化学和NGS检测后没有样本剩余,或者因为样本坏死过多,因此未进行检测。有 20 名患者有可用的细胞块,但没有进行PD-L1检测,因为已经在活检或切除的肿瘤上进行了检测。
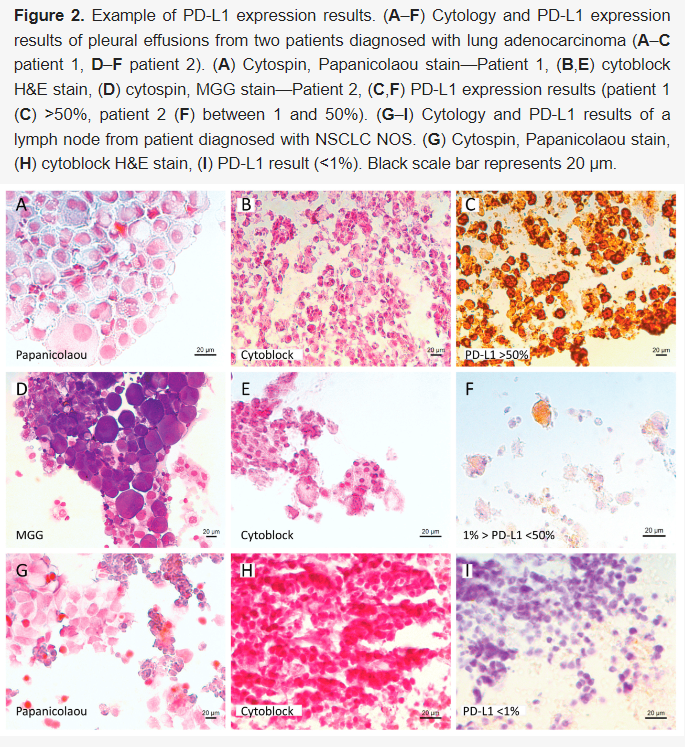
▲图2 PD-L1表达结果示例
对 150 例诊断为肺腺癌或NSCLC NOS的病例中的 140 例(93%)进行了下一代测序(NGS)。20 例(14.2%)携带EGFR突变,其中 12 例接受酪氨酸激酶抑制剂治疗。其他 8 名患者未处于IV期,或接受了最佳支持治疗,或治疗方法未知。4 例(2.8%)携带ALK融合,2 例(1.4%)携带ROS1融合。所有这些携带ALK或ROS1融合的患者均接受了对应的酪氨酸激酶抑制剂治疗。67 例(47.8%)携带TP53突变,其中 46 例存在其它相关突变。48 例(34.3%)携带KRAS突变,其中 29 例存在其它相关突变。其它突变包括HER2、PIK3CA、STK11、RET、BRAF、DDR2、CTNNB1、SMAD4、PTEN和POLE(图3)。19 例(13.6%)未发现突变或融合。
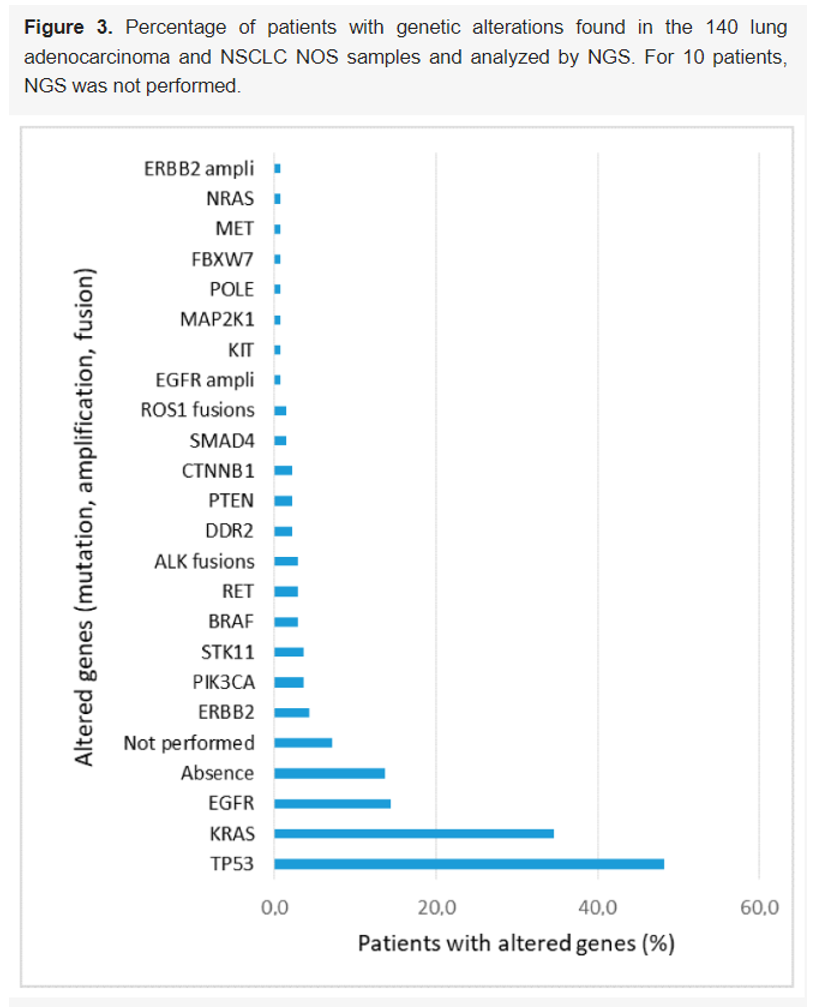
▲图3 在140个肺腺癌和NSCLC NOS样本中发现并通过NGS检测的基因变异患者的百分比
利用细胞学样本改进诊断和治疗管理
本文分析了细胞学结果对 189 名肺癌患者治疗的影响:有 124 例(65.6%)样本的结果有利于诊断和治疗管理。其中,37 例患者同时进行了活检和细胞学检查:24 例患者活检和细胞学诊断相同,13 例患者活检未见肿瘤细胞,仅通过细胞学诊断。在 3 例病例中,由于坏死或没有足够的材料进行NGS,建议在细胞学检查后进行活检。对于 40 名已知患有肺癌的患者(21.2%),在疑似肺癌进展的情况下(通过影像学证明)进行了细胞学采样。细胞学样本中肿瘤细胞的存在证实了疾病进展并导致治疗方案的改变。有 19 例(10.0%)患者,细胞学结果对治疗管理没有影响。在大多数病例中,转移部位已知(胸膜、腹膜或心包),并进行了细胞学分析——因为必须进行积液引流。在其它情况下,临床状况迅速恶化,患者在几天内死亡。有 6 例(3.2%)患者没有提供任何信息。根据研究人员的数据,从细胞学样本获得的结果可以对 87% 的肺癌患者进行治疗管理。
讨 论
在这项研究中,使用细胞离心涂片样本进行染色和免疫组织化学,并使用细胞块进行PD-L1检测。细胞学制备方法各有优缺点。例如,细胞块便于与活检样本进行比较,而细胞离心涂片制备则可以提供良好的形态,便于进行免疫组织化学。无论选择哪种方法,严格的质量控制都是必不可少的。研究报告称,小活检和细胞学样本占肺癌诊断标本的 70%。在本文研究中,细胞离心涂片免疫组织化学可以在 259 个观察到可疑肿瘤细胞的细胞学样本中确定 248 个癌症样本。对于其余 11 个样本,免疫组织化学无法表征,原因可能是质量差(坏死或异形细胞过多)、体积不足(例如脑脊液)或可疑肿瘤细胞数量较少(<总细胞的 1%)。尽管如此,肿瘤细胞的分类在超过 95% 的病例中都是成功的,这一比例证实了细胞学样本对于识别肿瘤细胞的价值。本文结果与其它评估细胞学样本诊断肺癌能力的研究一致。例如,Rekhtman等人将 192 份术前细胞学标本与组织学进行比较,发现一致性为 96%。Proietti等人评估了 941 名患者的细胞学和活检样本中肺癌亚型分型的效果,发现 92.8% 的病例具有一致性。Arnold等人进行了一项前瞻性研究来调查细胞学检测在胸腔积液中的作用,其中包括 921 例胸腔积液,其中 166 例为肺癌,100 例为肺腺癌,结果证实肺癌诊断的敏感性为 56%,腺癌诊断的敏感性为 82%。其它在胸腔积液中肿瘤细胞的检测和表征方面的研究也发现了类似的结果。
在过去的十年中,免疫检查点抑制剂和靶向治疗的出现改变了细胞学样本的管理方式。除了诊断之外,样本还必须能够评估PD-L1表达和用于分子检测。PD-L1表达是一种生物标志物,可以预测哪些患者更有可能对免疫治疗产生反应。对于PD-L1表达 ≥50% 的晚期NSCLC患者,可将免疫疗法作为一线单药治疗;对于PD-L1表达≥1%的转移性NSCLC患者,可将免疫疗法作为二线治疗。在这种情况下,对细胞学样本的PD-L1表达评估至关重要。这项检测可能具有挑战性,它需要一定的经验和良好的质量控制。例如,必须正确识别巨噬细胞和间皮细胞,以避免将它们计入PD-L1表达细胞的百分比中。与活检相比,细胞块是最常用的检测材料,尽管使用涂片也能提供一致的结果。最近一项纳入了 264 名患者的多中心研究得出结论:基于细胞学样本的PD-L1表达可以正确预测免疫治疗的疗效。在本文研究中,仅在 115 个细胞块上检测了PD-L1表达。当已通过活检或手术标本确定患者的PD-L1状态时,可不再对细胞学样本进行分析。
必须对晚期NSCLC患者进行分子检测,因为有几个致癌驱动因素是可靶向治疗的。国际肺癌研究协会(IASLC)建议检测EGFR突变以及ALK和ROS1融合。HER2、RET、MET、BRAF和KRAS并未被指定为常规独立检测,但可能包含在大型分子检测panel中。据此,欧洲肿瘤内科学会(ESMO)建议使用至少包括EGFR常见突变、ALK融合、MET突变、BRAF突变和ROS1融合的NGS panel。细胞学样本中不含福尔马林,有利于在分子检测中应用NGS或聚合酶链反应(PCR)。即使样品量或肿瘤细胞数量较低,对细胞学样品进行分子检测也能提供结果。在本文研究中,93% 的肺腺癌或NSCLC患者有NGS结果,只有 13.5% 的患者基因没有检出基因变异。研究人员之前已经证明了通过免疫组织化学从细胞学样本中检测ALK和ROS1融合的可行性,如果结果为阳性,可进行荧光原位杂交(FISH)或者NGS检测,两种技术具有高度一致性。作为诊断结果的一部分,现在通常通过免疫组织化学对细胞学样本进行ALK和ROS1融合检测。Rekhtman等人证实了对胸部来源细胞学样本检测EGFR和KRAS突变的可行性。在本文研究中,NGS是在冷冻细胞沉淀上进行的。离心后液基细胞学的上清液也可用于NGS。
阻碍相关技术(即免疫组织化学、分子检测和PD-L1)检测的两个主要原因是样本量少或肿瘤细胞含量低。
关于样本量,病理学家应告知临床医生,送往实验室的样本量越大,用于诊断和额外检测的样本就越充足。特别是积液(心包、胸膜和腹膜),穿刺可以排出多达几升的积液,而病理医师只能收到 1-2 mL。积液的充足与否取决于肿瘤细胞结构和百分比。目前,不存在标准体积要求,但一些研究建议使用 50 mL,Dalvi等人建议至少 20 mL,证明肿瘤细胞比例对于评估诊断和分子分析至关重要。肿瘤细胞数量较少是再次进行活检以获取准确检测样本的原因。如果检测到的肿瘤细胞数量较少(1-5%),免疫组织化学和NGS可以进行解释;但PD-L1的解读需要至少 100 个肿瘤细胞,否则病理医师无法获得结果。
结 论
在过去的十年中,随着靶向治疗和免疫检查点抑制剂的引入,肺癌治疗方面取得了重大进展,使得病理医师需要改变既往检测手段并以不同的方式使用细胞学样本。仅进行诊断已经无法满足临床需求,病理医师必须保留一部分样本来进行PD-L1表达评估和分子检测。细胞学样本可通过微创操作获得,可以为肺癌患者的诊断和治疗管理提供足够的材料。
参考文献:
Frankel, D.; Nanni, I.; Ouafik, L.; Greillier, L.; Dutau, H.; Astoul, P.; Daniel, L.; Kaspi, E.; Roll, P. Cytological Samples: An Asset for the Diagnosis and Therapeutic Management of Patients with Lung Cancer. Cells 2023, 12, 754. https://doi.org/10.3390/cells12050754

- 上一篇:大咖谈 | BRAF突变结直肠癌的病理学特征
- 下一篇:机械呼吸机的设置和基本模式
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)