首页 > 医疗资讯/ 正文
导读
95%的转移性CRC为MSS型。MSS型CRCs特征是低TMB、低免疫细胞浸润和大约40%患者合并NRAS突变。KRAS突变与CRC中CD8 T浸润和HLA表达减少相关。炎症性癌症相关成纤维细胞(iCAFs)表达核心蛋白多糖,后者可能形成T细胞和肿瘤细胞之间的免疫屏障。此外,肝转移影响免疫应答。例如,RIN方案(瑞戈菲尼联合纳武利尤单抗和逸沃单抗)治疗肝转移MSS型CRCs的有效率为0。
MEDITREME研究是PD-L1抗体度伐利尤单抗联合CTLA-4抗体曲美木单抗和mFOLFOX6一线治疗RAS突变型转移性结直肠癌的1/2期临床研究。入组57例患者,3个月PFS为90.7%,6个月PFS为60%,中位PFS为8.2个月,达到预设主要研究终点。没有观察到肝转移等临床特征影响MEDITREME方案的PFS和ORR。历史数据显示,单纯FOLFOX治疗后该人群的预期中位PFS为5-6个月,贝伐珠单抗联合化疗的PFS大约8个月。
在次要研究终点方面,MEDITREME方案ORR为63%,与FOLFOX单药治疗突变RAS肿瘤的36%相比,该试验产生了迄今为止相关报道最好的客观反应率。
转化研究观察到MEDITREME方案的PFS或ORR与癌巢肿瘤细胞PD-L1分子表达、癌巢CD8+T细胞浸润数量、TMB>5.8mut/mB、新抗原<14个、同源重组分数(HRD)<29、CTLA-4分子、HLA-B、HLA-DOR、TERT和NY-ESO-1分子高表达正相关,与核心蛋白多糖表达负相关。
临床意义:该研究报道了一线化疗免疫治疗治疗不可切除的MSS转移性结直肠癌的良好临床疗效,并通过深入的分子和免疫分析,为更好地选择MSS转移性结直肠癌患者进行化疗免疫治疗提供了线索(Nat Med. 2023 Aug;29(8):2087-2098. doi: 10.1038/s41591-023-02497-z)。
Background
结直肠癌是一种按其遗传特征分类的异质性疾病,指导预后和治疗。CRC的一个特殊基因亚群是具有微卫星不稳定性(MSI)的肿瘤,导致高肿瘤突变负荷(TMB)和高免疫细胞浸润。此类肿瘤,使用靶向PD-1/PD-L1的单克隆抗体进行免疫治疗已显示出疗效。对于其他类型的CRC,称为微卫星稳定(MSS),单用免疫治疗往往无效。
临床前数据表明,将PD-1/PD-L1抑制剂与免疫原性细胞死亡诱导剂,如奥沙利铂联合使用,可以提高免疫治疗的疗效。
5-氟尿嘧啶(5-FU)可以消除骨髓源性抑制细胞,并限制肿瘤诱导的免疫抑制。因此,5-FU联合奥沙利铂可提高抗肿瘤免疫应答。
在小鼠结直肠癌模型中,使用抗PD-L1+FOLFOX组合观察到协同效应。
基于以上这些数据,我们设计了1b/2期MEDITREME(NCT03202758)。在研究中,患者接受3个月的改良mFOLFOX6方案(6个周期)联合德瓦鲁单抗(PD-L1)和曲美木单抗(CTLA-4)作为诱导治疗,然后使用德瓦鲁单抗维持治疗,直到病情进展。
目的是探讨MSS mCRC应答的可行性和有效性,并探讨其基因组学和免疫学特征。为了获得同质反应率和无进展生存期(PFS),我们重点关注了ras突变的肿瘤患者。
研究目的
首要目的
-
评估德瓦鲁单抗+曲美木单抗联合mFOLFOX6化疗在57例ras突变不可切除转移性结直肠癌患者中的安全性和有效性。
次要目的
-
MSS肿瘤患者3个月无进展生存期,总生存期。
-
肿瘤突变负荷、高免疫特征和上皮间充质转变与疗效结果相关性。
试验方法
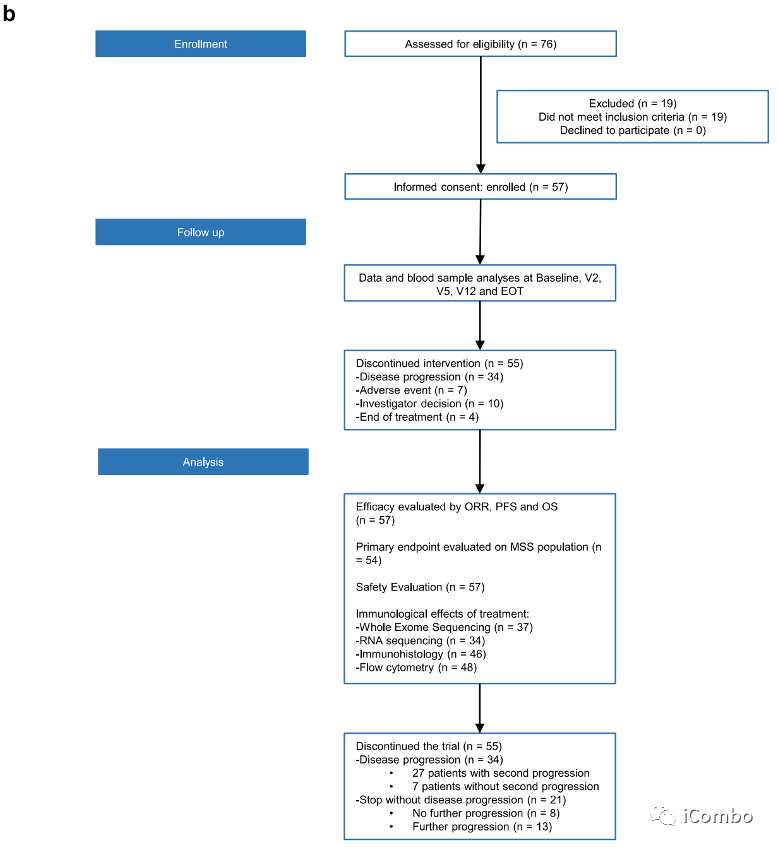
在2017年8月30日至2019年12月20日期间,我们纳入了来自8家法国医院的57例不可切除的转移性ras突变CRC患者(a,b). 患者接受了6个周期(3个月)的mFOLFOX6(奥沙利铂(85mg/m2)和亚叶酸钙(200mg/m2第1天静脉注射,随后注射5-FU(400mg/m2)静脉注射,然后再注射5-FU(2400mg/m2)静脉注射。在此期间,使用durvalumab单抗(每2周750mg)和曲美木单抗(每4周75mg)。治疗后肿瘤稳定或应答的患者随后继续使用durvalumab单抗维持治疗(每2周750mg),最多1年。
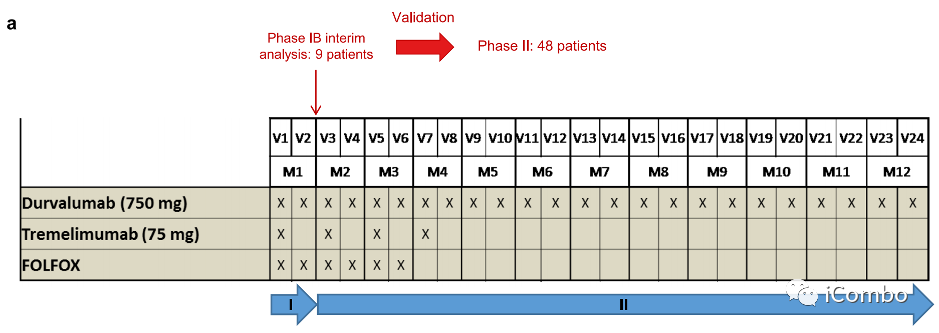
入组人群
第一部分是一项纳入的Ib期研究,包括9名患者。进行了一个由方案定义的安全性审查。在没有任何安全事件警告的情况下。
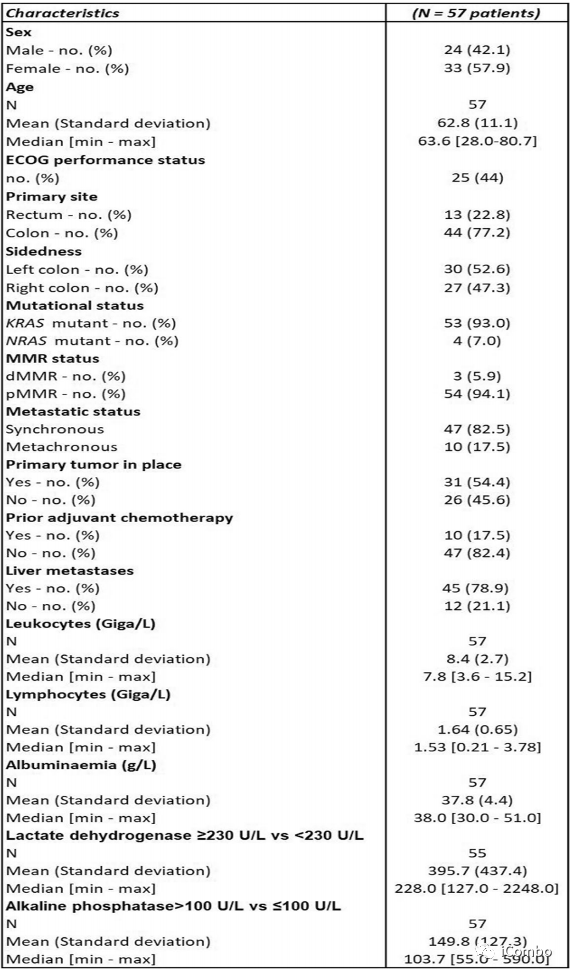
另外48名患者被纳入了2期研究。中位年龄为63.6岁(范围28-80);33(58%)患者为女性;17(30%)患者左侧结直肠癌;13(23%)患者直肠癌;45(79%)患者肝转移;23(40%)患者肺转移;17例(30%)患者腹膜转移。10例(17.5%)患者接受了mFOLFOX6作为辅助治疗。
安全性/可行性
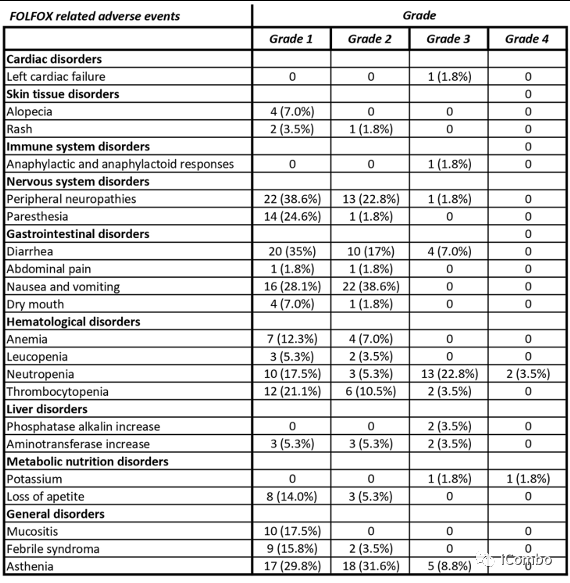
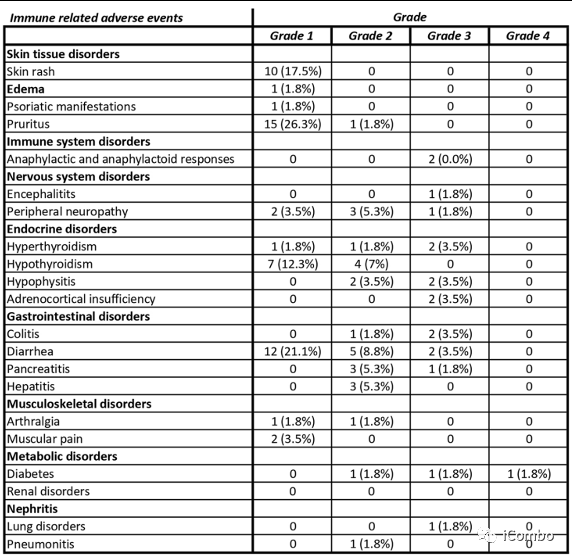
38例(67%)患者发生了与治疗相关的3/4级AEs,导致7例(12%)患者停止治疗(2例糖尿病、2例垂体炎、2例输注反应和1例脑炎)。未发生5级不良事件。
毒性主要与化疗相关,32例(56%)患者存在与化疗相关的3级和4级毒性,8例(14%)患者与免疫治疗相关。
对于化疗相关毒性,最常见的事件是腹泻34例(60%),中性粒细胞减少28例(49%),血小板减少20例(35%)。
对于免疫治疗相关的毒性,最常见的事件是皮肤反应21例(37%),内分泌紊乱15例(26%),结肠炎和肝炎3例(5%)。
值得注意的是,90%的3/4级AE发生在化疗免疫治疗期间。
疗效分析 1
在57例患者中,51例患者已知MSS状态,3例为MSI状态,48例为MSS状态。根据方案,只有48例MSS肿瘤患者被纳入符合疗效分析的合格人群。
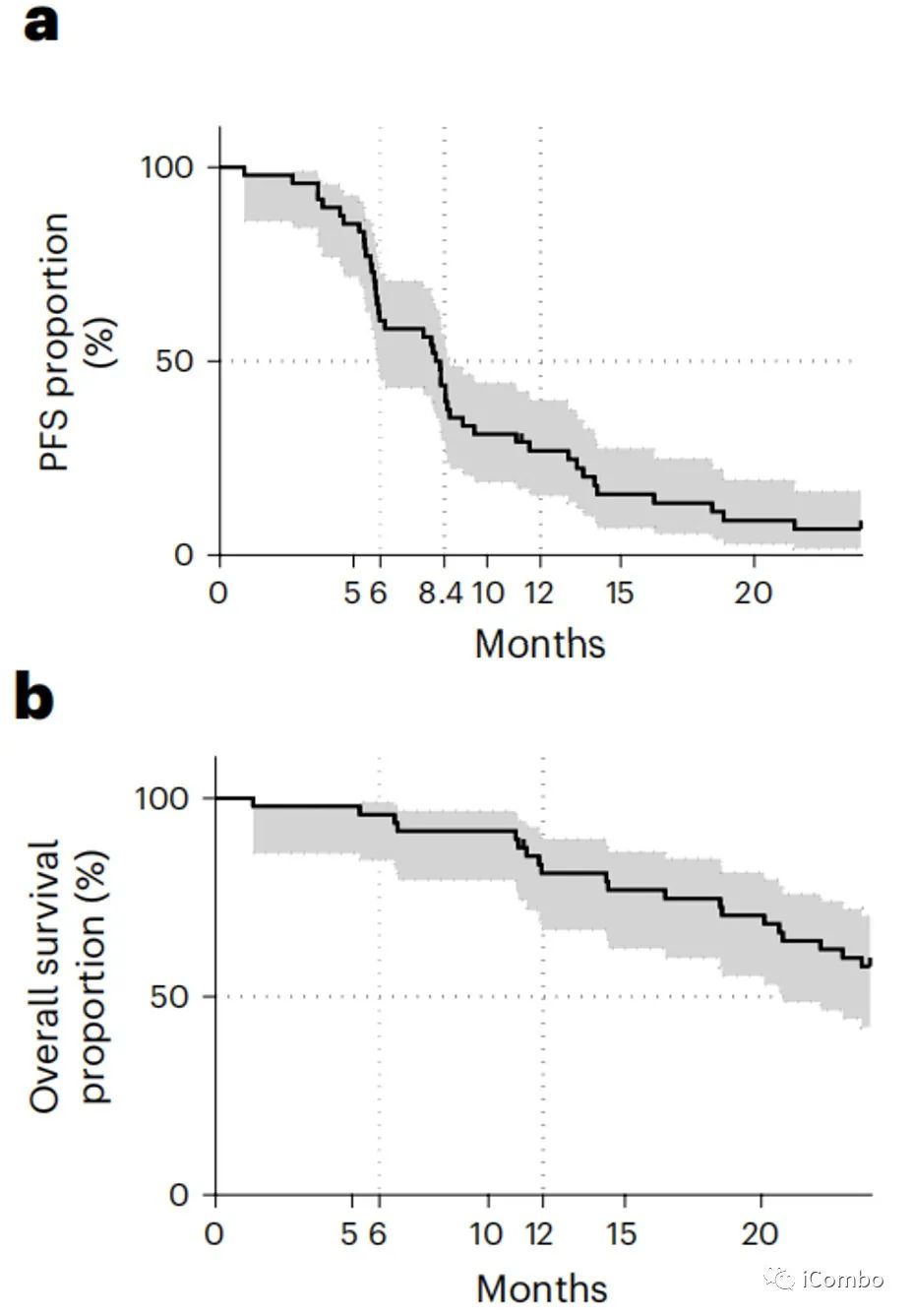
中位随访时间为36个月(2.5-33.9个月)。3个月的PFS为90.7%(95%置信区间(CI): 79.2-96%)。6个月、12个月和24个月的PFS为,分别为60.4%(95%CI: 45.2–72.6%)、26.9%(95%CI: 15.3–39.9%)和6.7%(95%CI: 1.8-16.5%)。中位PFS为8.2个月(95%CI: 5.9-8.6)。6个月、12个月和24个月的OS分别为95.8%(95%: 84.3–98.9%)、81.1%(95%:66.8–89.7%)和57.6%(95%: 42.3–70.2%)。未达到中位OS(图b)。
此外,31例(64.5%)患者达到了实体肿瘤缓解评价标准(RECIST)客观缓解;25例(52%)患者获得了部分缓解;6例(12.5%)患者获得了完全缓解。疾病控制率(完全缓解+部分缓解+稳定疾病)为93.7%。
疗效分析 2
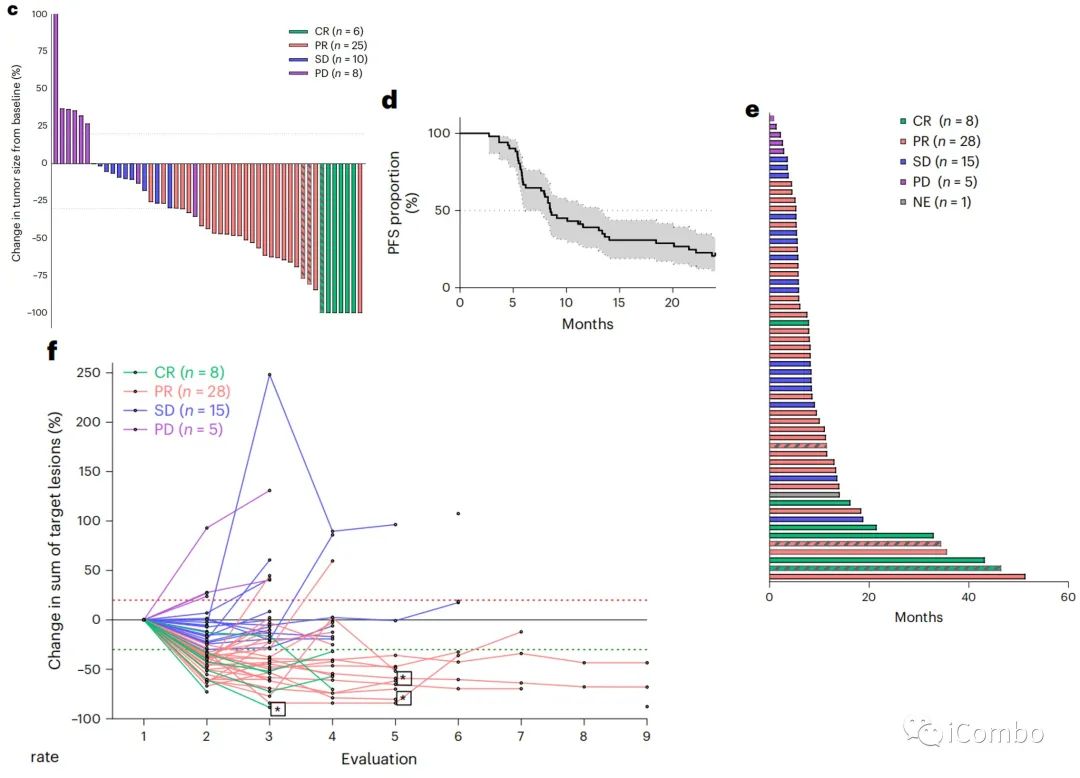
在整个人群中,6个月、12个月和24个月存活患者的估计百分比分别为96.5%(95%CI: 86.7–99.1%)、80.6%(95%CI: 67.6–88.8%)和59.1%(95%CI:45.1–70.6-%)。6个月、12个月和24个月的PFS患者的估计百分比分别为63.2%(95%CI: 49.3–74.2%)、38.5%(95%CI: 26-50.9%)和19.9%(10.6–31.3%)。所有患者的最佳反应见瀑布图。c). 中位治疗时间为5.4个月(0.9-12个月)。Kaplan-Meier、游泳图和蜘蛛图显示了反应的持续时间(DOR)。d–f).
疗效分析 3
中位DOR为8.5个月(95%CI : 6.2-13.4),28%的患者在12个月时仍接受durvalumab单抗治疗,6个月时为61%,而仅接受3个月的化疗。5名患者在研究者确定进展时重新引入了FOLFOX联合durvalumab单抗和曲美木单抗,3名患者在数据库关闭时仍有反应。在分析时,2名患者仍在接受治疗;34名患者因疾病进展停止研究;13名患者因其他原因停止治疗,因此复发;8名患者完全缓解,无复发。
基因组相关性的探索性分析 1
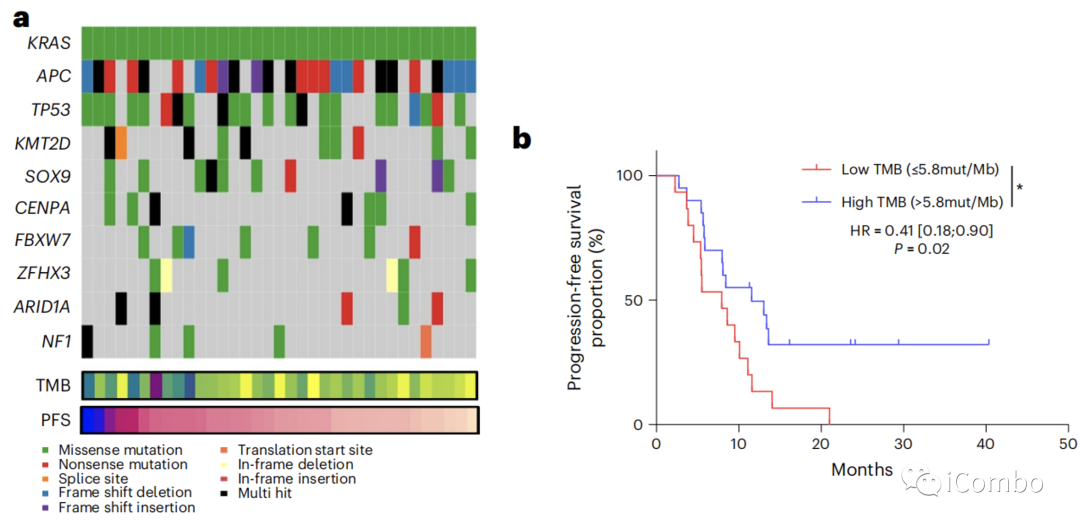
对37例患者进行了外显子组测序。最常见的突变是APC、KRAS和TP53(图2a)。
超过10%的患者未发生与PFS相关的基因改变(图2a)。
所有患者的中位TMB为每兆碱基(Mb)6.1个突变,且根据肿瘤侧度无差异(扩展数据图2a)。
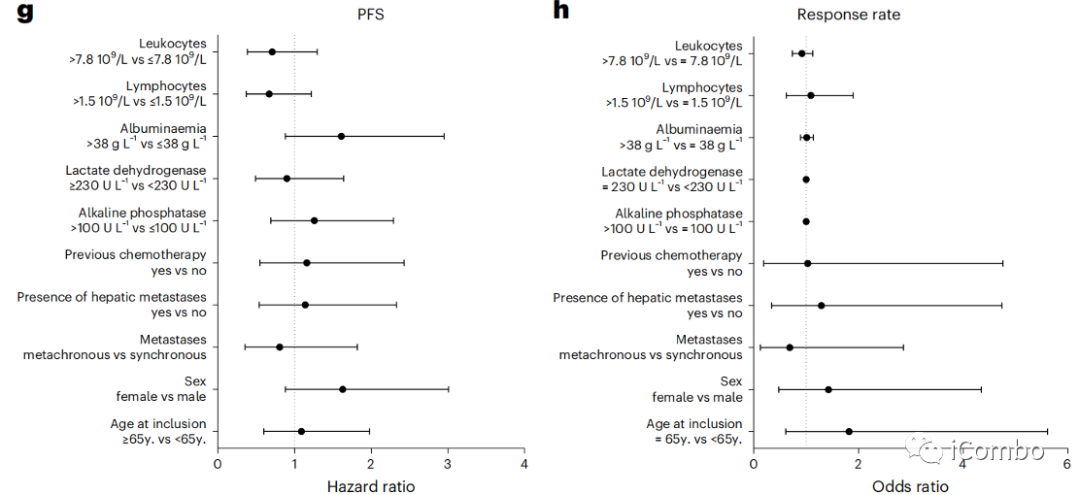
3例患者的TMB超过每Mb有10个突变;TMB > 5.8与较长的PFS相关(风险比(HR)=0.41, 95%CI: 0.18–0.90, P=0.02)(图2b)。
基因组相关性的探索性分析 2
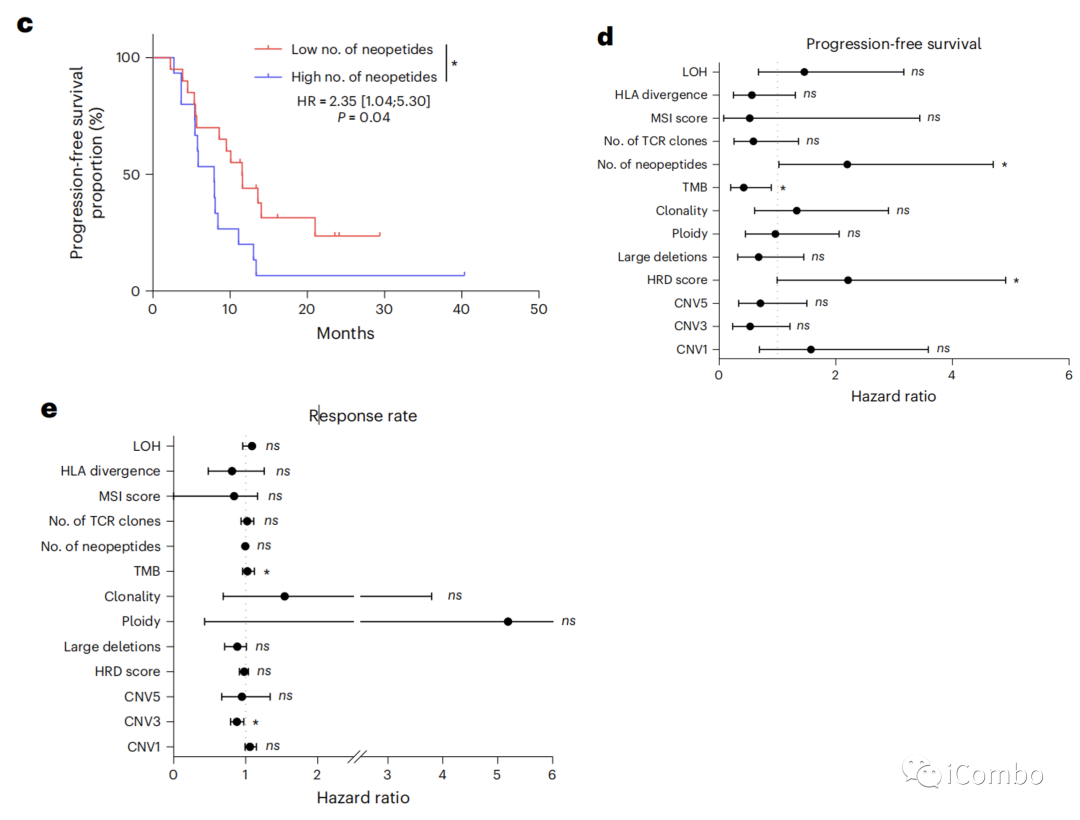
当我们评估与假定的免疫原性I类新抗原相关的非同义序列改变时(使用pVACtools21),我们发现低数量的新抗原(<14)与更好的PFS相关(HR=2.35, 95%CI: 1.04–5.30, P=0.04)(图2c)。
人白细胞抗原(HLA)I类位点的最大种系理化序列差异与PFS或客观应答率无关(图2d, e)。
基因组相关性的探索性分析 3
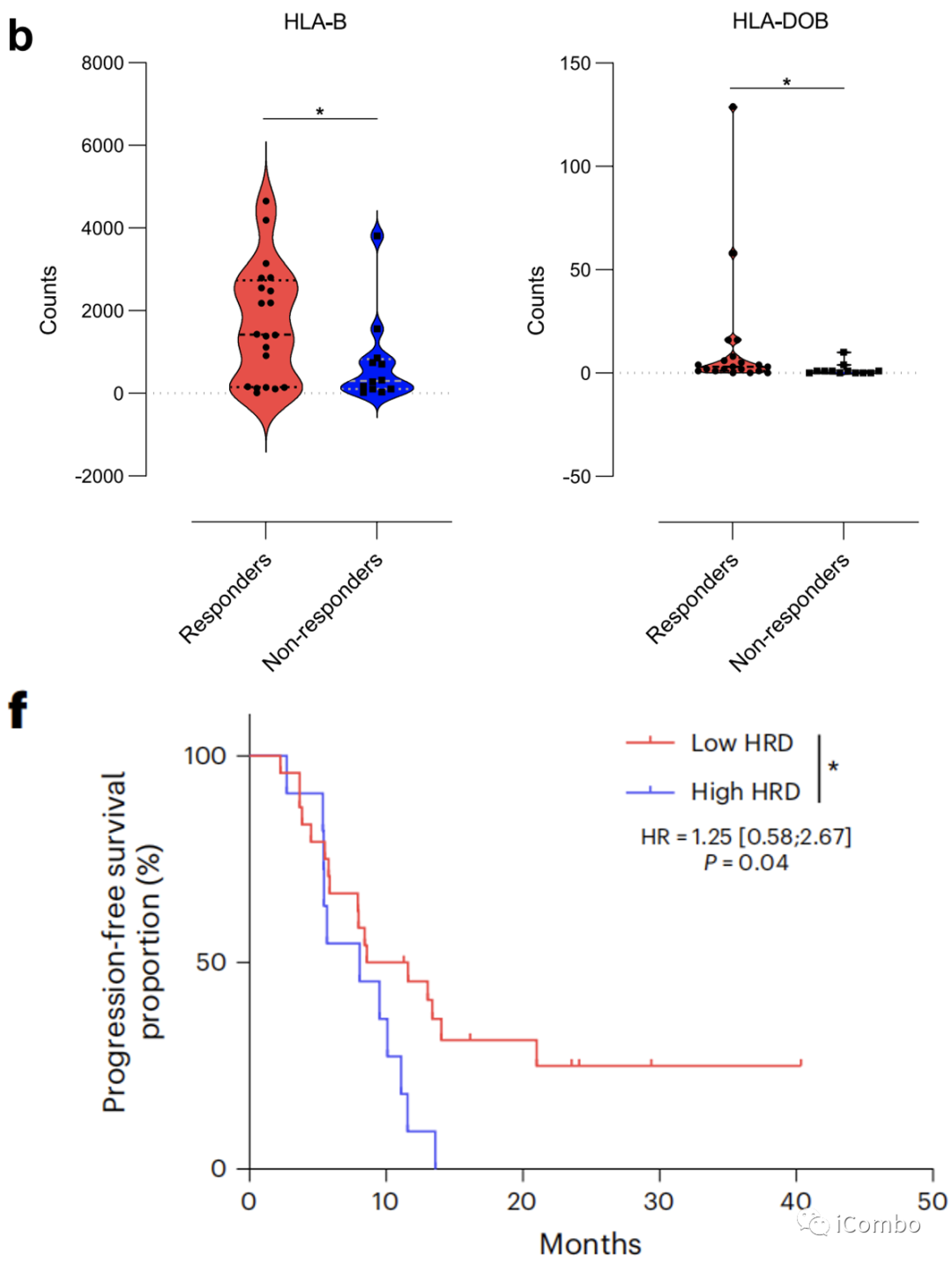
虽然HLA差异与结果无关,但HLA-B和HLA-DOB mRNA的高表达与更好的应答率相关,这表明更高的T细胞抗原呈递能力提高了治疗疗效(扩展数据图2b)。
肿瘤基因组改变的特征是克隆性、倍性、杂合性缺失和染色体大缺失。使用同源重组缺陷(HRD)评分来估计基因组结构的改变,这是一种衡量基因组不稳定性的测量方法;低HRD评分(<29)与较好的PFS相关(图2f)。
基因组相关性的探索性分析 4
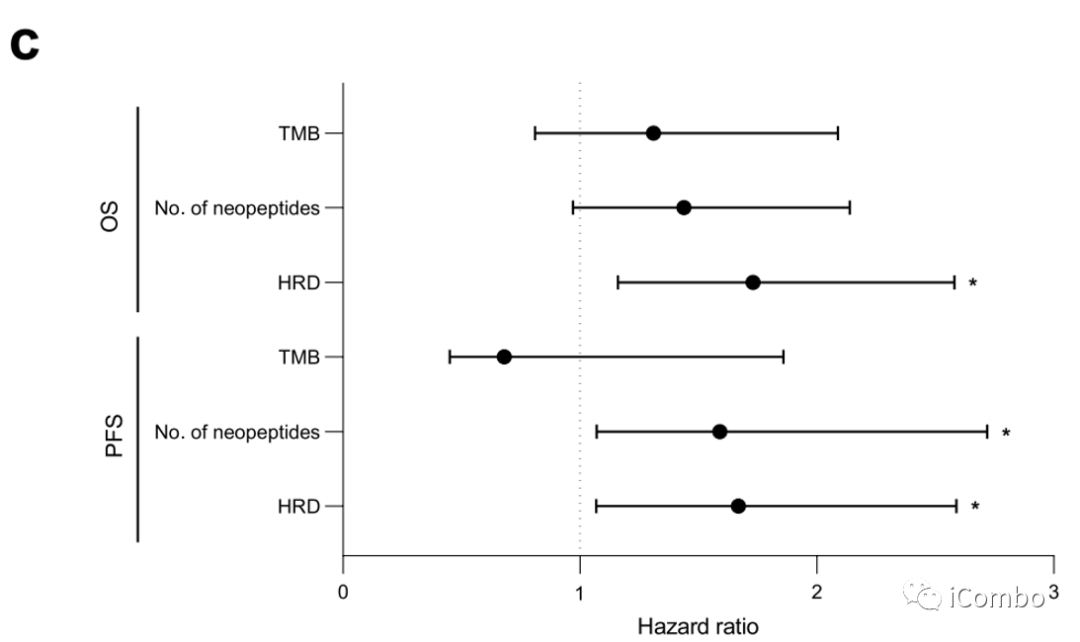
我们分析了来自癌症基因组图谱(TCGA)的341个CRC肿瘤的独立队列的肿瘤全外显子组测序数据,该数据早于免疫检查点封锁的时代。在TCGA队列中,TMB与PFS或OS无关。HRD评分与短PFS和OS相关,大量的新肽与短PFS相关(扩展数据图2c)。
总之,这些结果支持了,尽管TMB似乎是一个预测标记物,但其他基因组标记物更具有预后性而不是预测性。
转录组相关性的探索性分析 1
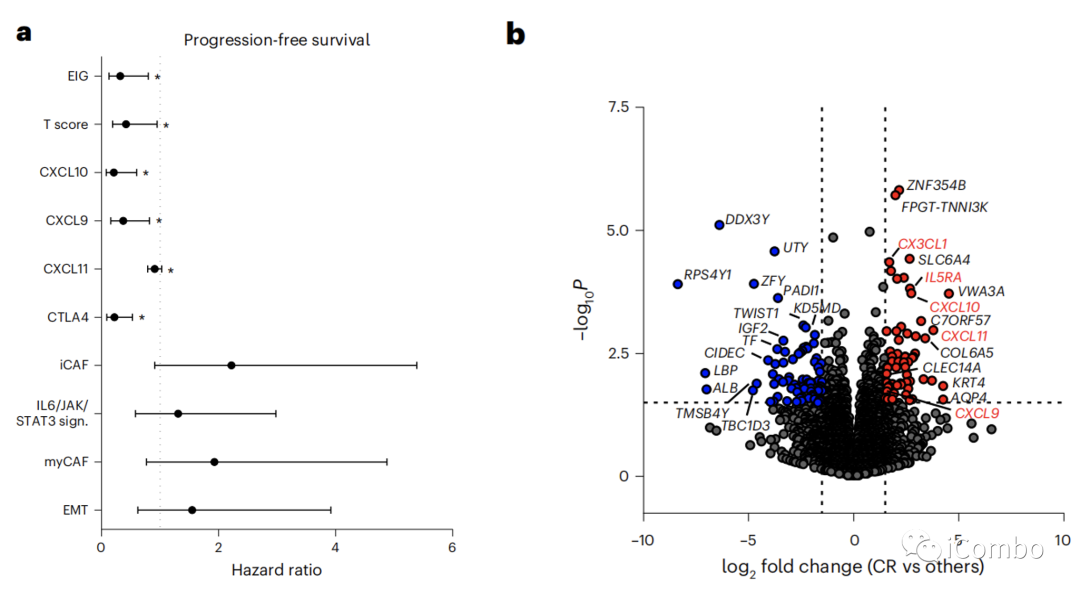
对36例患者进行RNA测序(RNA-seq)分析。采用差异基因分析的方法检测中位PFS与个体蛋白编码基因表达之间的关系。
使用ssGSEA、EMT、IL6/JAK/STAT3、CAF特征与较短的PFS呈边界关系,而免疫特征与较长的PFS相关(图3a)。
我们比较了完全应答者与其他患者的转录组谱。利用KEGG 2021通路对显著富集的基因,只有免疫相关通路显著富集呈应答者(趋化因子信号通路,细胞因子-细胞因子受体相互作用)(图3b)。
转录组相关性的探索性分析 2
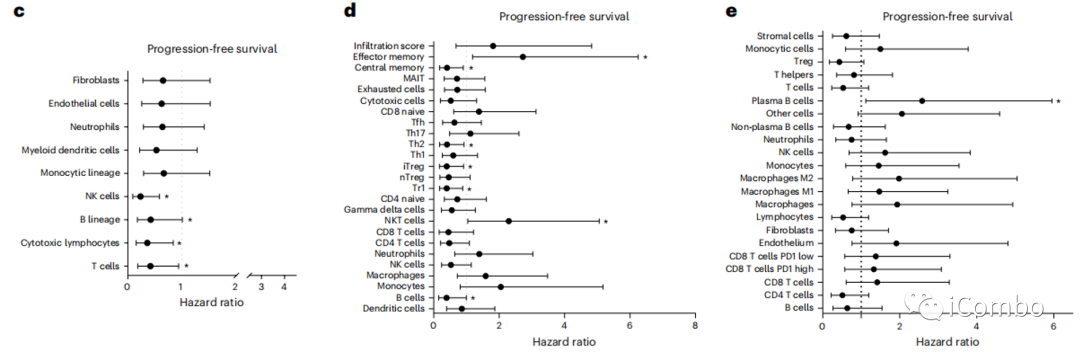
使用mcp-计数器23、ImmuCellAI24和Kassandra25软件来描述基线免疫浸润。
所有软件程序都显示基线时T细胞浸润与较长的PFS之间存在显著或边缘性关联(图3c-e)。
转录组相关性的探索性分析 3
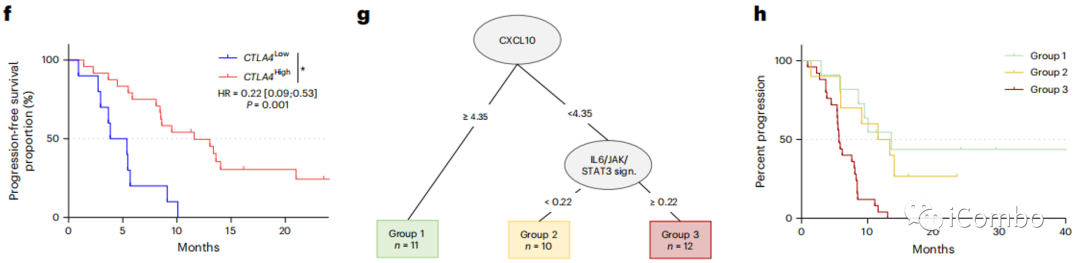
Durvalumab靶向PD-1和PD-L1之间的相互作用,而曲美木单抗靶向CTLA-4和CD80/CD86之间的相互作用。我们检测了PD-L1(CD274)、PD1(PDCD1)、CTLA-4、CD80和CD86的表达与PFS之间的关系。对于每个变量,使用最大选择秩统计法的最佳截断值将患者分为高评分组和低评分组。使用这种策略,我们观察到只有较高的CTLA-4 mRNA表达与更好的PFS相关(图3a,f)。为了进一步探索基质和免疫含量的各自作用,我们使用决策树,通过单变量分析与P < 0.1相关的所有免疫和基质特征。低CXCL10和高IL6/JAK/STAT3信号表达是预测预后的最重要的变量(图3g,h)
总之,这些数据强调了在免疫细胞、T细胞趋化剂趋化因子和低基质信号中富集的TME是对化疗免疫治疗有更好反应的预测因素。
免疫学相关性的探索性分析 1
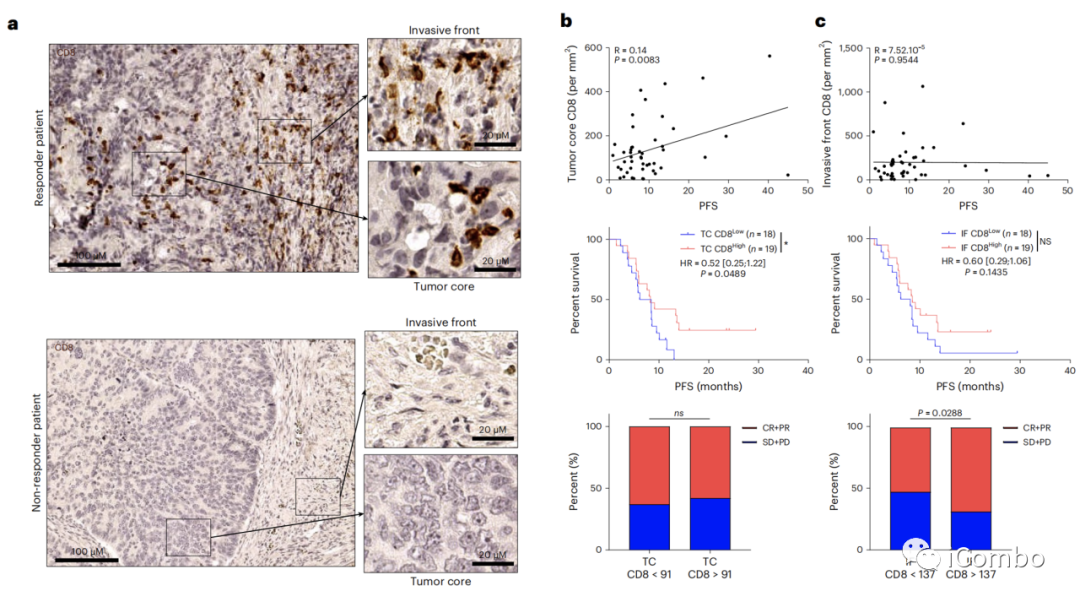
PD-L1 CPS的表达与结果无关(扩展数据图3a-d)。肿瘤核心的高CD8浸润与较好的PFS相关,而浸润边缘的高CD8与较好的应答率相关,但与较好的PFS无关(图4a-c)。
免疫学相关性的探索性分析 2
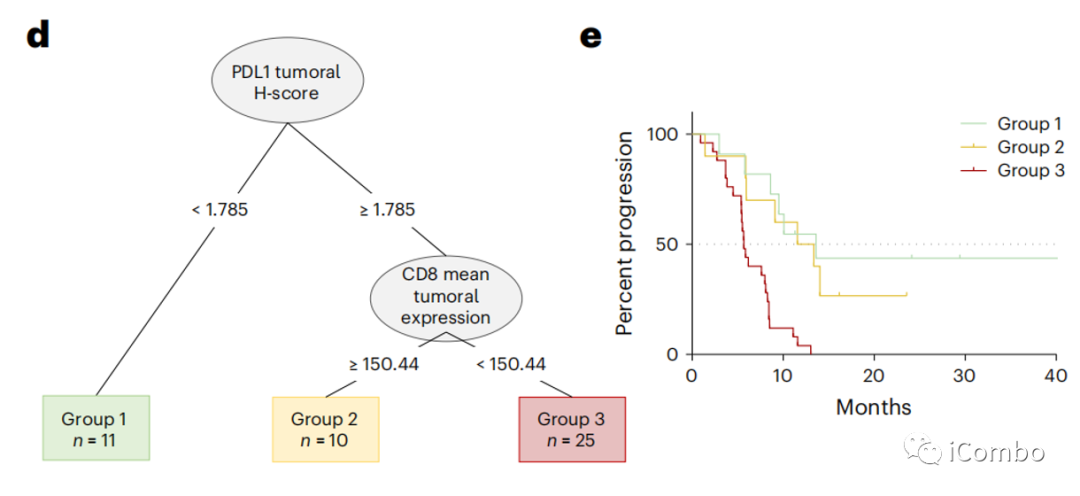
肿瘤核心中的PD-L1评分高和CD8数量可能与预测PFS相关。PD-L1评分高、肿瘤核心CD8浸润程度高的患者的PFS比其他患者更长(图4d,e)。
免疫学相关性的探索性分析 3
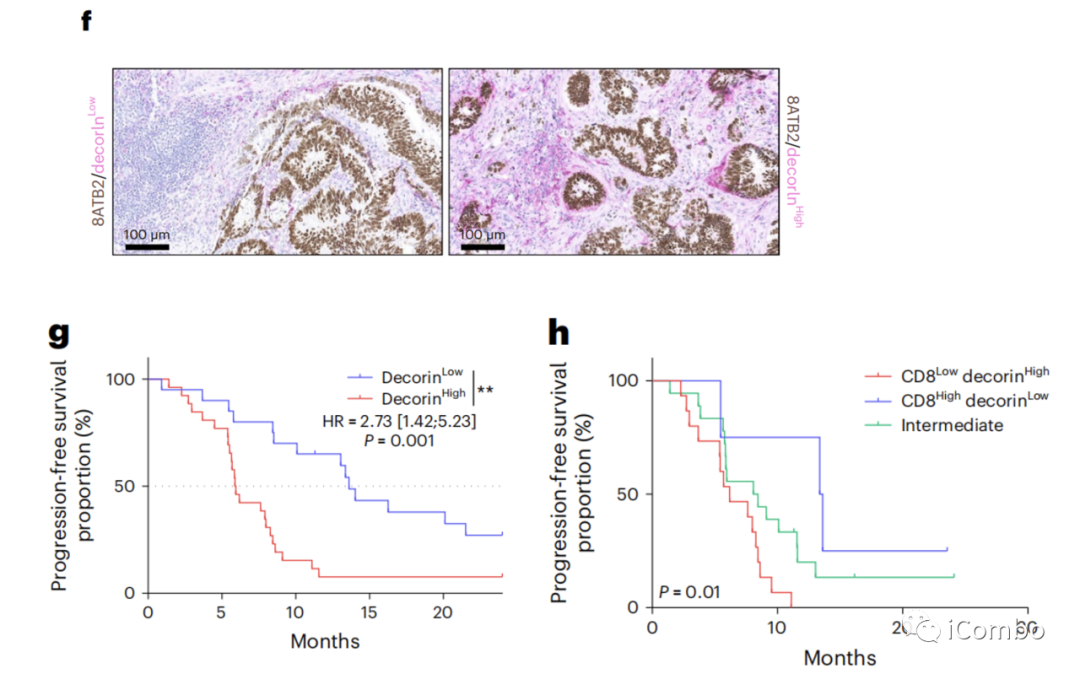
我们检测了核心蛋白多糖的表达,这是炎症性癌症相关成纤维细胞(iCAFs)中高表达的细胞外基质的一个组成部分。
我们观察到低核心蛋白多糖表达的患者有较长的PFS。
结合CD8和核心蛋白多糖的信息,我们观察到高CD8和低核心蛋白多糖表达患者有较长的PFS(图4h)。
免疫学相关性的探索性分析 4
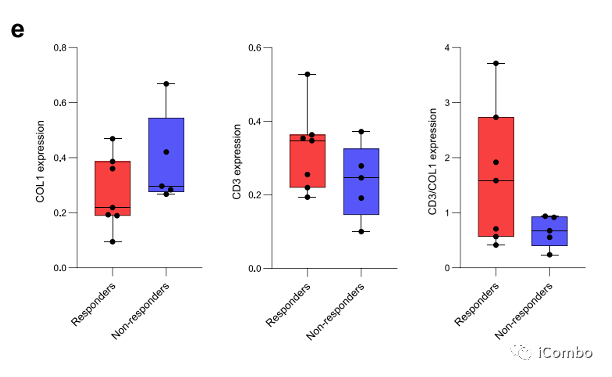
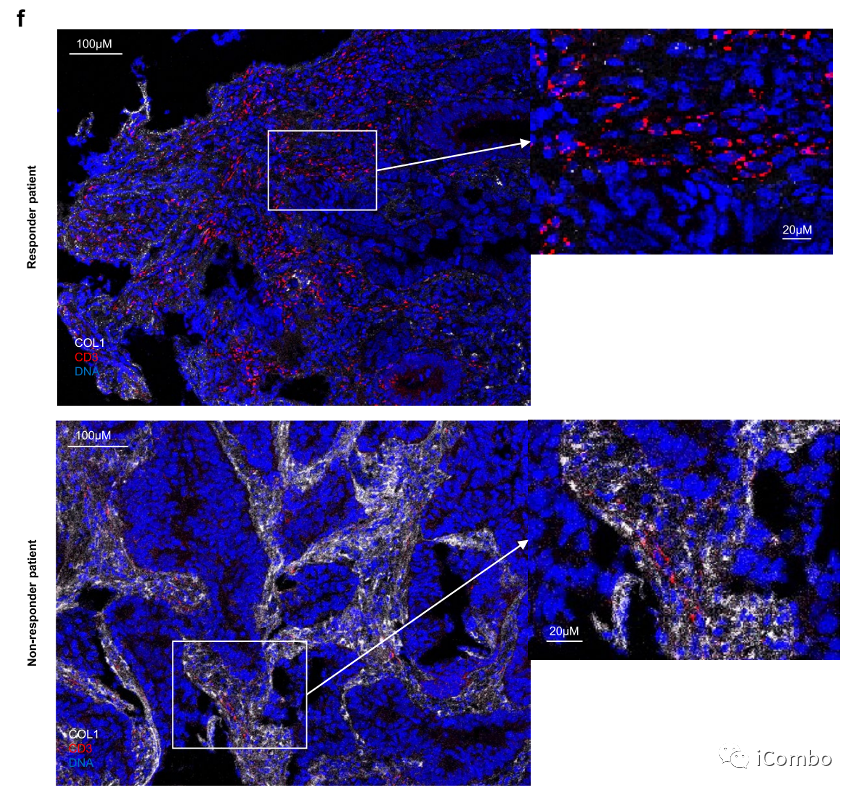
通过对7例有应答者和5例无应答者的成像质量细胞术,我们观察到,有应答者在CD3+细胞中富集,而无应答者在间质室中具有较高的1型胶原(COL1)含量。CD3+与COL1表达的比值可以预测客观反应,并可能是客观反应的一个有价值的标志。
在无反应的情况下,COL1表现出代表癌细胞和免疫细胞之间的保护性屏障(扩展数据图3e,f)。
免疫学相关性的探索性分析 5
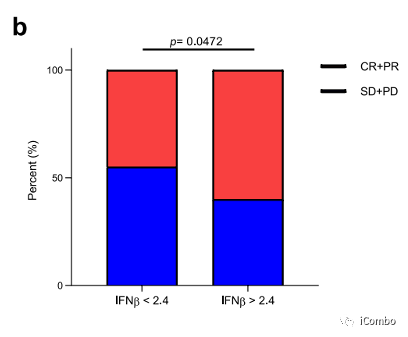
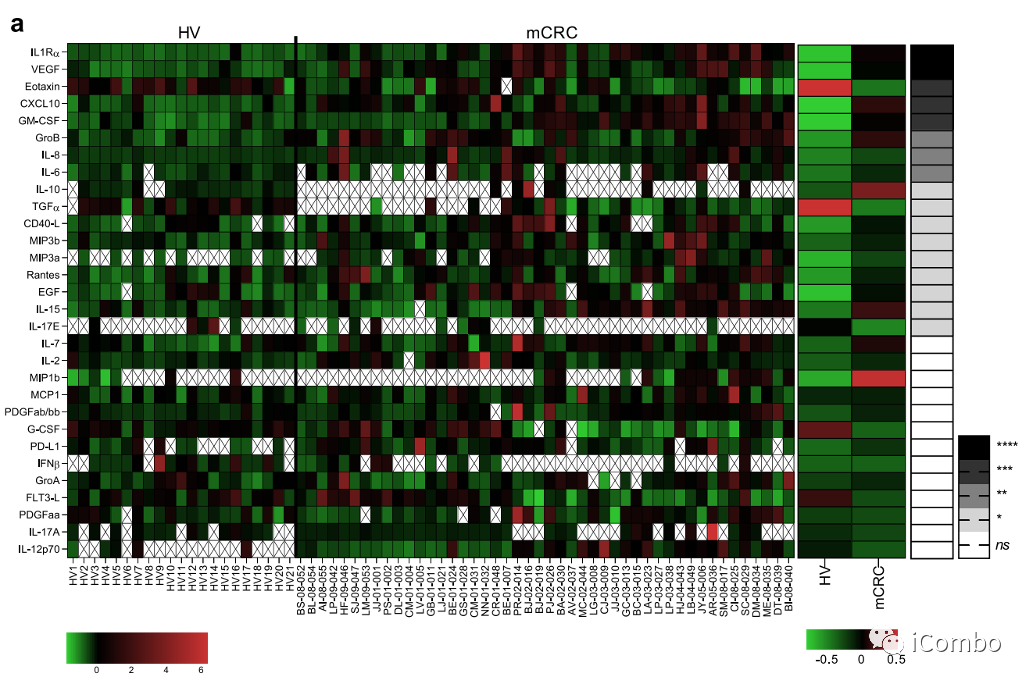
使用bioplex法检测44种不同的细胞因子(补充文件表1),我们注意到与对照组患者相比,转移性结直肠癌血浆中有17种细胞因子,这些细胞因子高度存在(扩展数据图4a)。只有高干扰素(IFN)-β的基线表达是与较好的响应率相关(扩展数据图4b)。
免疫学相关性的探索性分析 6
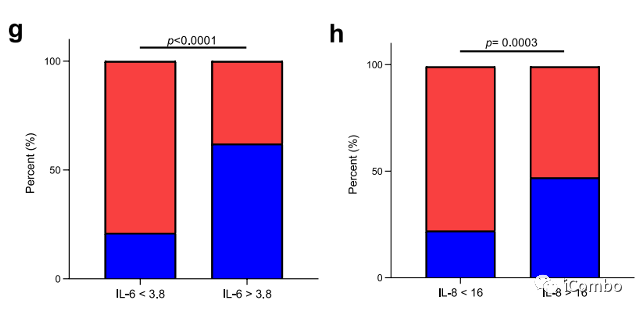
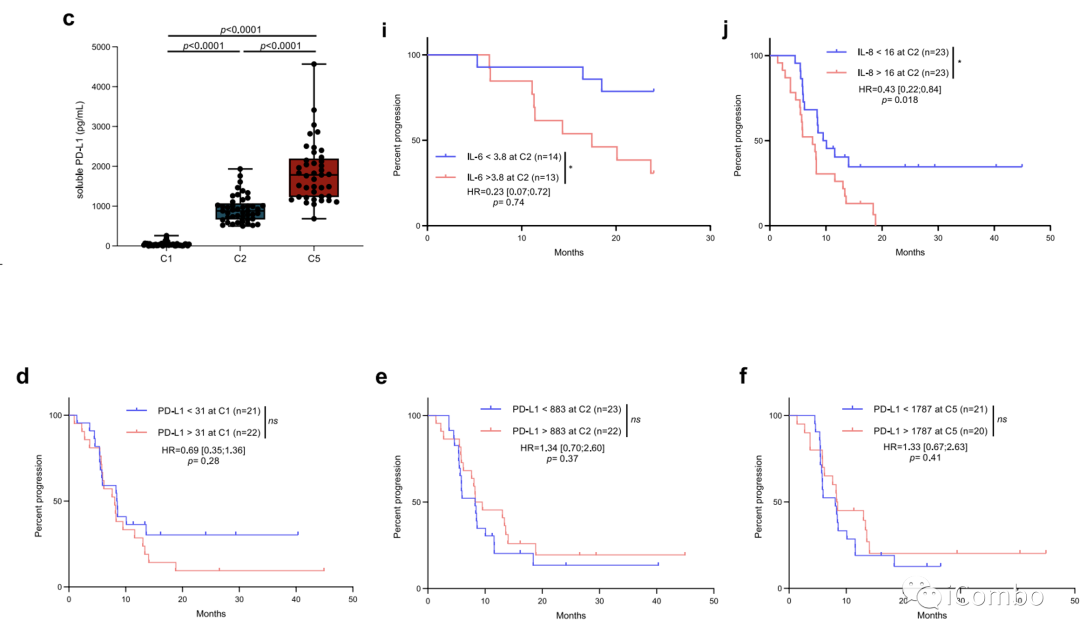
在治疗期间,我们观察到可溶性PD-L1水平升高,尽管与结果无关(扩展数据图4c-f)。经过一个治疗周期(C2)后,高水平的白细胞介素(IL)-6和IL-8与较差的反应率(扩展数据图4g、h)和较短的PFS(扩展数据图4i、j)相关。
免疫学相关性的探索性分析 7
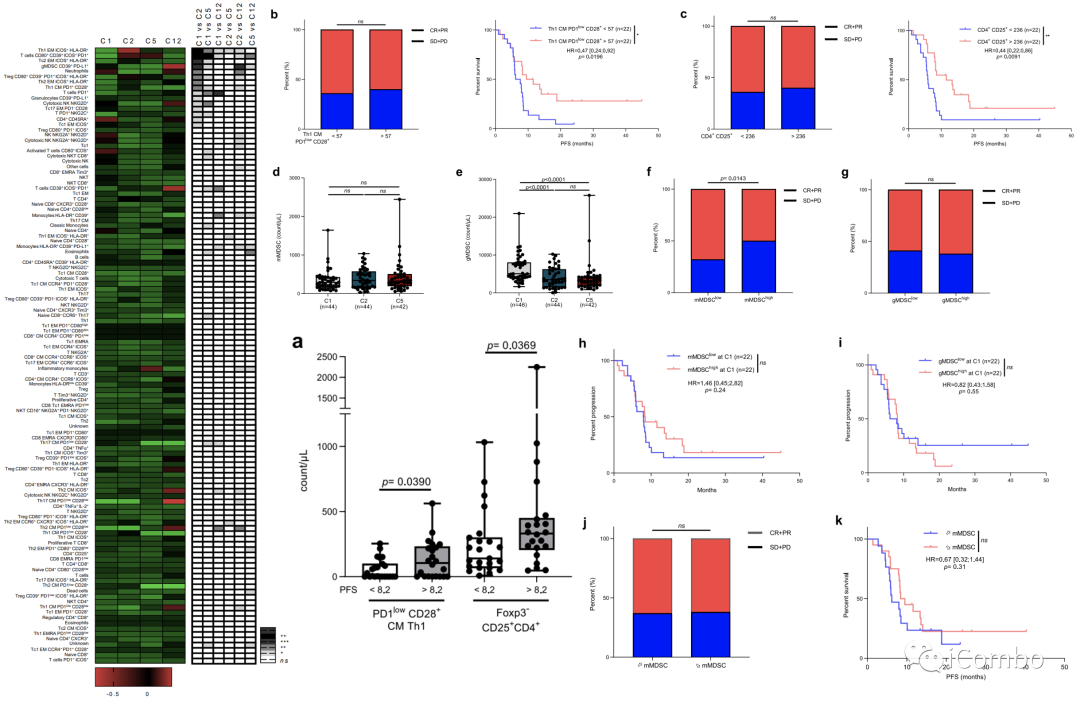
为了了解治疗的全身免疫效应,我们检测了57例在基线、周期2和周期5时均有现有样本的患者的外周血单个核细胞(PBMCs);我们共区分了36种免疫细胞类型(补充文件图。在基线时,只有高水平的Foxp3−CD4+CD25+和Th1 PD1低的CD28+中央记忆细胞与更好的PFS相关(扩展数据图。5a–c).
单核细胞髓系来源的抑制细胞(mMDSCs)不受治疗的影响,而粒细胞MDSCs(gMDSCs)在C2和C5时下降(扩展数据图。5d,e).
高水平的mMDSCs,而不是gMDSCs,与较差的反应率相关.mMDSCs和gMDSCs均未与PFS相关.
治疗期间MDSC水平的降低与应答率和PFS均无关。
免疫学相关性的探索性分析 8
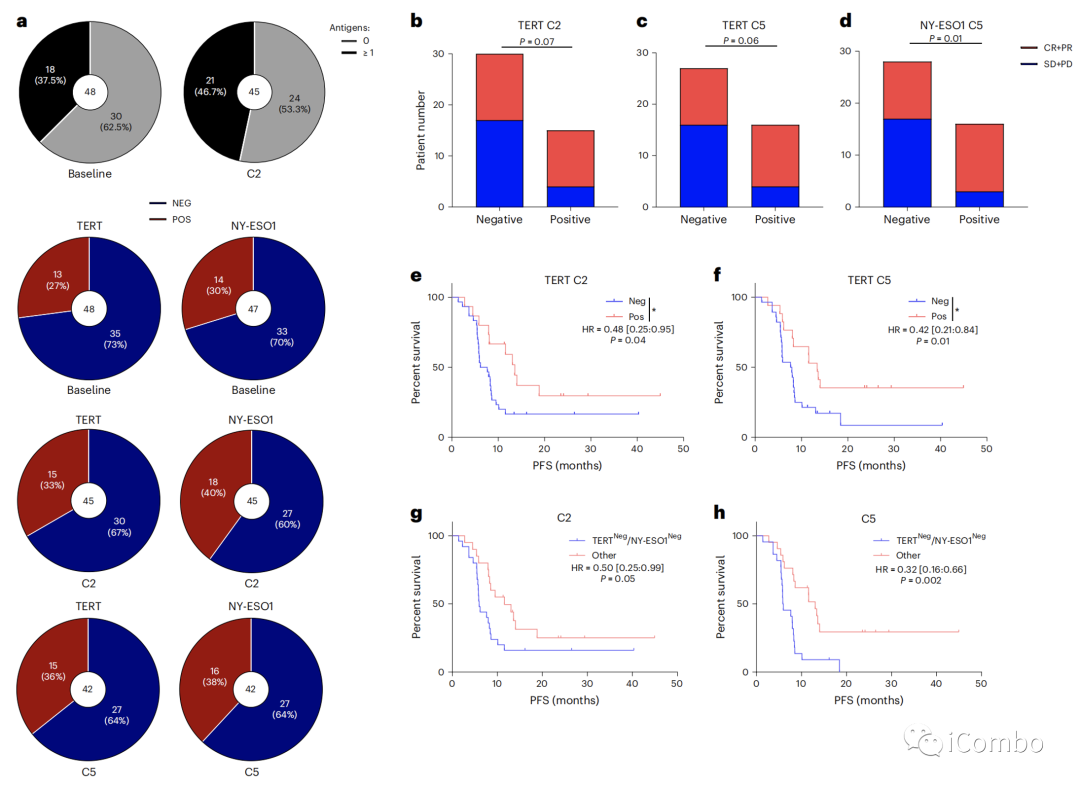
利用ELISpot,我们研究了抗肿瘤特异性T细胞对血液中共享的肿瘤抗原、端粒酶和NY-ESO1的反应。我们观察到,37.5%的患者对这两种抗原中的至少一种出现了基线T细胞反应。
在一个治疗周期后,46.7%的患者中检测到T细胞对任何一种抗原的反应增加. 针对这些抗原的基线反应与客观反应或PFS无关.相比之下,在C2和C5处发现的T细胞对端粒酶的反应与更好的客观反应和显著延长的PFS相关。
同样,在C5处发现的T细胞对NY-ESO1抗原的应答的诱导与更好的应答率相关.对T细胞对端粒酶和NY-ESO-1的反应的联合分析显示,在C2或C5处至少存在一种反应性,与更长的PFS显著相关。这些数据支持了基线免疫浸润的存在和针对共同肿瘤抗原的免疫反应的诱导与对治疗的反应相关。
研究结论
本研究报道了一线化疗联合免疫治疗对ras突变转移性结直肠癌的临床和生物学反应。本研究达到了其主要目标,3个月PFS为90.7%,6个月PFS为60%,中位PFS为8.2个月,而单纯FOLFOX治疗后该人群的预期中位PFS为5-6个月。该方案产生了与贝伐珠单抗联合化疗相似的结果,后者PFS大约8个月。
在应答率方面,该研究的客观应答率为63%,与FOLFOX单药治疗突变RAS肿瘤的36%相比。该试验产生了迄今为止相关报道最好的客观反应率之一。
MSS CRCs占所有转移性CRC的95%,其特征是低TMB率和低免疫浸润率。此外,KRAS突变与CRC中CD8 T浸润和HLA表达减少相关,因此,KRAS突变的肿瘤细胞被T细胞识别的机会较低。
肝转移是免疫治疗的不利因素。CD3和CD8 T细胞在CRC浸润边缘和肝转移中的积累与预后相关。肿瘤部位的CTLA-4表达与更好的反应相关。与单独抗PD-1/PD-L1相比,联合抗CTLA-4治疗疗效更佳。
转录组学分析中的高免疫浸润,加上高CD8和高PD-L1的结合,与结果相关。除了免疫特征外,炎症性癌症相关成纤维细胞(iCAFs)的低存在和低核心蛋白多糖水平与更好的反应相关,他们可能是T细胞和肿瘤细胞之间的屏障。说明对基线免疫浸润和成纤维细胞反应的分析在预测化疗免疫治疗的疗效方面可能很重要。
化疗免疫治疗可以促进针对MSS转移性结直肠癌中共享的肿瘤抗原和新抗原的免疫应答,并且这种免疫应答与治疗应答相关。最后,对长应答者患者的单细胞和基因组分析表明,除了产生针对共享新抗原的T细胞应答外,这种化疗-免疫治疗方案还在肿瘤部位和周围诱导和扩增了肿瘤特异性新肽免疫应答。
缺陷:本研究受到样本量小和缺乏FOLFOX单药治疗对照组的限制。
总之,该研究报道了一线化疗免疫治疗治疗不可切除的MSS转移性结直肠癌的良好临床疗效,并通过深入的分子和免疫分析,为更好地选择MSS转移性结直肠癌患者进行化疗免疫治疗提供了线索,具有潜在的广泛临床意义。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)