首页 > 医疗资讯/ 正文
研究亮点
- 细胞外基质(ECM)在肿瘤微环境(TME)中的动态重塑决定了肿瘤免疫调控的双向作用,既促进肿瘤进展也形成免疫抑制屏障。
- 关键ECM成分如胶原蛋白(COL)、透明质酸(HA)、糖蛋白及蛋白多糖通过影响免疫细胞的活化、迁移和浸润,显著影响免疫治疗效果。
- 新兴靶向ECM的策略结合免疫检查点抑制剂(ICIs)和细胞治疗,展示了改善免疫细胞浸润和增强治疗效能的良好前景。
研究概述
本文综述发表在Journal of Hematology & Oncology上,系统阐述了肿瘤微环境中细胞外基质(ECM)动态变化对肿瘤免疫调控的影响。研究聚焦ECM的异质性及其关键成分在调控免疫细胞行为中的作用,尤其强调了ECM机制如何影响免疫治疗的响应率和耐药性。基于最新的研究进展,文章探讨了针对ECM重塑的治疗策略,以期为肿瘤免疫治疗的优化提供理论依据和临床指导。

研究背景
免疫检查点抑制剂(ICIs)已成为当代癌症治疗的里程碑,但仅少部分患者从中获益。导致免疫治疗效应差异的根源之一正是复杂且动态变化的肿瘤微环境(TME)。TME包括肿瘤细胞、多种周围细胞类型及细胞外基质(ECM)。ECM作为TME的重要组成部分,通过提供机械支持和生化信号传导,调节了免疫细胞的活化、迁移与效能。同时,ECM的重塑形成了物理和化学屏障,限制了免疫细胞的肿瘤浸润,并促进免疫逃逸。本领域当前面临的挑战在于全面理解ECM动态调控机理及制定选择性靶向病理性ECM但保护其稳态功能的策略。
研究方法
作为综述性文章,本文未涉及实验方法部分,重点整合了当前关于ECM与肿瘤免疫调控交互作用的研究成果,涵盖了生物力学、免疫学及代谢等多学科视角。
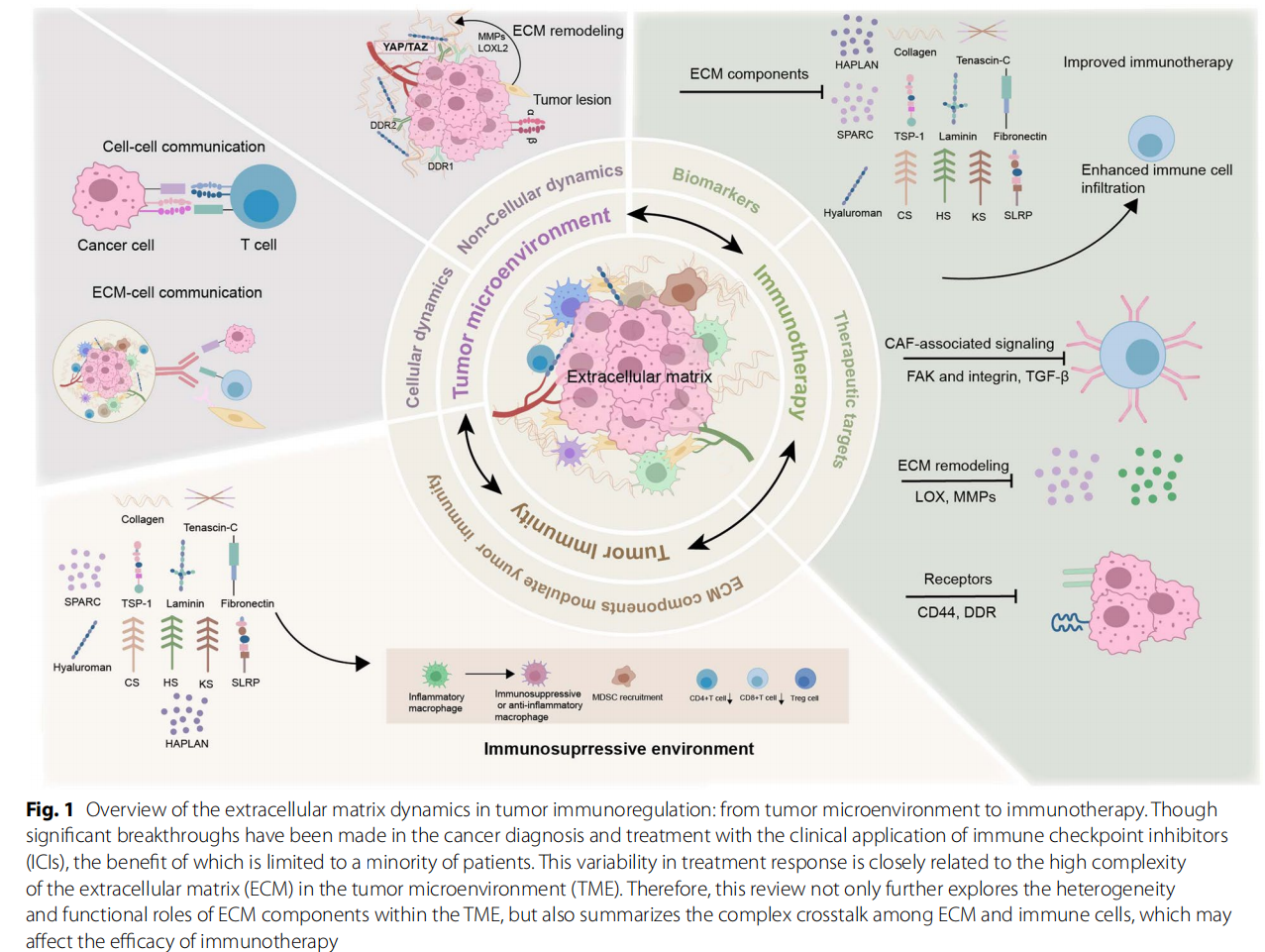
主要研究结果
ECM与肿瘤微环境(TME)的复杂交互
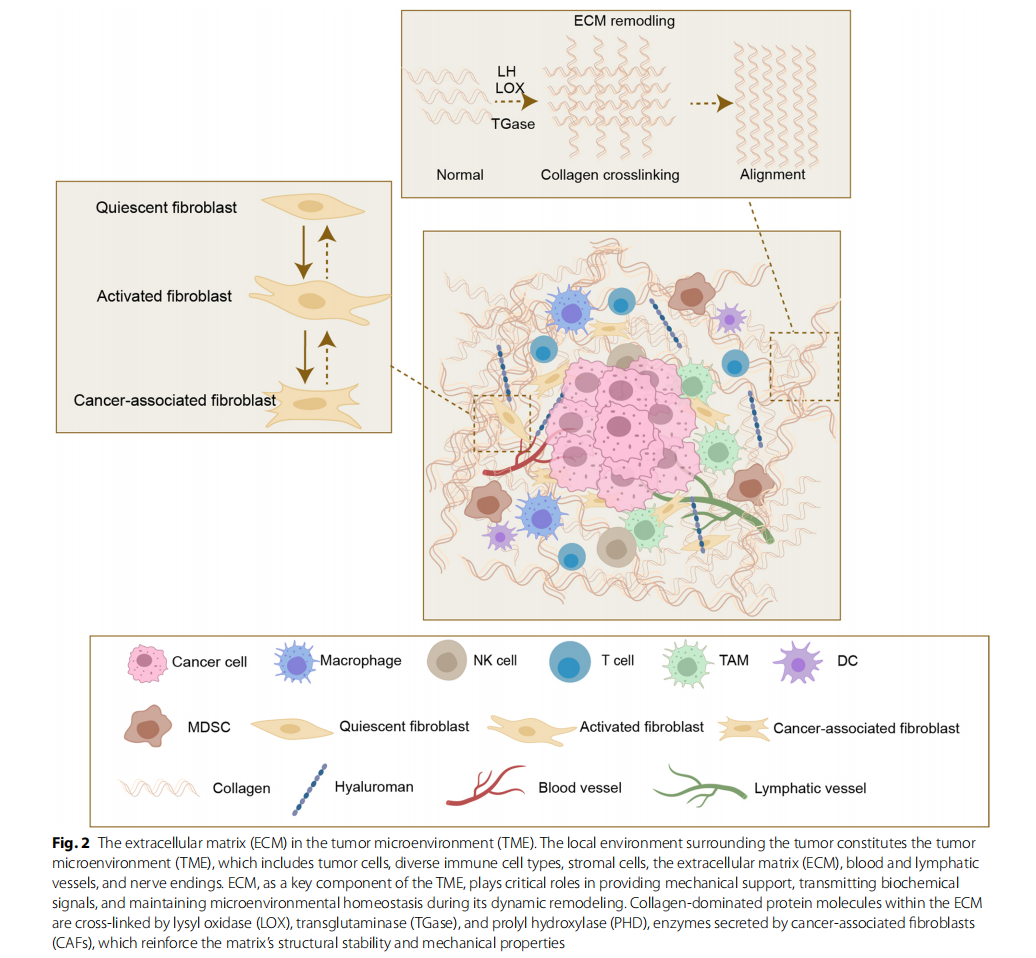
- TME组成及动态变化:TME由肿瘤细胞、免疫细胞、基质细胞及ECM构成,其细胞成分和功能状态随肿瘤进展、部位及组织差异而异。晚期肿瘤通常伴随着免疫抑制细胞(M2型巨噬细胞、调节性T细胞)比例升高,ECM成分和结构亦发生改变,影响免疫细胞行为。
- ECM的结构与成分:ECM由基底膜(如胶原IV型、层粘连蛋白)及间质基质(如胶原I型、III型、透明质酸、纤维连接蛋白)两大部分组成。ECM通过蛋白交联酶(LOX、转谷氨酰胺酶)、降解酶(MMPs、ADAMTS)促使其重塑,调控基质结构稳态、力学性质及信号环境。
ECM作用于免疫细胞的多重机制
-
生物力学信号与免疫细胞功能
ECM刚度及纤维排列影响免疫细胞迁移路径和激活状态。例如,刚性增强激活YAP/TAZ通路,促进肿瘤细胞干性和免疫逃逸;硬质胶原纤维限制CD8+ T细胞浸润,引发免疫抑制。 -
胶原蛋白的双重作用
胶原蛋白可作为物理屏障阻碍免疫细胞进入肿瘤核心,同时分解产物可激活免疫应答。胶原与细胞表面受体DDR1/DDR2、整合素、LAIR-1相互作用,调节免疫细胞耗竭及免疫逃逸。胶原I型尤其在肿瘤免疫调控中发挥关键作用。 -
糖蛋白和蛋白多糖的免疫调控
Tenascin-C通过TLR4诱导CXCL12,促进M2型巨噬细胞极化,抑制CD8+ T细胞肿瘤浸润;SPARC诱导骨髓来源抑制性细胞(MDSCs)、促进免疫抑制微环境形成。透明质酸(HA)的分子量决定其功能:高分子HA维持组织稳定,低分子HA促进免疫抑制表型,通过CD44受体介导免疫细胞极化。
代谢与机械信号的交汇点
-
ECM-线粒体联动
ECM刚度通过机械信号调控线粒体分裂与转位,影响肿瘤及免疫细胞代谢和功能。YAP通路调节线粒体活性,增强调节性T细胞(Tregs)免疫抑制功能。ECM代谢重编程为免疫逃逸提供能量基础。 -
低氧微环境的双向调控
ECM交联增强组织硬度,限制氧气扩散,形成功能性低氧。低氧激活HIF-1α,促进胶原沉积及免疫抑制细胞募集。同时,低氧通过诱导DNA修复缺陷增强肿瘤免疫原性,为联合低氧-免疫疗法提供机会。
ECM动态调控与治疗抵抗
- ECM刚度及间质压力升高极大妨碍药物渗透和免疫细胞浸润,成为免疫治疗及化疗耐药的重要屏障。
- 抑制ECM交联酶(如LOX)、胶原或整合素信号通路可部分逆转耐药,但目前大多靶向药物尚未取得理想的临床效果。
- 致力于重塑ECM结构以提升免疫细胞浸润和功能的治疗策略正在探索中,包括纳米载体辅助药物精准递送和联合免疫治疗。
ECM相关生物标志物及治疗靶点
表:不同肿瘤中ECM主要组分的作用及潜在治疗干预
ECM相关蛋白如胶原、HA和糖蛋白的表达模式与肿瘤预后密切相关,并在免疫治疗反应预测中显示潜力。
当前临床试验中,针对ECM酶(如LOX、MMP)和分子(整合素、DDR1等)的药物多表现出有限疗效,提示需优化靶点选择及联合治疗策略。
研究意义与展望
本综述全面揭示了ECM及其动态重塑在肿瘤免疫调控中的多层次作用,强调了ECM不仅作为物理屏障,更是免疫抑制细胞招募和免疫细胞功能调节的重要介质。随着单细胞测序和多组学技术的发展,解析ECM-免疫细胞互作的机制为发现新型免疫治疗靶点及预测生物标志物提供了可能。
未来研究应重点解决ECM异质性带来的临床转化挑战,开发时空可控的ECM靶向策略,合理联合免疫疗法以逆转免疫排斥微环境,提高免疫治疗整体效益。同时,深入发掘ECM与代谢重编程和机械信号传导的联系,有助于设计多靶点综合干预方案,更精准地控制肿瘤进展和克服疗法耐药。
原始出处
Hu Q, Zhu Y, Mei J, Liu Y, Zhou G. Extracellular matrix dynamics in tumor immunoregulation: from tumor microenvironment to immunotherapy. Journal of Hematology & Oncology. 2025;18:65. DOI: 10.1186/s13045-025-01717-y
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)