首页 > 医疗资讯/ 正文
扩张型心肌病(DCM)是心力衰竭的第二大常见原因,在普通人群中的估计患病率超过0.4%,其特征为左心室或双心室扩张和心脏收缩功能受损。DCM具有较高的死亡率(1年死亡率为25-30%,5年生存率为50%),其中心力衰竭(70%)和猝死(25-30%)是最常见的死亡原因。多种遗传突变与DCM有关,尤其是在编码细胞骨架、肌节、桥粒或核膜蛋白的基因上。其中,与LMNA基因相关的DCM (LMNA-DCM)受到了广泛关注,其占DCM病例4-8%。LMNA的突变与十多种已定义的临床疾病有关,统称为核纤层蛋白病,如哈钦森-吉尔福德早衰综合征(HGPS)、常染色体显性遗传的埃默里-德赖弗斯肌营养不良症(EDMD)、肢带型肌营养不良症以及DCM。与其它类型的DCM相比,LMNA-DCM相对不典型且更为严重,患者突出表现为早期出现危及生命的心脏电生理异常,如房室传导阻滞和室性心动过速及颤动。
2024年8月14日,浙江大学转化医学研究院/浙江大学医学院附属第一医院梁平教授团队联合浙江大学医学院附属邵逸夫医院蒋晨阳教授团队在Nature Communications杂志在线发表题为“Lamin A/C deficiency-mediated ROS elevation contributes to pathogenic phenotypes of dilated cardiomyopathy in iPSC model”的研究论文。该研究揭示了Lamin A/C缺乏引起的活性氧自由基(ROS)紊乱在LMNA-DCM发展过程中具有重要作用,改善受损的sirtuin 1 (SIRT1)活性和过量的氧化应激是LMNA-DCM潜在的未来治疗策略。

该研究招募了一个DCM家系,包括先证者和他的妹妹。两位患者最初被诊断为房颤,两年后,两位患者发展为房室传导阻滞,并植入了起搏器。先证者的心电图上出现了室性早搏和非持续性室性心动过速。基因检测结果显示,两位患者携带LMNA基因的新发杂合移码突变(c.1163dupC; p.A388fs)。在随访期间,先证者的妹妹不幸猝死去世。为了研究该突变的致病性和致病机制,研究人员应用体细胞重编程和CRISPR/Cas9技术建立了多个LMNA-DCM患者特异性以及基因组编辑的诱导多能干细胞衍生的心肌细胞(iPSC-CMs)模型。研究人员发现,LMNA-DCM患者来源的iPSC-CMs表现出细胞内舒张期Ca2+浓度(diastolic [Ca2+]i)升高、Ca2+处理(Ca2+ handling)紊乱、心律失常负担增加、核膜形态异常。通过对患者组和基因矫正组iPSC-CMs的蛋白组学分析结合相关的实验验证,研究人员发现患者组iPSC-CMs存在线粒体形态和功能缺陷,同时伴随全细胞和线粒体ROS水平的上升。
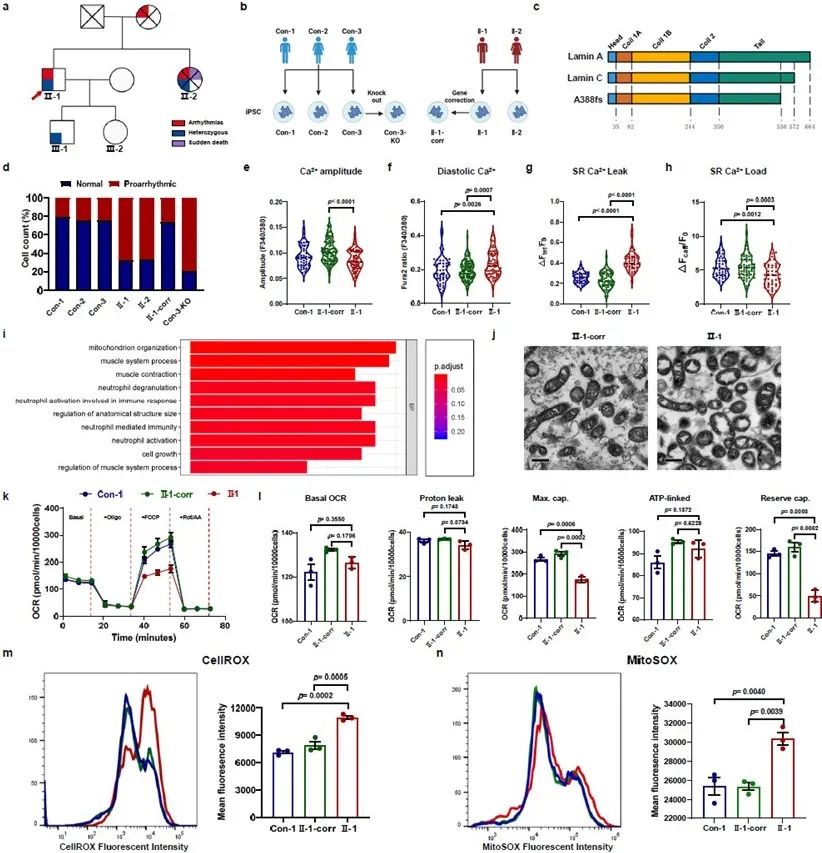
图1. Lamin A/C缺乏导致心律失常、Ca2+处理异常、线粒体功能障碍和ROS水平上升
SIRT1是线粒体功能的关键调节器,并且已被报道与lamin A相互作用。研究人员在iPSC-CMs模型系统中确认了SIRT1和lamin A之间的相互作用。在患者组和LMNA基因敲除(LMNA-KO)组iPSC-CMs中,与对照组相比,SIRT1的降解速率显著加快。Lamin A/C的单倍体剂量不足(haploinsufficiency)引起了SIRT1与lamin A之间的相互作用受损以及SIRT1降解速率加快,从而导致SIRT1缺乏。通过SIRT1激活剂(SRT 1720)的处理,患者组iPSC-CMs中的线粒体功能障碍和氧化应激均显著减轻,表明lamin A/C缺乏相关的SIRT1下调导致了LMNA-DCM中线粒体功能受损和ROS增加。
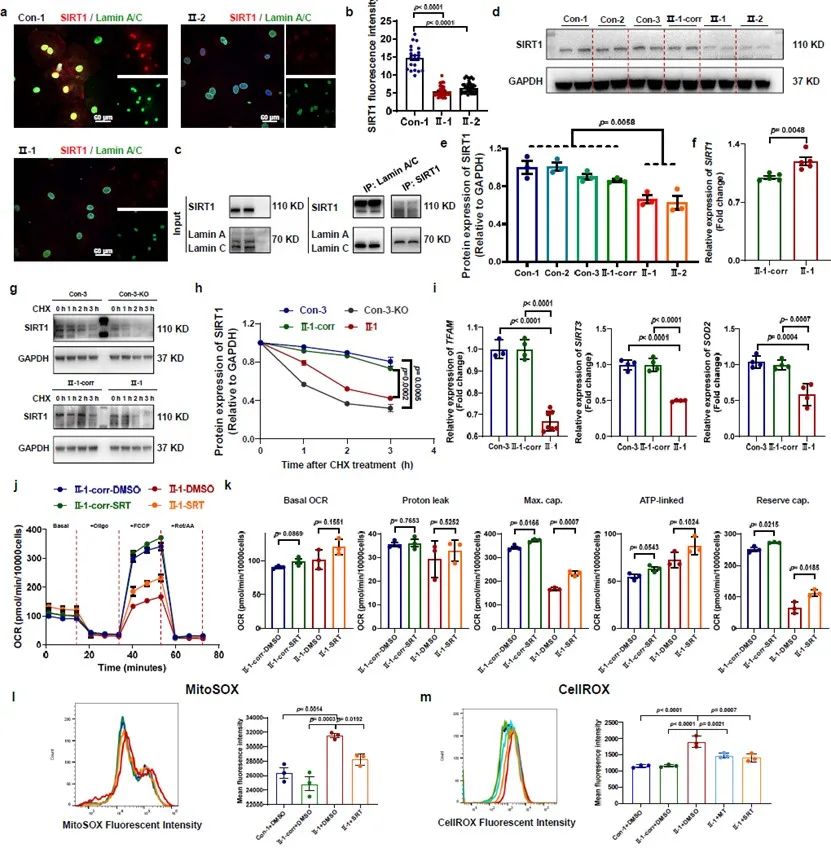
图2. SIRT1降解加速导致线粒体功能障碍和ROS水平上升
ROS-CaMKⅡ-RYR2信号通路已在多项研究中被证实会加剧心脏功能障碍并导致心律失常。研究人员发现在氧化应激条件下,CaMKⅡ的磷酸化和氧化水平显著升高,作为关键介质,激活的CaMKⅡ增加了肌浆网兰尼碱受体2 (RYR2)的磷酸化水平,并介导肌浆网的Ca2+泄漏(Ca2+ leak),扰乱细胞内舒张期Ca2+浓度,最终导致心律失常发生。患者组iPSC-CMs中的Ca2+处理紊乱和心律失常表型通过SIRT1激活剂(SRT 1720或白藜芦醇)或ROS清除剂(NAC或mitoTEMPO)的干预得到了显著逆转。研究人员还发现由于线粒体功能障碍导致的过量ROS加速了SUN1的积累,SUN1是核膜变形的重要病理因素。在SIRT1激活剂或ROS清除剂的作用下,随着氧化应激的减轻,SUN1的表达显著降低,患者组iPSC-CMs中的核膜结构缺陷得到了部分纠正。
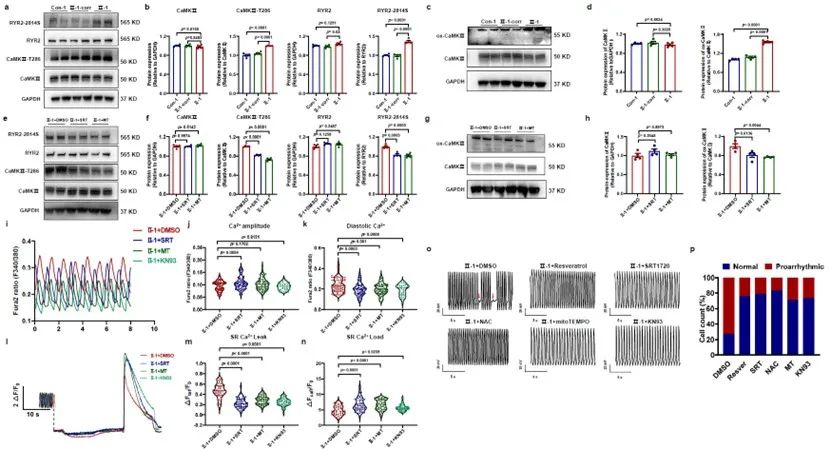
图3. 下调的SIRT1通过激活ROS-CaMKⅡ-RYR2信号通路诱发心律失常表型
此外,研究人员还构建了基于iPSC-CMs的工程化心肌组织(EHTs)模型,并在组织水平上复现了心肌细胞模型中观察到的病理表型。研究人员观察到在使用CaMKⅡ抑制剂或SIRT1激活剂处理后,患者组EHTs的结构变得更加紧凑,收缩力显著提高,其对起搏刺激的响应能力也得到了显著改善。
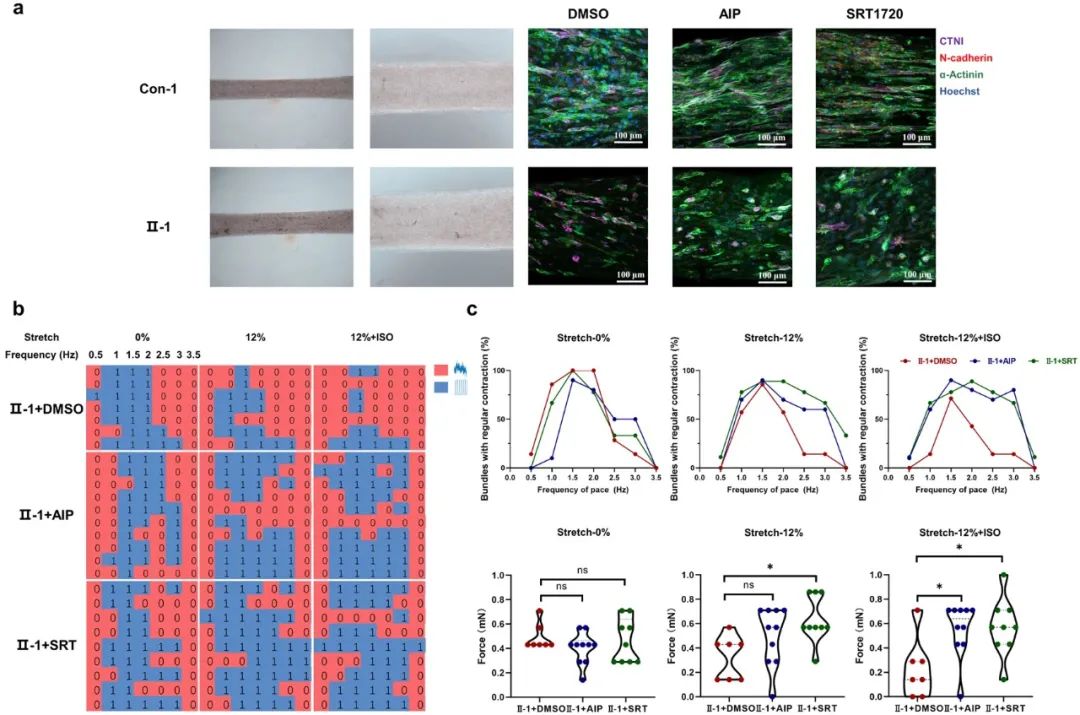
图4. 工程化心肌组织模型验证病理表型和药物作用
综上,LMNA基因突变(A388fs)引起lamin A/C单倍体剂量不足,导致突变型心肌细胞中出现Ca2+处理紊乱、心律失常负担增加、核膜形态异常等病理表型。突变型心肌细胞中lamin A/C表达的减低引起lamin A的相互作用蛋白SIRT1的降解加速,导致线粒体功能障碍和氧化应激。一方面,ROS水平的升高激活了CaMKⅡ-RYR2信号通路,促进了RYR2介导的肌浆网Ca2+泄漏,进一步引起了细胞内舒张期Ca2+浓度升高以及Ca2+处理紊乱,最终导致心律失常发生;另一方面,上调的ROS加速了核膜蛋白SUN1的积累,导致了突变型心肌细胞中核膜形态异常。通过SIRT1激活剂或ROS清除剂的干预可以挽救突变型心肌细胞的病理表型。该研究揭示了lamin A/C单倍体剂量不足介导的ROS上调在扩张型心肌病中的调控作用,重塑受损的SIRT1功能以及抑制过度的氧化应激可作为未来治疗LMNA-DCM的潜在策略。
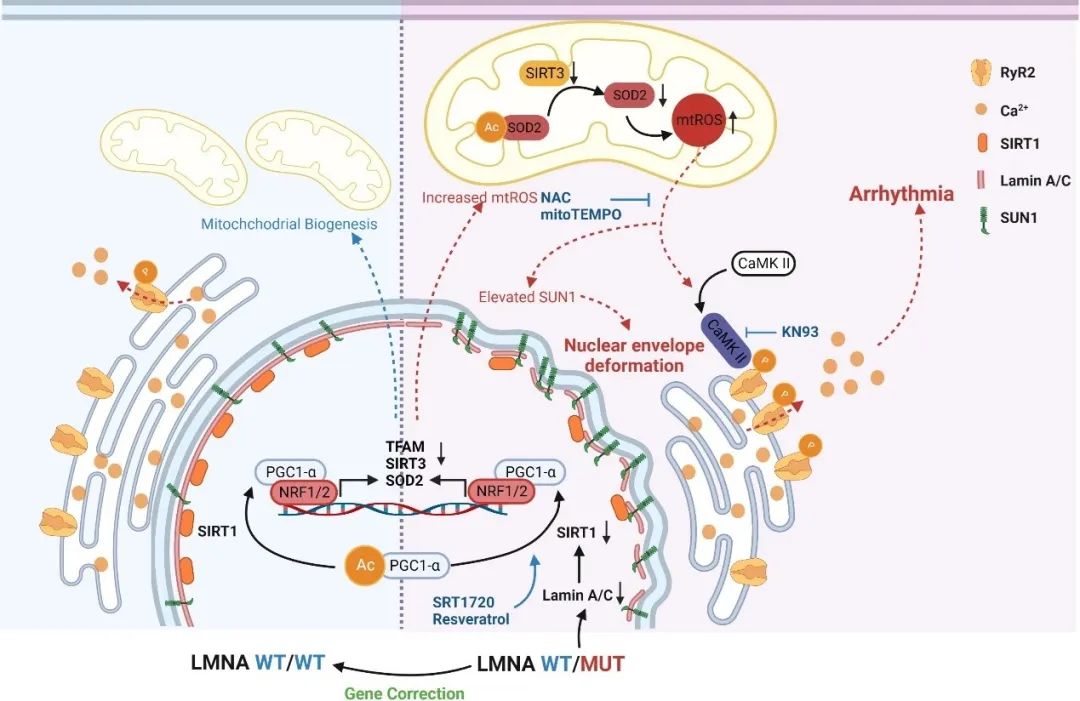
图5. 工作模式图
浙江大学医学院附属邵逸夫医院裘航远博士(现为浙江省人民医院心内科住院医师)为论文的第一作者,浙江大学转化医学研究院/浙江大学医学院附属第一医院梁平教授、浙江大学医学院附属邵逸夫医院蒋晨阳教授为论文的通讯作者。同时,这项研究得到了湖北大学生命科学学院张冬卉教授、浙江大学医学院附属邵逸夫医院傅国胜教授、浙江大学医学院附属邵逸夫医院孙雅逊主任医师、杭州市妇产科医院王昊副主任医师(现为浙江大学医学院附属邵逸夫医院副主任医师)、湖北大学生命科学学院博士研究生孟祥福、浙江大学医学院附属第一医院夏佳锋博士(现为浙江省人民医院消化内科住院医师)的大力支持。
原文链接:
https://www.nature.com/articles/s41467-024-51318-5
猜你喜欢
- JACC:直接口服抗凝剂 vs 维生素K拮抗剂在抗磷脂综合征患者中的疗效和安全性
- 冠脉支架集采接续采购首年需求量超180万个
- 法式煎蛋的做法-甜味炒菜谱
- 国家卫健委:11月6日新增确诊病例33例均为海外键入病例
- 真牛,这个减肥方法好强悍!网友7天减10斤,瘦的真快!
- European Radiology:深度学习模型对脂肪和淋巴水肿患者的标准化评估
- 山寒水冷?温补养精?冬季时节学会“收藏”
- 游泳减肥的误区游泳的好处有哪些
- Circulation 上海交通大学张冰教授团队开发出具备单碱基区分能力的高精准Cas13d编辑器实现肥厚型心肌病的有效治疗
- 医学界振奋!山东中医药大学首次揭示:钩藤碱借助 SIRT3 力量,逆转高血压内皮祖细胞线粒体损伤
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)