首页 > 医疗资讯/ 正文
脑胶质母细胞瘤(GBM)是成人中最常见且最具侵袭性的原发性脑肿瘤,预后极差,治疗极具挑战性。尽管光动力疗法(PDT)与免疫疗法等新兴策略展现了一定潜力,但由于GBM存在独特的缺氧、免疫抑制微环境以及血脑屏障等物理障碍,这些疗法的实际疗效受到严重制约,患者的生存获益有限。因此,寻找能够重塑肿瘤微环境、协同增效现有疗法的新型药物靶点与递送策略,对于改善GBM患者的预后具有至关重要的意义。

2025年8月18日,山东大学齐鲁医院李刚/薛皓团队与山东大学刘宏/济南大学周伟家团队在Nature子刊 Nature Communications 杂志在线发表了题为“Bioengineered hybrid dual-targeting nanoparticles reprogram the tumour microenvironment for deep glioblastoma photodynamic therapy”的研究工作。该研究报道了一种生物工程化的多功能“智能纳米平台”,通过精准靶向并系统性地重塑肿瘤微环境,成功破解了脑胶质母细胞瘤治疗中的多重障碍,显著增强了光动力-免疫联合治疗的效果,为攻克这一致命顽疾提供了极具前景的新策略和理论依据。
【文章要点】
基于胶质母细胞瘤微环境中高丰度的肿瘤相关巨噬细胞(TAMs),通过将浸润单核细胞直接极化或将促瘤的M2样TAMs重编程为抗瘤的M1样表型,并增强其抗原交叉呈递能力激活肿瘤部位CD8⁺ T细胞,是一种直接且有效的免疫治疗策略。为了阐明TAMs在GBM进展和免疫调控中的功能作用和贡献,我们分析了GBM的单细胞RNA(scRNA)数据,发现M2样TAMs是数量最丰富的TAM亚群,它们能有效促进上皮间质转化(EMT)和肿瘤血管生成,并通过表达或分泌蛋白酶和免疫抑制因子来抑制抗肿瘤免疫。我们还发现M1样TAMs具有抗原呈递细胞(APC)的潜力,这表明M1样TAMs可能充当先天性免疫和适应性免疫之间的桥梁。随后,我们结合scRNA-seq和空间转录组学数据来识别GBM中的特定空间结构。我们发现SPP1主要由M2样TAMs表达,并且从小鼠scRNA-seq数据中也获得了相同的结果。进一步的scRNA-seq和空间分布图谱显示,M2样TAM亚群在缺氧和血管生成的肿瘤区域高度富集,并且SPP1及其配体(Cd44和Itgb1)以及VEGFA在M2样骨髓源性巨噬细胞(BMDMs)和缺氧区域中同样高度表达。我们进一步对荷有CT2A肿瘤的小鼠进行了免疫荧光分析,发现髓系标记物f4/80高表达的区域也显示出OPN的高表达,且边界清晰。此外,其配体(Cd44和Itgb1)的表达高于癌旁组织(图1)。基于这些发现,我们假设靶向OPN及其相关通路可以提高联合PDT和免疫疗法的疗效。
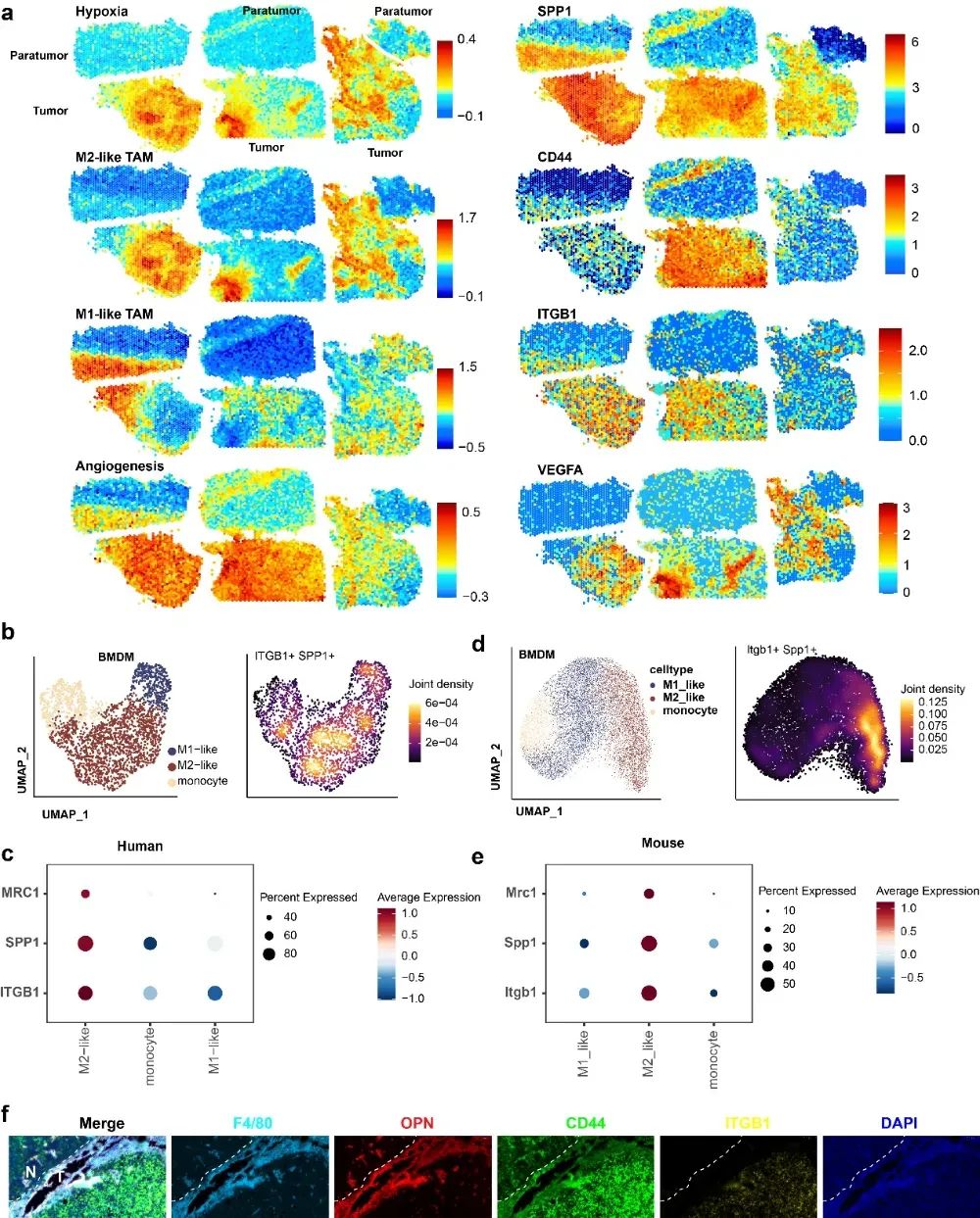
图1 SPP1+ TAM细胞亚群在缺氧和血管生成活跃的肿瘤区域高度富集
接下来,研究采用溶剂热法制备Fe₃O₄纳米颗粒(NPs),继而通过原位生长法引入Bi³⁺和聚乙烯吡咯烷酮(PVP)合成FBFO NPs。该设计通过Bi/Fe₃O₄掺杂拓宽光吸收范围并提升载流子分离效率,在660 nm激光照射下驱动光生空穴-电子对反应:与H₂O/O₂作用产生·OH和·O₂⁻(Ⅰ型PDT),同时利用Fe²⁺/Fe³⁺循环模拟过氧化物酶(POD)催化H₂O₂转化为·OH,并通过空穴氧化H₂O₂释放O₂(模拟过氧化氢酶,CAT)以缓解肿瘤缺氧微环境(TME)。为增强靶向性与生物相容性,将FBFO NPs与杂交膜(HM)复合:利用叠氮胆碱修饰Raw264.7细胞膜获得N₃标记的M1巨噬细胞外泌体(M1EVs),结合低内毒基因工程化大肠杆菌W3110来源的细菌膜囊泡(OMVs),经超声-冻融循环制备M1EV-OMV HM;通过脂质体挤出器使HM包覆FBFO形成核壳结构FBFO@HM NPs。进一步采用酸敏感连接策略偶联aOPN抗体:以苯甲醛-PEG₂₀₀₀-NHS修饰aOPN氨基端形成aOPN-PEG₂₀₀₀-BD,再与DBCO-PEG₅-NH₂缩合构建pH响应性苯甲亚胺键(在pH 6.5酸性TME中断裂),最终通过点击化学获得FBFO@HM@aOPN NPs。此系统通过HM包覆层整合M1EVs(TSG101、趋化因子受体CXCR4等)与OMVs(FtsZ)的膜组分特性,协同光催化-双酶活性实现ROS/O₂可控生成及肿瘤靶向递送(图2)。
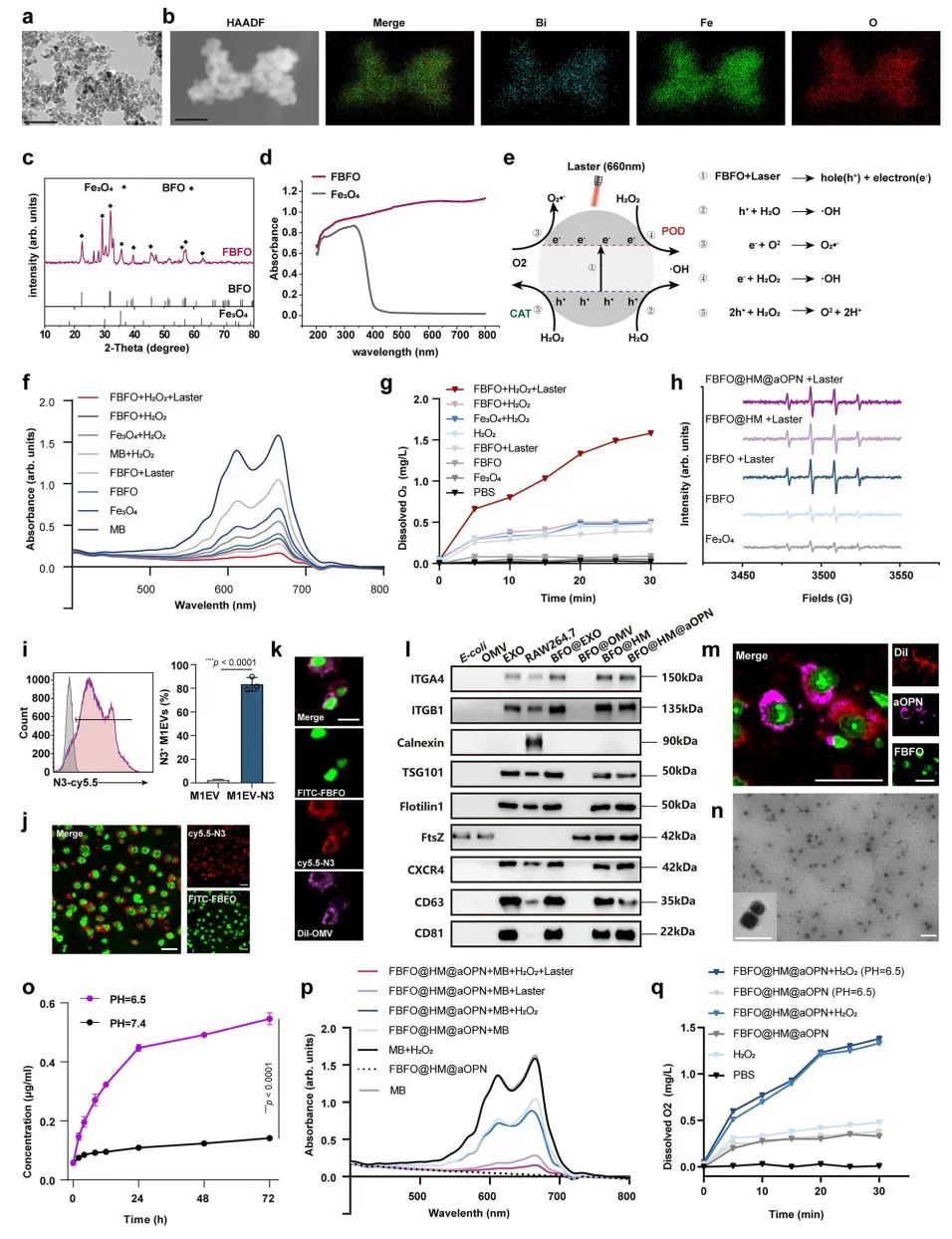
图2FBFO@HM@aOPN 纳米颗粒的制备与表征
总的来说,这项工作展示了一种多模式仿生纳米平台(FBFO@HM@aOPN),旨在增强GBM中的PDT-免疫疗法协同作用。该纳米平台将一个具有双酶样活性的纳米酶(Fe₃O₄@BiFeO₃, FBFO)封装在一个由OMVs和M1EVs融合形成的杂交膜(HM)内,然后与一种pH敏感的抗OPN(aOPN)抗体偶联,得到FBFO@HM@aOPN。经静脉给药后,FBFO@HM@aOPN在GBM组织中积聚,其中酸性的TME触发aOPN的释放,增加血管通透性并促进ECM重塑。同时,FBFO纳米酶产生氧气以缓解缺氧,提高PDT的疗效。HM进一步将纳米平台引导至肿瘤细胞和TAMs,以诱导铁死亡(新抗原释放)并将TAMs重编程为M1样表型。这种双重作用激活了先天性和适应性免疫,与检查点抑制剂协同作用,并抑制了肿瘤的进展和复发(图3)。该平台提供了一种微创策略,以克服GBM治疗中由TME驱动的耐药性。
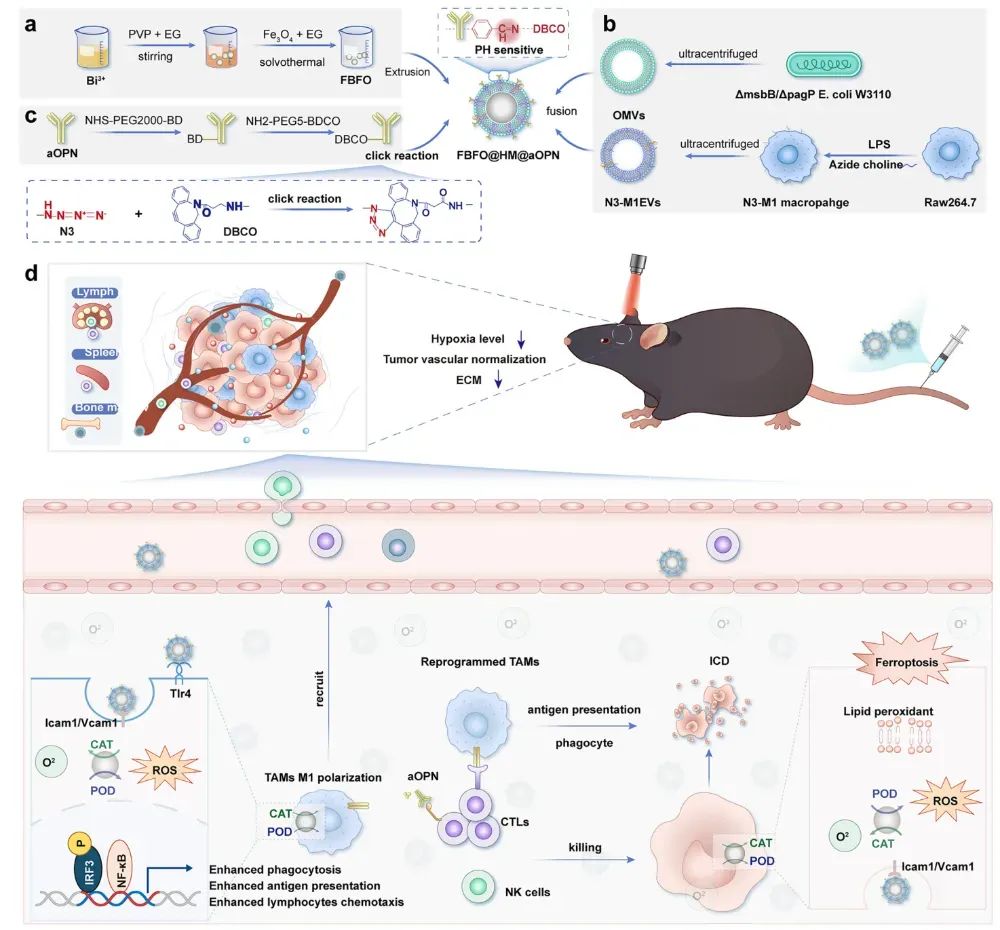
图3FBFO@HM@aOPN的合成过程及其针对GBM的免疫重塑光动力疗法体内治疗机制
【结论与展望】
总之,我们为GBM生成了一种创新且有前景的纳米治疗平台,通过从不同角度解决TME固有的复杂性,来提高PDT和免疫疗法联合治疗的疗效。体内治疗结果显示,该系统对缺氧的TME具有协同的抗肿瘤作用,使脉管系统正常化并介导细胞外基质的组成,从而增强了抗肿瘤的先天性和适应性免疫。此外,我们利用真核-原核膜融合创造了一个生物相容性的纳米递送平台,为增强的光动力疗法和免疫疗法组合建立了一种仿生纳米策略。
原文链接:
https://www.nature.com/articles/s41467-025-63081-2
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)