首页 > 医疗资讯/ 正文
原发性皮肤 B 细胞淋巴瘤(CBCL)是一组在诊断时局限于皮肤的非霍奇金淋巴瘤,且在临床表现和生物学特征上存在显著差异,约占所有原发性皮肤淋巴瘤的 25%。根据世界卫生组织-欧洲癌症研究与治疗组织(WHO-EORTC)分类和国际共识分类(ICC),可细分为不同的亚型,包括原发性皮肤滤泡中心淋巴瘤(PCFCL)、原发性皮肤边缘区淋巴瘤(PCMZL)、原发性皮肤弥漫性大 B 细胞淋巴瘤-腿型(PCDLBCL-LT)、血管内大 B 细胞淋巴瘤(IVLBCL)以及Epstein–Barr病毒阳性黏膜皮肤溃疡(EBVMCU),这些亚型在临床表现、组织病理学特征、分子改变和预后方面存在显著差异。惰性型如 PCFCL 和 PCMZL 通常采用局部治疗手段,预后良好。相比之下,侵袭性变体如 PCDLBCL-LT 需要全身治疗,并且预后较差。EBVMCU 虽然其组织学表现令人担忧,但总体上呈现出良性且自限性的特征。
《European Journal of Haematology》近日发表综述,提供了关于每种 CBCL 亚型的当前诊断标准、临床管理策略以及新兴分子见解的最新概述。同时强调了多学科方法的重要性,并讨论了预后判断的挑战,以及创新疗法不断演变(但仍有限)的作用。

引言
原发性皮肤淋巴瘤是一组多样且复杂的结外非霍奇金淋巴瘤,影响皮肤,诊断时无皮肤外疾病的证据。根据肿瘤细胞的谱系进行广泛分类,大多数来源于 T 细胞,约 25% 的病例来源于 B 细胞,统称为原发性皮肤 B 细胞淋巴瘤 (CBCL)(表 1)。
CBCL 的发病率持续上升,目前估计约为每百万人四例。流行病学数据表明,最高发病率发生在男性、西方人群和 50 岁以上的成年人中。CBCL 的分类和理解已显著发展,特别是得益于 2018 年世界卫生组织 (WHO) 和欧洲癌症研究与治疗组织 (EORTC) 的联合分类以及最近的国家共识分类 (ICC)。这些框架建立了诊断和命名的标准化方法,在 CBCL 中确立了四个主要亚型:原发性皮肤滤泡中心淋巴瘤 (PCFCL)——通常表现为头皮、前额或躯干上的缓慢进展性病变,通常与极佳预后相关;原发性皮肤边缘区 B 细胞淋巴瘤 (PCMZL)——一种惰性淋巴瘤,常表现为粉红色至红色的丘疹、斑块或结节,主要位于手臂和躯干;原发性皮肤弥漫性大 B 细胞淋巴瘤-腿型 (PCDLBCL, LT)——一种更具侵袭性的亚型,通常影响下肢,与其他 CBCL 相比预后较差。血管内大 B 细胞淋巴瘤 (IVLBCL) 是一种罕见且侵袭性的大 B 细胞淋巴瘤亚型,其特征是独特的血管内生长模式,通常无显著淋巴结病,偶尔局限于皮肤。Epstein–Barr 病毒阳性皮肤黏膜溃疡 (EBVMCU)——一种新认识的淋巴增殖性疾病,特征为自限性、溃疡性皮肤或黏膜病变,常发生于免疫抑制或老年个体。
诊断和管理 PCBCL 需要多学科方法,涉及皮肤科医生、病理科医生、血液科医生和放疗科医生之间的密切合作。PCMZL 和 PCFCL 通常为惰性,常单独采用局部放疗 (RT) 治疗,效果极佳。相比之下,更具侵袭性的 DLBCL-LT 通常采用全身化疗联合受累野放疗,生存预后较差。
原发性皮肤滤泡中心淋巴瘤 (PCFCL)
PCFCL 是白种人中最常见的 PCBCL 类型,占所有 PCBCL 的 30%–50%。但在日本和韩国等亚洲国家是最不常见的 PCBCL 亚型。在 WHO-ECRTC 原发性皮肤淋巴瘤分类以及新的 WHO 造血和淋巴组织肿瘤分类中,它被视为一个独立的亚型。
发病中位年龄在 50 至 60 岁之间,男性更多。
临床特征
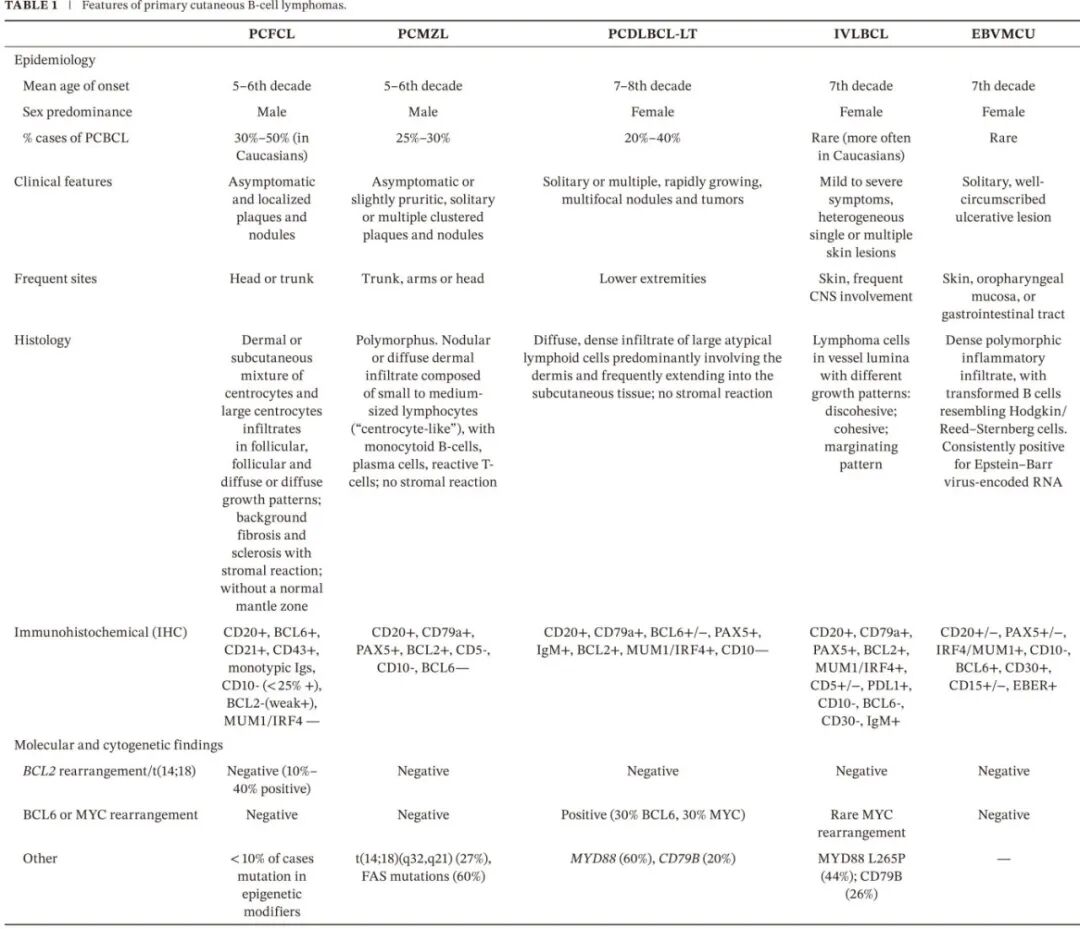
PCFCL 通常表现为孤立的红色至紫罗兰色斑块、结节或肿瘤,表面光滑、有光泽、呈乳头状,可为单发或成簇。这些病变最常见于头部(图 1A,B)、颈部或躯干,很少累及腿部。肿瘤周围的红色丘疹和轻度硬结斑块是特征性表现。多灶性皮肤受累不常见(占病例的 10%–15%),且无预后意义。如果不治疗,病变通常显示缓慢、进行性增大(大多数病变直径不超过约 3 厘米),而播散到皮肤外部位的情况罕见。大多数患者无症状或仅表现为局部瘙痒。溃疡罕见。也有文献中描述了不典型表现,可能类似面部皮肤病,如肿胀性狼疮、肉芽肿性玫瑰痤疮、面部播散性粟粒性狼疮、B细胞假性淋巴瘤、IgG4相关疾病,但也可能类似实体器官转移瘤。头皮受累可能导致脱发。有一种临床变异型,历史上称为“Crosti 淋巴瘤”或“背部网状组织细胞瘤”,其特征为躯干上出现图案状、环状、同心圆状斑块,伴外周斑疹或丘疹。皮肤外受累不常见。这些表现可能带来诊断挑战,因为它们可能难以与炎症性病变、对节肢动物叮咬的过度反应(图 1D)、肿胀性狼疮、其他皮肤肿瘤或非 B 细胞皮肤淋巴瘤区分开来。
组织病理学与生物学特征
组织学检查显示真皮深层和/或皮下组织存在底部为主的淋巴样浸润,呈现显著的滤泡模式。滤泡显示中心细胞和中心母细胞的可变成分,通常缺乏明确的套区。结构模式沿着一个连续谱变化,包括滤泡性、结节性、弥漫性生长模式或它们的组合。滤泡周围是小淋巴细胞和组织细胞,混杂着炎症细胞,如嗜酸性粒细胞和浆细胞。肿瘤性滤泡由 B 细胞 (CD20+, CD79a+) 组成,这些细胞表达滤泡中心相关标志物如 BCL-6,并嵌入由 CD21 或 CD35 标记的滤泡树突状细胞网络中。这些细胞通常显示单型性表面免疫球蛋白表达,可变的 CD43 阳性,以及减少或缺失的 CD10 表达。CD10 在具有滤泡生长模式的 PCFCL 中更常表达。大多数病例 MUM1/IRF4 和 FOXP1 阴性,以此可与 PCDLBCL-LT 等其他亚型区分。然而,由于 Bcl-2、MUM-1 以及在较小程度上 FOXP1 也在一小部分 PCFCL 中表达,这些标志物不能用作区分这两种情况的金标准。与结节性滤泡性淋巴瘤不同,PCFCL 通常缺乏 BCL-2 表达,并且很少携带涉及 BCL2 基因的 t(14;18)(q32;q21) 易位。表观遗传修饰因子 CREBBP、KMT2D、EZH2 和 EP300 的复发性突变在继发性皮肤滤泡性淋巴瘤中常见,但在 PCFCL 中很少发现。相反,TNFRSF14 突变在 PCFCL 中常见检测到。
诊断与分期
诊断基于组织病理学特征,结合临床相关性、免疫组织化学分析、免疫球蛋白重链克隆性分析以及排除鉴别诊断。明确诊断需要具有足够长度和直径的代表性活检。切除活检更可取;然而在穿刺活检的情况下,直径应尽可能至少为 4 毫米。表现出弥漫性生长模式的 PCFCL 与 PCDLBCL-LT 的组织学鉴别可能是一个重大的诊断挑战,对于含有大量中心母细胞的 PCFCL 变异型尤其如此,它们可以非常近似地模仿 PCDLBCL-LT 的高级别形态。准确的区分依赖于结构学和免疫表型发现的结合。PCDLBCL-LT 通常由融合成片的中心母细胞和免疫母细胞组成,并表现出特征性的表型:强而均匀的 BCL2 表达,IgM 和 MUMI/IRF4 阳性,以及非生发中心、活化 B 细胞谱系。相比之下,PCFCL 通常表现出模糊的结节状结构,部分保留 CD21+/CD23+ 滤泡树突状细胞网络,以及显著的反应性 T 细胞浸润。免疫组化上,通常显示弱或缺失的 BCL2 表达,IgM 和 MUMI 阴性,以及生发中心 B 细胞表型。
分期对于排除皮肤外疾病的存在至关重要,应包括病史和患者检查、适当的实验室检查(包括全面的血清化学、血清乳酸脱氢酶和血清蛋白电泳)以及适当的胸部、腹部和骨盆影像学检查(CT 扫描和/或 FDG-PET)。对于初诊时 BCL-2、CD10 阳性或存在 t(14,18) 易位的病例,可考虑骨髓活检。PCFCL 通常为 t(14;18) 易位阴性,但当其存在时可能具有预后意义,这种遗传改变虽然不常见,但与皮肤复发风险增加和皮肤外播散可能性更高相关。此外,检测到 t(14;18) 也可能增加对系统性滤泡性淋巴瘤皮肤表现的怀疑,强调需要仔细分期。
ISCL/EORTC 推荐的分期系统仅用于疾病范围的解剖学记录,遵循 TNM 分类(表 2),其他 B 细胞皮肤淋巴瘤也是如此。然而,皮肤 B 细胞淋巴瘤的分期预后价值有限,因为组织病理学在风险分层中起主要作用。

治疗
PCFCL 是一种惰性淋巴瘤,疾病相关 5 年生存率为 95%。在临床适当时,应始终优先考虑保守治疗方法。表现为单一/局限性病变的患者可从以治愈为目的治疗每个病变中获益。一线治疗包括受累部位放疗 (ISRT)、低剂量放疗或手术切除,完全缓解率接近 100%对于惰性 PCFCL,最佳治愈性放疗剂量尚无共识。推荐剂量范围从 24 到 40–45 Gy,临床未受累皮肤的边界至少 1–1.5 厘米;NCCN 和 ILROG 建议剂量在 24 到 30 Gy 之间。低剂量 RT(2–4 Gy,分 2 次)可实现 72% 的完全缓解率,其中 30% 的病变需要再次治疗。手术似乎是一种同样有效的治疗选择,但通常保留用于部分病例,即小病变可以通过最小且无毁容的手术切除。关于切除边缘未提供详细信息。使用高效类固醇、咪喹莫特、氮芥和贝沙罗汀的局部疗法可能有效治疗有症状的病变。对于少数散在病变的患者,可以采取对所有可见皮肤病变进行 ISRT 治疗,也可以采取等待观察策略,仅治疗有症状的皮肤病变。罕见情况下,PCFCL 患者可能表现出局部侵袭性病程,有人提出可能转化为 DLBCL,建议“等待观察”的患者需要密切的临床随访。病灶内注射利妥昔单抗非常有效,完全缓解率为 60%–80%,但由于需要多次注射、相关疼痛和轻度不良事件而不适用。在系统性疾病的情况下,一线治疗通常包括系统性利妥昔单抗(375 mg/m²,每周一次,持续 4-8 周),然后在适当时,结合如受累部位放疗 (ISRT) 或手术切除等联合模式以增强局部疾病控制。对于表现为弥漫性皮肤外受累、广泛皮肤播散或影响下肢病变的 PCFCL 病例,可考虑使用利妥昔单抗进行全身治疗。在多药联合化疗(如 R-CHOP:利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松)的基础上,联合受累部位放疗 (ISRT),可用于选定的高危病例。然而由于多药化疗的毒性,应仅用于非常谨慎选择的患者。一项系统评价报告,多药化疗的完全缓解 (CR) 率为 85%,但约 44% 的病例出现复发。
随访建议应根据临床情况个体化。通常,指南建议每 6 个月随访一次,进行完整的皮肤和淋巴结检查。额外的检查,如组织学、血液检查和影像学,应仅在临床指征时进行。复发发生在 20%–50% 的病例中,但通常局限于皮肤,不影响总体预后。虽然大多数复发发生在前四年内,但即使在 10 年后也观察到持续的复发风险(范围在 2% 到 6%)。
原发性皮肤边缘区淋巴瘤 (PCMZL)
PCMZL 是一种惰性 B 细胞淋巴瘤,占所有原发性皮肤淋巴瘤的 7%–9% 和 CBCL 的 25%–30%。2022 年 WHO 分类和 2022 年 ICC 承认 PCMZL 为一个独立亚型,与其他黏膜相关淋巴组织 (MALT) 淋巴瘤分开,基于其独特的临床表现和生物学行为。虽然 WHO 将 PCMZL 分类为惰性淋巴瘤,但 ICC 2022 强调了其显著的惰性病程,并将其重新分类为原发性皮肤边缘区淋巴增殖性疾病 (PCMZL-LPD),突出了其低度性质和良好预后。
临床特征
PCMZL-LPD 主要影响成年男性患者,中位年龄在 50 至 60 岁之间。虽然在儿童期罕见,但它是儿童和青少年中最常见的皮肤 B 细胞淋巴瘤。据报道,PCMZL-LPD 患者的 5 年疾病特异性生存率为 99%–100%,5 年总生存率为 93%。仅 4% 的患者出现皮肤外疾病。在某些欧洲病例中,伯氏疏螺旋体感染与皮肤 MZL 相关。然而,在美国、亚洲和欧洲部分地区并未观察到这种关联,从而挑战了其提出的病因学作用。此外,PCMZL-LPD 与全身性疾病显著相关,包括胃肠道疾病、自身免疫性疾病和其他恶性肿瘤。
临床上,通常表现为无症状或轻度瘙痒的孤立或成簇丘疹、斑块或结节,大多位于躯干(图 1C)或上肢。头颈部受累约占病例的三分之一,而腿部受累相对不常见。全身症状通常不存在。在某些情况下,可以观察到病变的自发消退。溃疡不常见。可见皮肤松弛症,伴真皮弹性组织缺失。PCMZL-LPD 可发生在受慢性萎缩性肢端皮炎影响的皮肤上,这是伯氏疏螺旋体感染的结果。PCMZL 的诊断可能具有挑战性,因为它通常与反应性皮肤淋巴组织增生共享组织病理学特征;证明轻链限制性或克隆性 IGH 重排,结合临床病理相关性,可能有助于诊断。
组织病理学与生物学特征
PCMZL-LPD 通常表现为结节状或弥漫性真皮浸润,由小至中等大小的淋巴细胞组成,偶尔延伸至皮下组织和皮下脂肪,而表皮通常不受影响。浸润包括小淋巴细胞、边缘区 B 细胞(中心细胞样细胞)、淋巴浆细胞样细胞和浆细胞,混杂着少量中心母细胞或免疫母细胞样细胞以及许多反应性 T 细胞。在许多病例中存在 T 细胞为主,伴有细胞学非典型性、不规则核轮廓和淡染胞质。常见反应性生发中心,可能被一群小或中等大小细胞围绕,这些细胞核不规则,核仁不明显,胞质丰富淡染(边缘区 B 细胞)。单型性浆细胞常见于淋巴样结节周边和紧邻表皮下的浅层真皮。小淋巴细胞和大母细胞也常见。约 25% 的病例存在嗜酸性粒细胞。
PCMZL-LPD 中的肿瘤性 B 细胞表达 CD20、CD79a、PAX-5 等标志物,BCL-2 阳性,而 CD5、CD10 和 BCL-6 阴性。FAS 突变在 PCMZL-LPD 中常见,有助于将这些疾病与其他结外边缘区或 MALT 淋巴瘤区分开来。据报道,高达 27% 的 PCMZL-LPD 存在 IGH/MALT1 t(11;18)(q21;q21)。IGH/BCL2 t(14;18)(q32;q21)、FOXP1/IGH等其他易位可见于 MALT 淋巴瘤,但在 PCMZL 中罕见报道。据报道,PCMZL-LPD 患者中丙型肝炎病毒 (HCV) 感染患病率很高,有时与一种特殊的皮下脂肪瘤样形态相关。根据免疫球蛋白重链 IgH 基因重排,已鉴定出 PCMZL-LPD 的两种免疫遗传学 distinct 亚型。大多数病例表现出类别转换的免疫球蛋白,主要为 IgG+,并以突出的反应性 T 辅助细胞浸润和丰富的浆细胞为特征,这些特征让人联想到反应性淋巴组织增生。肿瘤细胞通常是少数,并且通常不表达 IRTA1 和 CXCR3。类别转换亚型代表 PCMZL-LPD 最惰性的形式,偶尔在皮肤淋巴组织增生之后发生,并且与较低的全身播散风险相关。第二种亚型是非类别转换的(通常为 IgM+),具有更多 MALT 淋巴瘤样特征。肿瘤性 B 细胞占主导地位,并且通常表达 IRTA1 和 CXCR3。在一些非类别转换的 IgM 病例中报道了 MYD88 突变。这第二种亚型更常与皮肤外受累相关,病程相对更具侵袭性,尽管预后仍然良好。尽管仍有争议,但一些专家提出类别转换型可归类为“淋巴增殖性疾病”(LPD),而非类别转换亚型可能代表一种真正的但完全惰性的淋巴瘤。
诊断与分期
PCMZL-LPD 的诊断需要对受累皮肤进行切除活检并排除非皮肤疾病。然而,在 PCMZL-LPD 中,常规骨髓活检在分期中的效用存在争议,通常不推荐,除非患者出现意外的血细胞减少或淋巴细胞增多。研究表明,此类程序在 2%-23% 的病例中呈阳性,并且骨髓受累几乎仅是唯一的结外受累部位。当前建议继续支持全面的分期检查,包括详尽的病史和体格检查、全血细胞计数、全面的血清化学 panel 以及影像学检查,如胸部/腹部/骨盆 CT。在此背景下使用 PET-CT 存在争议,没有正式推荐,因为皮肤 MZL 的 FDG 亲和性据报道较低或中等。推荐使用 TNM 分期。在流行地区,应推荐进行伯氏疏螺旋体检测(血清学和通过 PCR 对皮损皮肤进行 DNA 检测)。
治疗
PCMZL-LPD 病程惰性,预后极佳,疾病特异性生存 (DSS) 为 99%。皮肤复发常见(约 50%),而皮肤外进展罕见。出于所有这些原因,治疗策略优先考虑微创和低发病率的方法,根据病变数量、位置和症状进行个性化决策。对于有孤立或局限性病变患者的初始治疗是局部放疗,剂量从 20 到 45 Gy 不等。EORTC/ISCL 推荐用于原发性皮肤边缘区淋巴瘤的剂量范围为 20 到 36 Gy。对于多灶性疾病的对症治疗,低剂量 RT (2×2Gy) 通常有效且无毒性。对于不适合放疗的孤立病变,可采用手术切除。对于多灶性疾病的患者可以观察。一旦出现症状,可以对病变进行放疗或手术切除。全身治疗,如利妥昔单抗,可能适用于有症状、难治性或泛发性疾病的患者。对于伯氏疏螺旋体相关的 PCMZL-LPD 患者,可考虑抗生素治疗(通常包括头孢菌素 +/- 四环素类)。然而,关于抗生素治疗后皮肤 MZL 消退的数据存在矛盾,且基于病例报告。此外,对于与丙型肝炎病毒感染相关的 PCMZL-LPD 患者,抗病毒治疗在某些情况下可能提供临床获益。
原发性皮肤弥漫性大 B 细胞淋巴瘤,腿型 (PCDLBCL-LT)
弥漫性大 B 细胞淋巴瘤 (DLBCL) 是最常诊断的非霍奇金淋巴瘤亚型,包含一组广泛且异质性的恶性肿瘤,在临床表现、组织病理学特征、遗传改变和治疗反应方面存在显著差异。在已识别的 DLBCL 亚型中,腿型变异型 (PCDLBCL-LT) 代表着一个独特的临床和病理亚型。WHO-EORTC 和 ICC 分类中将 PCDLBCL-LT 视为一个独立亚型,突显了其临床意义以及量身定制诊断和治疗方法的必要性。了解这种淋巴瘤亚型的生物学行为对于优化患者结局至关重要,因为与惰性皮肤 B 细胞淋巴瘤相比,它通常需要更强化治疗。
有报告强调了存在不能明确归入当前 PCFCL 和 PCDLBCL-LT 二分法的原发性皮肤大 B 细胞淋巴瘤,这些病例有时称为 PBCL NOS/不可分类,显示出介于 PCFCL 惰性病程和 PCDLBCL-LT 侵袭性行为之间的形态学和临床特征。临床上,它们的预后也似乎是中等的,结局比典型的 PCFCL 差,但比经典的 PCDLBCL-LT 好。虽然未包含在最近的 WHO 分类中,但这些病例突出了皮肤大 B 细胞淋巴瘤的异质性,可能代表具有重叠特征的中间形式。
临床特征
PCDLBCL-LT 主要发生在老年人中,诊断时的中位年龄通常在 70 至 80 岁之间。与大多数其他淋巴瘤不同,这种亚型显示出的女性优势。临床上,患者通常表现为一个或多个快速生长的皮肤肿瘤,局限于下肢,这些病变可能表现为孤立结节或多个、多灶性肿瘤。它们颜色特征为红色至紫罗兰色,触诊时质地坚实至硬结(图 1E,F)。溃疡常见,尤其是随着疾病进展。这些病变的侵袭性,结合其独特的位置和外观,使得临床识别对于及时诊断和启动适当治疗至关重要。在某些情况下,PCDLBCL-LT 的皮肤表现可能非常类似于炎症性或感染性皮肤病,包括脂膜炎、Bazin 硬红斑或皮下脂膜炎样 T 细胞淋巴瘤。这种临床重叠可能导致初始误诊,导致适当的诊断评估和确定性治疗启动的延迟。病变的红斑色调、局部水肿和偶尔的触痛常常模仿感染过程,可能强化误导性的临床印象。因此,对于表现为持续性、不典型或治疗难治性皮肤病变的老年患者(尤其是下肢)应高度警惕皮肤淋巴瘤,以确保及时识别和管理。
组织病理学与生物学特征
PCDLBCL-LT 的特征为弥漫性、致密的大而不典型淋巴样细胞浸润,主要累及真皮,并常延伸至皮下组织。肿瘤细胞通常排列成融合片状,表现出明显的细胞学非典型性,包括圆形至卵圆形泡状核、显著的中心核仁和丰富的两染性至嗜酸性胞质。高核分裂率和升高的增殖指数,如 Ki-67 免疫染色通常超过 70% 所示,表明肿瘤的高级别和侵袭性生物学行为。免疫表型分析显示泛 B 细胞标志物如 CD20、CD79a 和 PAX5 的强表达。肿瘤细胞也持续表达 IgM、BCL2 和 MUM1,而缺乏 CD10 表达。这种免疫表型与非生发中心 B 细胞 (non-GCB) 表型一致,后者与不良预后相关,并反映了活化 B 细胞样分子亚型。PCDLBCL-LT 通常为 EBER 阴性。BCL2 阳性是关键的诊断标志物,有助于区分 PCDLBCL-LT 与其他 PBCL,特别是 PCFCL,后者通常缺乏 BCL2 和 MUM1 表达。这种差异表达反映了潜在的生物学差异,并导致在 PCDLBCL-LT 中观察到的更具侵袭性的临床行为。
PCDLBCL-LT 的免疫表型特征不仅具有诊断区分性,而且反映了其生物学上的侵袭性。除了持续表达 BCL2 外,相当一部分病例显示 c-MYC 过表达,c-MYC 是一种涉及细胞周期进程和肿瘤发生的转录调节因子。双表达 (DE) 状态(定义为 MYC 和 BCL2 共表达)和双/三打击 (DH/TH) 状态(特征为涉及 MYC 和 BCL2 和/或 BCL6 的易位)的不良预后意义在结节性弥漫性大 B 细胞淋巴瘤中已明确。然而,DE 和 DH/TH 状态在原发性皮肤 PCDLBCL 中的预后相关性由于观察结果不一致尚无定论。同样,MYC 重排的预后影响尚未完全明了。
最近的分子研究揭示了 PCDLBCL-LT 的生物学异质性,并确定了驱动其发病机制和侵袭性的复发性遗传改变。在相当大比例的病例中检测到 MYD88 的激活突变和 CD79B 的突变,这些改变在促进 NF-κB 信号通路的组成性激活中起核心作用,从而支持恶性 B 细胞的存活和增殖。除了这些致癌驱动因素外,涉及肿瘤抑制基因的功能丧失事件(最显著的是 CDKN2A 的缺失或失活)进一步促进了细胞周期控制的失调和肿瘤进展。
诊断与分期
在 PCDLBCL-LT 中,放射学评估通常显示位于下肢皮下组织内的结节状、边界不清的病变。在 FDG PET-CT 成像上,这些病变表现出明显的 FDG 摄取,反映了这种侵袭性淋巴瘤亚型特征性的高增殖和代谢活性。应使用 EORTC/ISCL TNM 分类系统进行精确分期。国际预后指数 (IPI) 等风险分层工具可考虑用于 PCDLBCL-LT 的临床评估;然而IPI 尚未针对这种淋巴瘤亚型进行特异性验证。虽然 IPI 为评估系统性 DLBCL 的预后提供了一个通用框架,但其对皮肤变异型的适用性仍然有限,其在 PCDLBCL-LT 中的预后准确性应谨慎解读。
治疗
由于它们常发生在老年人中(许多超过 80 岁),PCDLBCL-LT 常采用单独放疗或姑息性化疗处理。这种保守的治疗方法主要受患者年龄和合并症的影响,与相对较差的结局相关。当 PCDLBCL-LT 局限于腿部时,放疗是一种有价值的治疗方式。对于局部分期的患者,特别是老年人,单独放疗可能是一种合适的治疗选择,推荐剂量超过 40 Gy。在全身治疗基础上加用局部放疗可以增强疾病控制,并与单独全身治疗相比提高总生存期。对于表现为单一病变或局限于单个解剖区域的病变的病例,可以考虑以对症为目的进行手术切除。使用 R-CHOP 治疗 PCDLBCL-LT 患者的完全缓解率超过 90%,3 年总生存率大于 70%。尽管来自回顾性分析,但这些结果(特别是与使用替代、强度较低方案治疗的历史队列相比)强烈表明,使用适应年龄的基于利妥昔单抗的化学免疫疗法可以显著改善这种临床侵袭性且危及生命的淋巴瘤的预后。
许多 PCDLBCL-LT 病例属于 non-GCB/ABC 亚型,该亚型对化疗反应较差,并导致在该亚型中观察到的不良结局。这些发现强调了即使在老年人群中,个体化全身治疗也具有治疗潜力,在这种情况下,必须平衡疾病侵袭性与治疗耐受性。伊布替尼在复发或难治性 PCDLBCL-LT 患者中显示出令人鼓舞的结果,即使低剂量也有记录的持久缓解,当与 R-EPOCH、 维奈克拉或来那度胺等药物联合使用时,反应似乎更强劲和持久。
耐药机制(如 CARD11 突变和 BCL2 扩增)强调了基因组监测的重要性以及个体化联合策略的潜在优势。目前没有可靠的临床数据专门评估其他创新疗法——如抗体-药物偶联物、双特异性抗体或嵌合抗原受体 T 细胞 (CAR-T) 疗法——在治疗 PCDLBCL-LT 中的疗效。这些先进的治疗方式在复发/难治性系统性 DLBCL 中显示出有希望的结果,特别是在高危或治疗耐药病例中。然而,它们在 PCDLBCL-LT 中的使用基本上未经研究,临床经验仅限于个案报告或从系统性疾病情况推断。
血管内大 B 细胞淋巴瘤 (IVLBCL)
血管内大 B 细胞淋巴瘤 (IVLBCL) 是一种非常罕见且侵袭性的 B 细胞淋巴瘤形式,约 40% 的病例表现为皮肤受累。在近 30% 的病例中,皮肤是发病时的唯一部位(原发性皮肤 IVLBCL)。临床表现高度异质性,可能包括疼痛性硬结性红斑疹、边界不清的紫罗兰色斑块、模仿蜂窝织炎的病变、大的孤立性斑块、肿瘤、溃疡性结节等。除了皮肤表现外,这种罕见亚型常与中枢神经系统受累相关。IVLBCL 通常 IgM 阳性,并强表达 BCL2 和 MUM1。鉴于该亚型的特殊表现,证明克隆性免疫球蛋白基因重排可能作为一种有用的诊断工具。靶向测序研究显示,约 44% 的病例存在 MYD88 L265P 突变,而约 26% 的患者发生 CD79B 突变。MYC 重排不常见,通常不与此淋巴瘤亚型相关。基于 R-CHOP 的免疫化疗仍然是标准的一线方案。IVLBCL 是发生在免疫豁免部位淋巴瘤谱系的一部分,因此存在中枢神经系统受累的高倾向;因此,应注意 CNS 分期,包括考虑药物性腰椎穿刺,并且在某些情况下可能推荐使用大剂量甲氨蝶呤。局限于皮肤的 IVLBCL 患者与系统性受累患者相比,显示出更好的总生存趋势。MYD88 和 CD79B 突变在皮肤和系统性疾病形式中均有观察到,并且似乎与临床行为或预后无关。
EBV阳性皮肤黏膜溃疡 (EBVMCU)
EBVMCU 被分类为与免疫缺陷和失调相关的淋巴增殖和淋巴瘤。
临床特征
EBVMCU 定义为在免疫抑制背景下发生的孤立性、边界清楚的溃疡性病变,影响皮肤、口咽黏膜或胃肠道。该实体通常在免疫抑制情况下观察到,例如高龄(免疫衰老)、医源性免疫抑制(例如,移植后或自身免疫性疾病治疗)或原发性免疫缺陷。
组织病理学与生物学特征
EBVMCU 的特征是密集的多形性炎症浸润,其中大的、转化的 B 细胞类似于霍奇金/里-斯细胞,是一个突出的组成部分。这些非典型 B 细胞通过原位杂交持续呈 Epstein-Barr 病毒编码 RNA 阳性,证实了它们的 EBV 驱动起源。大的肿瘤细胞表达 PAX5,并在免疫表型分析中显示 CD20 的可变表达。它们通常表现出非生发中心 B 细胞表型,表达 IRF4/MUM1、CD10(不常见)和 BCL6 等标志物。CD30 表达几乎普遍存在,约 50% 的病例也共表达 CD15,进一步类似经典霍奇金淋巴瘤。尽管有这些侵袭性的形态学和免疫表型特征,EBVMCU 通常遵循惰性临床病程,并且可能自发消退或随着免疫抑制治疗的减少或停止而消退。
EBVMCU 通常表现为局部过程,无系统性播散证据,与侵袭性 EBV 相关淋巴瘤形成对比。这种独特的临床行为强调了准确识别和诊断的重要性,因为错误分类可能导致不必要且潜在有害的过度治疗(强化化疗)。
治疗
管理 EBVMCU 的主要方法是保守治疗,初始治疗侧重于减少或停止可能损害免疫监视的免疫抑制治疗。在许多情况下,仅此干预就足以诱导病变消退,反映出当免疫功能恢复时疾病的自限性。密切的临床监测至关重要,额外的治疗通常保留给难治性或进展性疾病。大多数 EBVMCU 患者在减少或停止免疫抑制治疗后达到完全缓解,随访研究证实溃疡消退且进展为系统性淋巴瘤的可能性低。这种良好的结局突显了当免疫能力恢复时 EBVMCU 的惰性性质。然而在罕见病例中,据报道持续性或不消退的 EBVMCU 可转化为 EBV 阳性 DLBCL,强调了需要仔细的长期监测,特别是在持续免疫抑制或非典型临床病程的患者中。利妥昔单抗已有效用于 EBVMCU 的难治性病例,在几份报告中实现了完全缓解。其使用在对显著减少免疫抑制治疗不可行的患者中特别有价值,例如有潜在自身免疫性疾病或实体器官移植的患者,维持免疫抑制至关重要。此外,局部外照射放疗,以 20 至 45 Gy 的剂量施用,已证明具有高临床反应率和良好的毒性特征。放疗在需要快速控制病变的情况下尤其有利,例如有症状的溃疡或解剖敏感部位的病变。总之,EBVMCU 是一种良性和自限性的淋巴增殖性疾病,体现了病毒肿瘤发生与宿主免疫调节之间复杂的相互作用。识别这种独特的临床和病理实体具有重要的治疗意义,因为准确诊断可以防止使用细胞毒性方案的过度治疗,并支持保守的管理方法。此外,适当的识别使临床医生能够向患者保证与 EBVMCU 相关的通常极佳的预后和低系统性进展风险。
结论
PCBCL 代表了一组生物学和临床上异质性的淋巴增殖性疾病,需要仔细的诊断区分和个体化管理策略(表 3)。尽管在其组织病理学、免疫表型和分子特征的理解方面取得了显著进展,并识别了如 EBVMCU 这样的罕见亚型,但一些诊断和治疗挑战仍未解决。关键的争议包括反应性浸润与肿瘤性浸润的区分、PCFCL 与 PCDLBCL 的界定,以及侵袭性亚型的预后亚分类。此外,目前缺乏关于使用创新疗法如抗体-药物偶联物、双特异性抗体和 CAR-T 细胞疗法治疗 PCBCL 的数据。展望未来,新遗传标志物的识别和新兴治疗药物的临床应用为提高诊断精度和扩大治疗选择带来了希望,最终改善惰性和侵袭性形式 PCBCL 的患者结局。
参考文献
A. Bernardelli, E. Carazzai, B. Bugnotto, F. Bellinato, M. Krampera, and C. Visco, “ Primary Cutaneous B-Cell Lymphomas: An Updated Portrait of Classification, Biology, and Clinical Management,” European Journal of Haematology (2025): 1–13, https://doi.org/10.1111/ejh.70053.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)