首页 > 医疗资讯/ 正文
根据 1 期FORAGER-1试验(NCT05614739)剂量优化部分的数据,维普格拉替尼(Vepugratinib,LY3866288)单药治疗在携带FGFR3基因变异的转移性尿路上皮癌患者中显示出疗效和耐受性。此外,扩展队列的初步数据显示,维普格拉替尼联合维恩妥尤单抗(Padcev)和帕博利珠单抗(Keytruda)在FGFR3基因变异的尿路上皮癌患者的一线治疗中具有安全性和活性。
2025 年欧洲肿瘤内科学会(ESMO)大会上公布的数据显示,维普格拉替尼 200 mg每日两次剂量组(n = 35)的客观缓解率为 34%,300 mg每日两次剂量组(n = 37)为 30%,400 mg每日两次剂量组(n = 30)为 33%。所有缓解均为部分缓解,各剂量组的疾病稳定率分别为 60%、54% 和 43%。200 mg队列的疾病控制率为 94%,300 mg队列为 84%,400 mg队列为 77%。安全性方面,在 3 个单药剂量组中,38% 的患者在数据截止时仍在接受治疗。在所有携带FGFR3基因变异的实体瘤患者中,200 mg每日两次剂量组中(n = 59),97% 的患者发生任何级别治疗期间出现的不良事件(TEAEs),300 mg每日两次剂量组(n = 65)为 100%,400 mg每日两次剂量组(n = 62)为100%。3 级或更高级别TEAEs的发生率分别为 37%、49% 和 45%。TEAEs导致 14%、35% 和 29%的患者分别降低剂量;这些毒性分别导致 3%、3% 和 0% 的患者中断治疗。
主要研究者、加州大学洛杉矶分校大卫·格芬医学院血液肿瘤学和泌尿学副教授Alexandra Drakaki医学博士在数据报告中表示:“中位随访时间为 8 个月,61% 的缓解患者继续参与研究,并且由于维普格拉替尼是一种安全的药物,我们对将其与其他药物联合使用充满信心。”
1.维普格拉替尼与其他FGFR抑制剂有何区别?
FGFR3基因变异存在于约 15%-20% 的转移性尿路上皮癌患者中。维普格拉替尼是一种口服、高效、亚型选择性小分子FGFR3抑制剂,旨在减少与其他泛FGFR抑制剂相关的脱靶毒性。值得注意的是,临床前研究显示,在FGFR3基因变异的尿路上皮癌细胞系中使用FGFR3抑制可诱导NECTIN-4表达,而NECTIN-4是维恩妥尤单抗的靶点。Drakaki指出,随后在这些细胞系中,维普格拉替尼、维恩妥尤单抗和帕博利珠单抗的联合使用显示出显著的抗肿瘤活性。维恩妥尤单抗联合帕博利珠单抗目前已获美国FDA批准用于治疗局部晚期或转移性尿路上皮癌患者。

▲FDA批准维恩妥尤单抗联合帕博利珠单抗用于局部晚期或转移性尿路上皮癌
2.FORAGER-1试验是如何设计的?
在该研究的 1 期剂量递增部分,研究者根据当地实验室检测结果纳入了 223 例携带FGFR3变异的晚期实体瘤患者。患者需具备 0-2 分的ECOG体能状态,且允许既往接受过FGFR抑制剂治疗。在初始A1队列中,维普格拉替尼在 10 个剂量水平进行了评估,范围从 6 mg每日一次至 400 mg每日两次不等。A2队列作为随机化剂量优化组,尿路上皮癌患者在此队列中接受该药物单药治疗,剂量分别为 200 mg、300 mg或 400 mg每日两次。在剂量扩展阶段,B队列纳入转移性尿路上皮癌患者,这些患者被分配至 5 个亚组中,包括B5亚组——该亚组评估维普格拉替尼 200 mg每日两次联合维恩妥尤单抗和帕博利珠单抗作为一线治疗。该研究两部分的主要终点包括安全性/耐受性、确定维普格拉替尼的最佳剂量、药代动力学以及根据RECIST v1.1标准的初步疗效。本分析的数据截止日期为 2025 年 8 月 29 日。
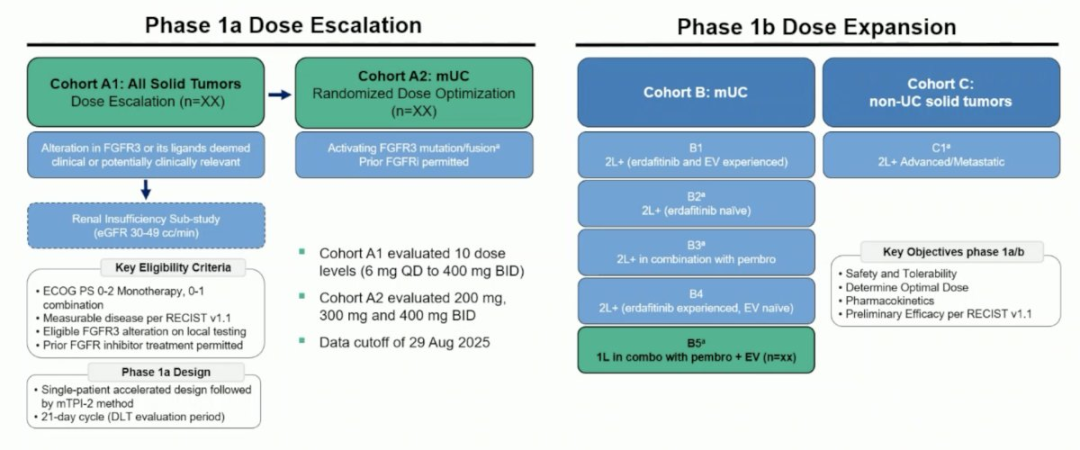
▲研究设计
接受维普格拉替尼单药治疗(剂量分别为 200 mg每日两次[n = 46]、300 mg每日两次[n = 52]和 400 mg每日两次[n = 40])的转移性尿路上皮癌患者,中位年龄分别为 67 岁(范围:35-88 岁)、72 岁(范围:42-93 岁)和 70 岁(范围:26-89 岁)。3 个组中大多数患者为男性(67%;60%;73%)、白人(46%;58%;70%),ECOG体能状态为 1 分(70%;73%;63%),原发肿瘤位于下尿路(54%;58%;65%),携带FGFR3突变而非融合(70%;88%;78%),且肌酐清除率至少为 60 mL/min。
3.关于维普格拉替尼单药治疗,还报告了哪些其他安全性数据?
在接受维普格拉替尼单药治疗(剂量分别为 200 mg、300 mg或 400 mg每日两次)的任何实体瘤可评估患者中,最常见的任何级别治疗期间出现的不良事件(TEAEs)包括腹泻(200 mg组:59%;300 mg组:77%;400 mg组:79%)、疲劳(34%;34%;27%)、丙氨酸氨基转移酶水平升高(27%;34%;31%)、食欲下降(24%;23%;31%)、天冬氨酸氨基转移酶水平升高(22%;31%;32%)、恶心(17%;19%;24%)、呕吐(17%;17%;16%)、便秘(15%;8%;18%)、血肌酐水平升高(15%;14%;11%)和尿路感染(8%;15%;18%)。特别关注的任何级别TEAEs包括皮肤疾病(34%;46%;47%)、手足综合征(10%;11%;15%)、口腔黏膜炎(25%;35%;27%)、口炎(22%;35%;26%)、高磷血症(19%;37%;34%)、指甲疾病(17%;20%;26%)、口干(7%;20%;21%)、眼部疾病(5%;31%;18%)和视网膜病变(2%;9%;5%)。
4.维普格拉替尼联合维恩妥尤单抗和帕博利珠单抗的初步数据有哪些?
在接受维普格拉替尼联合维恩妥尤单抗和帕博利珠单抗治疗的 5 名可评估患者中,4 名在首次扫描时达到缓解,包括 1 例完全缓解和 3 例部分缓解。联合治疗的安全性与这三种药物的已知特征一致。最常见的治疗相关不良事件包括恶心、腹泻、疲劳、食欲下降和口干,所有这些毒性的发生率均为 40%。
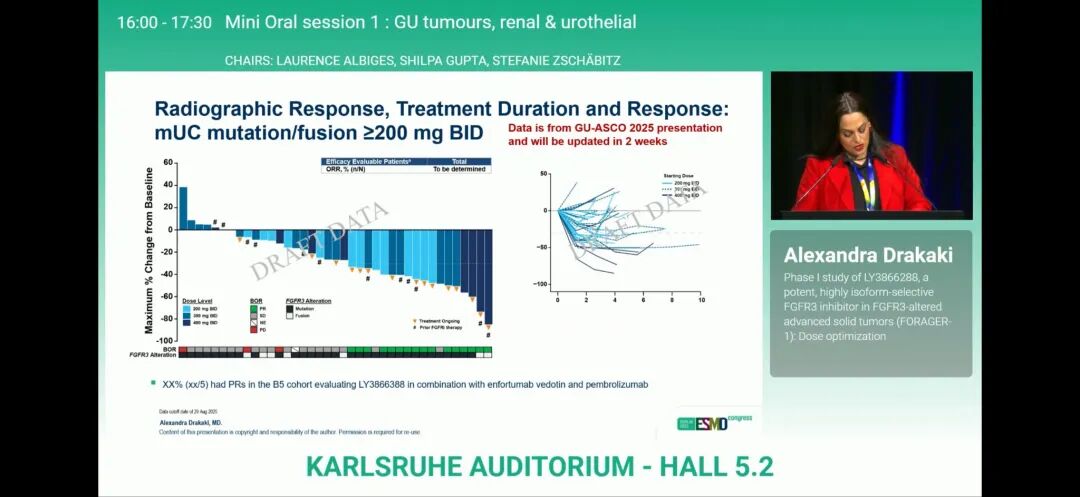
▲研究结果

▲研究结论
参考文献:
[1]Vepugratinib-Based Therapy Displays Potential in Metastatic FGFR3+ Urothelial Cancer
https://www.onclive.com/view/vepugratinib-based-therapy-displays-potential-in-metastatic-fgfr3-urothelial-cancer
[2]ESMO 2025: FORAGER-1: A Phase 1 Study of LY3866288, a Potent, Highly Isoform-Selective FGFR3 Inhibitor in FGFR3-Altered Advanced Solid Tumors
https://www.urotoday.com/conference-highlights/esmo-2025/esmo-2025-bladder-cancer/164036-esmo-2025-forager-1-a-phase-1-study-of-ly3866288-a-potent-highly-isoform-selective-fgfr3-inhibitor-in-fgfr3-altered-advanced-solid-tumors.html
[3]Drakaki A, Park SH, Castellano D, et al. Phase 1 study of vepugratinib (LY3866288), a potent, highly isoform-selective FGFR3 inhibitor in FGFR3-altered advanced solid tumors (FORAGER-1): dose optimization. Presented at: 2025 ESMO Congress; October 17-21, 2025; Berlin, Germany. Abstract 3070MO.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)