首页 > 医疗资讯/ 正文
摘 要 糖尿病患者认知功能障碍风险显著增加,严重影响患者生活质量,增加社会医疗负担。新型降糖药如钠-葡萄糖共转运蛋白2抑制剂(sodium-dependent glucose transporters 2,SGLT-2i)、二肽基肽酶-4抑制剂(dipeptidyl peptidase-4 inhibitor,DPP4-i)、胰高血糖素样肽1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RAs)、胰高血糖素样肽1受体/葡萄糖依赖性促胰岛素多肽受体激动剂(替尔泊肽)被发现在有效控制血糖的同时,还可通过抑制炎症、氧化应激、细胞凋亡和降低 β淀粉样蛋白(amyloid β-protein,Aβ)沉积、减少Tau蛋白磷酸化等病理生理过程延缓认知功能障碍进展。
关键词
糖尿病;认知功能障碍;胰高血糖素样肽1受体激动剂;钠-葡萄糖共转运蛋白2抑制剂;二肽基肽酶4抑制剂
流行病学研究[1]显示,糖尿病患者出现认知功能损伤的风险显著高于非糖尿病患者。在65岁以上的糖尿病患者中,认知功能障碍的发生率甚至可高达24%。目前,糖尿病被认为与多种神经退行性疾病(如阿尔茨海默病)具有一定的相关性[2]。糖尿病引起的胰岛素抵抗、慢性炎症、氧化应激以及线粒体功能障碍等因素均可通过损害神经元生存环境而加速认知功能的衰退[3]。这种病理生理机制的复杂性使得糖尿病患者在认知健康方面面临更大的挑战。随着降糖药的不断迭代更新,尤其是一些新型降糖药物如胰高血糖素样肽1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RAs)和钠-葡萄糖共转运蛋白2抑制剂(sodium-dependent glucose transporters 2,SGLT-2i)除了表现出优秀的血糖保护作用外,还显示出潜在的神经保护作用,为糖尿病患者延缓认知功能障碍提供了新的可能[4-5]。尽管如利拉鲁肽等新型降糖药在部分研究中表现出对认知功能的改善[3],但其延缓认知功能障碍的具体作用机制目前尚未完全明确。因此,进一步深入探讨新型降糖药在延缓认知功能障碍方面的作用机制,可能为延缓糖尿病患者认知功能障碍的进展提供新的见解,有助于糖尿病和认知功能障碍的共病管理。
1 新型降糖药在延缓糖尿病患者认知功能障碍进展中的应用
根据国际糖尿病联合会的数据,全球约有4.63亿成年人患有糖尿病,预计到2045年这一数字将增加到7亿[6]。近年来,越来越多的临床研究揭示了糖尿病与认知功能障碍之间的密切关系[7]。证据显示罹患糖尿病的患者痴呆的发病率比非糖尿病患者高出1.5~2.5倍[8]。糖尿病病程的长短、血糖控制优良与否以及是否伴发心血管疾病等多重因素均会影响糖尿病患者认知功能障碍的发生风险[9]。长期的高血糖可通过加重全身胰岛素抵抗影响大脑的胰岛素信号通路,导致β淀粉样蛋白(amyloid β-protein,Aβ)的沉积和Tau蛋白的过度磷酸化[10],协同糖尿病患者体内升高的炎症因子如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白细胞介素-6(interleukin- 6,IL-6)等在降低胰岛素作用的同时加重神经元的炎症反应和氧化应激,加速阿尔茨海默病(Alzheimer disease, AD)的进程[10-11]。血糖波动是认知功能下降的另一重要因素,对于血糖控制欠佳的患者,频繁的血糖波动不仅会导致短期内的认知功能障碍,还可能对长期的脑健康产生负面影响[12],特别是在执行功能和记忆能力方面[13]。对脑内的能量代谢和神经递质释放的影响可能是血糖波动加重神经退行性变的原因[10]。因此强调改善胰岛素抵抗和减少血糖波动对于延缓糖尿病患者认知功能障碍的重要性。
既往临床研究结果显示部分传统降糖药可延缓认知功能下降,但有效性及安全性尚存争议。如与未使用降糖药物的患者相比,使用二甲双胍的患者痴呆发生率降低了8%~10%[14]。但也有证据支持二甲双胍对认知功能的保护作用有限,特别是在老年患者中,早期使用二甲双胍并未能显著降低痴呆的发生率[14]。伴随着新型降糖药物的迭代更新,包括GLP-1RAs [15] 、二肽基肽酶-4抑制剂(dipeptidyl peptidase-4 inhibitor,DPP4-i)[16]、SGLT-2i [17]均被发现在血糖控制外可额外降低认知障碍风险,降糖药分类及降糖机制见表1,TANG等[18]对新型降糖药物的系统评价证实DPP4-i、GLP-1RAs和SGLT-2i可显著降低患者全因痴呆风险。LI等[19]对不同降糖药物与2型糖尿病患者痴呆风险之间关联的系统评价和网络荟萃分析也得到了与之相似的结果。
表1 降糖药及作用机制Tab.1 Hypoglycemic drugs and mechanism
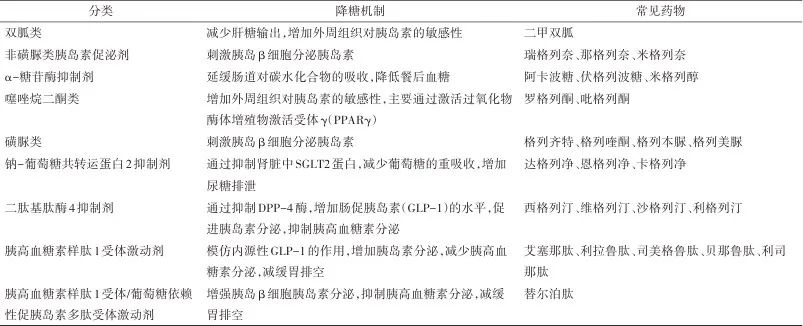
综上所述,新型降糖药物在降低认知障碍风险方面较传统降糖药在安全性及有效性上具有一定的优势,深入探究新型降糖药延缓认知功能障碍的机制将为延缓糖尿病患者认知功能障碍进展提供新的治疗选择,这为未来的研究和临床实践提供了新的方向。
2 新型降糖药物延缓认知功能下降的机制
2.1 胰高血糖素样肽1受体激动剂 GLP-1RAs是一类新型的降糖药物,主要通过模拟内源性胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的作用来改善血糖控制。GLP-1RAs通过多种机制发挥其血糖控制作用,包括促进胰岛素分泌、抑制胰高血糖素分泌、减缓胃排空和增加饱腹感等。在对AD患者及动物模型的研究中发现GLP-1RAs能促进线粒体功能和改善细胞能量代谢[20-21],降低神经元中活性氧(reactive oxygen species,ROS)水平减轻神经元氧化损伤[22],同时通过激活PI3K/Akt/mTOR/GCLc/redox信号通路,降低氧化应激诱导的凋亡相关蛋白的表达,促进神经元的存活[23-24]。体外研究还发现GLP-1RAs可以与DYRK1A抑制剂发挥协同作用,通过改善PI3K/Akt/GSK3β信号通路降低Tau和NFs蛋白过磷酸化的作用延缓AD早发[25-26]。除GLP-1RAs外,胰高血糖素样肽-1/胰高血糖素双激动剂以及胰高血糖素样肽-1/葡萄糖依赖性胰岛素分泌多肽/胰高血糖素三激动剂也可通过增加海马体中的PI3K/Akt表达,降低丝氨酸/苏氨酸激酶(glycogen synthase kinase 3 beta,GSK3β)水平,减轻记忆的下降,并减少海马体中Aβ斑块数量[27]。除直接影响PI3K/Akt信号通路外,GLP-1RAs还可通过触发cAMP-PKA-MEK-ERK途径激活cAMP反应元件结合蛋白(cyclic-AMP response binding protein,CREB)[28],调控下游脑源性神经营养因子基因(brain-derived neurotrophic factor,BDNF)、无嘌呤内切酶1和过氧化物酶体增殖激活受体的转录等降低ROS活性[29] ,并可以通过CREB-BDNF-TrkB信号通路增加抗氧化分子的生产[30]等多种途径减轻神经炎症和氧化应激,从而起到神经保护作用[31-32]。综上所述,GLP-1RAs主要通过影响PI3K/Akt信号通路参与炎症、氧化应激、细胞凋亡等多种途径起到神经保护作用。
2.2 钠-葡萄糖共转运蛋白2抑制剂 SGLT-2i是一类通过抑制肾小管对葡萄糖的重吸收来降低血糖的药物。这种机制使得葡萄糖通过尿液排出,从而降低血糖水平。近年来,SGLT-2i在糖尿病管理中被广泛应用,在有效降低血糖水平的同时观察到其还可对认知功能产生积极影响。前瞻性研究[33]观察到与仅接受二甲双胍治疗的患者相比,联用 SGLT-2i的2型糖尿病患者在认知能力评估中表现更优。在对老年糖尿病患者的认知评估中也发现SGLT-2i可显著改善认知功能障碍[34],尤其是在蒙特利尔认知评估(Montreal cognitive assessment, MoCA)评分上,治疗组的评分显著高于对照组。体外研究[35]进一步证实了SGLT-2i的认知保护作用,使用达格列净治疗的糖尿病小鼠在认知能力测试中表现出更好的记忆和学习能力,且其脑组织中的Aβ和Tau蛋白的积累显著减少。SGLT-2i主要通过抗炎、抗氧化、改善线粒体功能发挥神经保护作用[36]。卡格列净在高血糖条件下展现出显著的抗氧化和抗炎作用,已被证明能够显著降低BV-2小胶质细胞中活性氧和一氧化氮水平,抑制NF-κB、JNK和p38 MAPK等关键炎症信号通路[37],除对信号通路的影响外,卡格列净还可促进NF-κB p65向细胞质的转位,降低胞质中促炎细胞因子如TNF-α、白细胞介素1β(interleukin-1β,IL-1β)、一氧化氮合酶和环氧合酶-2的产生,减轻中枢神经系统炎症反应,保护细胞免受高血糖诱导的细胞凋亡及自噬降解[37]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和神经营养因子-4(neurotrophic factors 4,NT4)是参与神经保护和神经元存活的关键神经营养因子[38-39],在恩格列净和达格列净治疗的糖尿病小鼠前额叶皮质中可观察到BDNF和NT4蛋白水平的显著升高,且伴随着小鼠认知功能的改善[40],提示SGLT-2i可通过调控神经影响因子延缓认知功能障碍进展。缺血诱导因子1α(hypoxia-inducible factor 1 alpha subunit,HIF1α)是细胞对缺氧反应的关键调节因子,同样具有神经保护功能。达格列净可通过增强葡萄糖代谢、减少氧化应激和改善脑血流增加糖尿病小鼠大脑中HIF1α的水平[41] 改善认知功能。除对神经营养因子及缺氧反应的调控以外,达格列净还可通过上调淀粉样蛋白前体蛋白和α-突触核蛋白基因的表达,增加小鼠神经可塑性,改善小鼠认知功能[40]。上述研究结果揭示SGLT-2i在认知功能改善方面的作用是多维度的,涉及NF-κB、JNK和p38 MAPK多条信号通路,可通过减轻炎症、改善代谢和增强神经可塑性等多种途径延缓认知功能障碍进展。
2.3 二肽基肽酶-4抑制剂
二肽基肽酶-4(dipeptidyl peptidase 4,DPP4)是一种广泛表达的丝氨酸蛋白酶,能够水解多种生物活性肽,包括GLP-1和葡萄糖依赖性胰岛素分泌多肽(glucose-dependent insulinotropic polypeptide,GIP)。在中枢神经系统中,DPP4参与神经保护的作用机制是多样的[42]。Tau蛋白与Aβ的相互作用在AD的发病过程中扮演着重要角色[43],DPP4可以将AD患者淀粉样斑块的主要成分Aβ1-42和Aβ1-40切割成Aβ3-42和Aβ3-40,后被谷氨酰环化酶进一步加工成不可降解的焦谷氨酸 Aβ,最终聚集形成淀粉样斑块,导致 AD 进展,DPP4-i可通过抑制DPP4活性减少Aβ 沉积和Tau 磷酸化[44]。除对DPP4的直接调控作用外,DPP4-i已被证明可通过提高GLP-1和GIP的利用度,减少糖原合酶激酶-3β活性,降低 Aβ 沉积,减少 Tau 磷酸化并促进BDNF的表达影响Aβ片段的裂解[42,45]。基质细胞衍生因子-1α(stromal cell-derived factor 1 α,SDF-1α)是一种调控细胞迁移的趋化因子,通过结合细胞表面的 CXCR4受体激活下游信号通路(如PI3K/Akt、MAPK) 发挥作用。在中枢神经系统中主要通过招募骨髓源性小胶质细胞迁移至脑内,增强对Aβ的吞噬能力[46],通过减少Aβ诱导的神经元树突退化和细胞凋亡[47],保护突触完整性[48]等多种途径参与神经保护作用,可被DPP4降解,而DPP4抑制剂可通过抑制DPP4活性,增加SDF-1α的生物利用度,增强其神经保护作用[49]。除减少Aβ沉积,增加神经保护性底物的生物利用度之外,DPP4-i还可通过减少海马体中促炎细胞因子如 TNF-α、IL-6和 NF-κB等促炎因子的含量,减少神经炎症[50];激活Nrf2/HO-1通路增强脑组织中谷胱甘肽等抗氧化酶活性,阻止活性氧的过度产生并加速活性氧的清除,进而维持线粒体功能,减少神经元细胞中的氧化应激[51-52];激活AMPK-Sirt1信号通路减轻 Aβ 诱导的神经元凋亡[42,53]等多种途径延缓认知功能障碍进展。
3 总结与展望
机制研究在理解疾病的病理生理过程中至关重要。糖尿病患者合并认知功能障碍的风险显著增加[54]。深入探讨高血糖如何通过影响脑内胰岛素信号传导、导致Aβ、Tau蛋白的过度磷酸化等途径加速认知功能障碍的进展,是未来研究的重要方向之一[3]。机制研究不仅有助于揭示疾病的本质,还为开发新的治疗方法提供了理论基础和实践指导。个体化治疗在糖尿病和认知功能障碍的管理中显示出良好的前景。随着对不同患者群体的生物标志物和遗传背景的深入理解,个体化治疗能够根据患者的具体情况制定更为精准的治疗方案。且随着新型降糖药的问世及其在降低心血管风险和改善认知功能方面的潜在作用,为糖尿病患者的个体化治疗提供了新的思路[14,55]。此外,针对老年糖尿病患者的治疗策略也应考虑到合并症的影响,制定更为个性化的治疗方案,以降低低血糖风险和改善生活质量[56]。未来的研究应继续探索个体化治疗的有效性和可行性,以期为患者提供更为优化的治疗选择。
在近年来的研究中,新型降糖药物被发现可能在降低痴呆风险方面具有潜力,这为糖尿病患者的认知健康管理开辟了新的思路。尽管已有一些初步证据支持这一观点,但现有研究依然存在局限性。例如,样本量不足、研究设计的多样性及随访时间的短暂性,使得研究结果的普遍性和可靠性受到影响。此外,许多研究未充分考虑患者的个体差异,如年龄、性别、病程及共病情况等因素,这可能导致结果的偏倚。因此,未来的研究需要在样本选择、研究设计和数据分析方法上更加严谨,以增强结论的有效性。同时,综合管理糖尿病与认知健康的重要性愈发突出。糖尿病与认知功能障碍之间的复杂关系要求我们采取多维度的干预措施,不仅要关注血糖水平的控制,还应重视生活方式的干预、心理健康的维护及社会支持的提供。健康的饮食、规律的锻炼和良好的心理状态都可能对改善糖尿病患者的认知功能产生积极影响。因此,未来的临床实践应致力于构建一个多学科协作的综合管理模式,以期最大限度地少认知障碍风险,提高患者的生活质量。
参考文献:
1. HOU Y, CHEN Z, CHENG J, et al. The Mechanism and Treatment of Cognitive Dysfunction in Diabetes: A Review[J]. Exp Clin Endocrinol Diabetes, 2025, 133(2): 64-72.
2. HONG C T, CHEN J H, HU C J. Role of glucagon-like peptide-1 receptor agonists in Alzheimer’s disease and Parkinson’s disease[J]. J Biomed Sci, 2024, 31(1): 102.
3. WANG Y, HU H, LIU X, et al. Hypoglycemic medicines in the treatment of Alzheimer’s disease: Pathophysiological links between AD and glucose metabolism[J]. Front Pharmacol, 2023, 14: 1138499.
4. ZŁOTEK M, KUROWSKA A, HERBET M, et al. GLP-1 Analogs, SGLT-2, and DPP-4 Inhibitors: A Triad of Hope for Alzheimer’s Disease Therapy[J]. Biomedicines, 2023, 11(11): 3035.
5. QI L, GAO R, CHEN Z, et al. Liraglutide reduces oxidative stress and improves energy metabolism in methylglyoxal-induced SH-SY5Y cells[J]. Neurotoxicology, 2022, 92: 166-179.
6. YOO J E, HAN K, KIM B, et al. Changes in Physical Activity and the Risk of Dementia in Patients With New-Onset Type 2 Diabetes: A Nationwide Cohort Study[J]. Diabetes Care, 2022, 45(5): 1091-1098.
7. 傅小玲, 蒋虹, 唐志雄, 等. 糖尿病与精神疾病共病研究进展[J]. 中国神经精神疾病杂志, 2007, 33(8): 505-507.
8. NINOMIYA T. Epidemiological Evidence of the Relationship Between Diabetes and Dementia[J]. Adv Exp Med Biol, 2019, 1128: 13-25.
9. CUEVAS H, STUIFBERGEN A K, HILSABECK R C, et al. The role of cognitive rehabilitation in people with type 2 diabetes: A study protocol for a randomized controlled trial[J]. PLoS One, 2023, 18(5): e0285553.
10. SANTIAGO J A, KARTHIKEYAN M, LACKEY M, et al. Diabetes: A tipping point in neurodegenerative diseases[J]. Trends Mol Med, 2023, 29(12): 1029-1044.
11. JANOUTOVÁ J, MACHACZKA O, ZATLOUKALOVÁ A, et al. Is Alzheimer’s disease a type 3 diabetes? A review[J]. Cent Eur J Public Health, 2022, 30(3): 139-143.
12. MA M, JING G, TIAN Y, et al. Ferroptosis in Cognitive Impairment Associated with Diabetes and Alzheimer’s Disease: Mechanistic Insights and New Therapeutic Opportunities[J]. Mol Neurobiol, 2025, 62(2): 2435-2449.
13. CUEVAS H, STUIFBERGEN A K, HILSABECK R, et al. Perceived Cognitive Function and Glycemic Variability: Baseline Results From a Cognitive Rehabilitation Intervention[J]. Sci Diabetes Self Manag Care, 2024, 50(4): 310-319.
14. SALAS J, MORLEY J E, SCHERRER J F, et al. Risk of incident dementia following metformin initiation compared with noninitiation or delay of antidiabetic medication therapy[J]. Pharmacoepidemiol Drug Saf, 2020, 29(6): 623-634.
15. PELLE M C, ZAFFINA I, GIOFRÈ F, et al. Potential Role of Glucagon-like Peptide-1 Receptor Agonists in the Treatment of Cognitive Decline and Dementia in Diabetes Mellitus[J]. Int J Mol Sci, 2023, 24(14): 11301.
16. LIU S, WAN H, NIE S, et al. Dipeptidyl peptidase 4 inhibitors vs. metformin for new-onset dementia: A propensity score-matched cohort study[J]. J Clin Endocrinol Metab, 2025, 110(3): e650-e659.
17. SHIN A, KOO B K, LEE J Y, et al. Risk of dementia after initiation of sodium-glucose cotransporter-2 inhibitors versus dipeptidyl peptidase-4 inhibitors in adults aged 40-69 years with type 2 diabetes: Population based cohort study[J]. BMJ, 2024, 386: e079475.
18. TANG H, SHAO H, SHAABAN C E, et al. Newer glucose-lowering drugs and risk of dementia: A systematic review and meta-analysis of observational studies[J]. J Am Geriatr Soc, 2023, 71(7): 2096-2106.
19. LI Z, LIN C, CAI X, et al. Anti-diabetic agents and the risks of dementia in patients with type 2 diabetes: a systematic review and network meta-analysis of observational studies and randomized controlled trials[J]. Alzheimers Res Ther, 2024, 16(1): 272.
20. VERMA A, GOYAL A. Beyond insulin: The Intriguing role of GLP-1 in Parkinson’s disease[J]. Eur J Pharmacol, 2024, 982: 176936.
21. PANDEY S, MANGMOOL S, MADREITER-SOKOLOWSKI C T, et al. Exendin-4 protects against high glucose-induced mitochondrial dysfunction and oxidative stress in SH-SY5Y neuroblastoma cells through GLP-1 receptor/Epac/Akt signaling[J]. Eur J Pharmacol, 2023, 954: 175896.
22. GHOSH P, FONTANELLA R A, SCISCIOLA L, et al. Targeting redox imbalance in neurodegeneration: characterizing the role of GLP-1 receptor agonists[J]. Theranostics, 2023, 13(14): 4872-4884.
23. URKON M, FERENCZ E, SZÁSZ J A, et al. Antidiabetic GLP-1 Receptor Agonists Have Neuroprotective Properties in Experimental Animal Models of Alzheimer’s Disease[J]. Pharmaceuticals (Basel), 2025, 18(5): 614.
24. KIMURA R, OKOUCHI M, FUJIOKA H, et al. Glucagon-like peptide-1 (GLP-1) protects against methylglyoxal-induced PC12 cell apoptosis through the PI3K/Akt/mTOR/GCLc/redox signaling pathway[J]. Neuroscience, 2009, 162(4): 1212-1219.
25. KUMAR K, MAN-UN UNG P, WANG P, et al. Novel selective thiadiazine DYRK1A inhibitor lead scaffold with human pancreatic β-cell proliferation activity[J]. Eur J Med Chem, 2018, 157: 1005-1016.
26. ZHOU M, CHEN S, PENG P, et al. Dulaglutide ameliorates STZ induced AD-like impairment of learning and memory ability by modulating hyperphosphorylation of tau and NFs through GSK3β[J]. Biochem Biophys Res Commun, 2019, 511(1): 154-160.
27. WANG Z J, HAN Y F, ZHAO F, et al. A dual GLP-1 and Gcg receptor agonist rescues spatial memory and synaptic plasticity in APP/PS1 transgenic mice[J]. Horm Behav, 2020, 118: 104640.
28. SUN Y, MA C, SUN H, et al. Metabolism: A Novel Shared Link between Diabetes Mellitus and Alzheimer’s Disease[J]. J Diabetes Res, 2020, 2020: 4981814.
29. YANG J L, CHEN W Y, CHEN Y P, et al. Activation of GLP-1 Receptor Enhances Neuronal Base Excision Repair via PI3K-AKT-Induced Expression of Apurinic/Apyrimidinic Endonuclease 1[J]. Theranostics, 2016, 6(12): 2015-2027.
30. OH Y S, JUN H S. Effects of Glucagon-Like Peptide-1 on Oxidative Stress and Nrf2 Signaling[J]. Int J Mol Sci, 2017, 19(1): 26.
31. HÖLSCHER C. Protective properties of GLP-1 and associated peptide hormones in neurodegenerative disorders[J]. Br J Pharmacol, 2022, 179(4): 695-714.
32. GLOTFELTY E J, OLSON L, KARLSSON T E, et al. Glucagon-like peptide-1 (GLP-1)-based receptor agonists as a treatment for Parkinson’s disease[J]. Expert Opin Investig Drugs, 2020, 29(6): 595-602.
33. OSMAN S T, PURBA W, DARAMOLA O, et al. Positive impact of DPP-4 or SGLT2 inhibitors on mild cognitive impairment in type 2 diabetes patients on metformin therapy: A metabolomic mechanistic insight[J]. Biomed Pharmacother, 2024, 182: 117771.
34. MONE P, LOMBARDI A, GAMBARDELLA J, et al. Empagliflozin Improves Cognitive Impairment in Frail Older Adults With Type 2 Diabetes and Heart Failure With Preserved Ejection Fraction[J]. Diabetes Care, 2022, 45(5): 1247-1251.
35. SIM A Y, CHOI D H, KIM J Y, et al. SGLT2 and DPP4 inhibitors improve Alzheimer’s disease-like pathology and cognitive function through distinct mechanisms in a T2D-AD mouse model[J]. Biomed Pharmacother, 2023, 168: 115755.
36. GUI Z, WANG J, ZHANG Y, et al. Dapagliflozin improves diabetic cognitive impairment via indirectly modulating the mitochondria homeostasis of hippocampus in diabetic mice[J]. Biofactors, 2024, 50(1): 145-160.
37. LEE C T, LIN K D, HSIEH C F, et al. SGLT2 Inhibitor Canagliflozin Alleviates High Glucose-Induced Inflammatory Toxicity in BV-2 Microglia[J]. Biomedicines, 2023, 12(1): 36.
38. MITROSHINA E V, YARKOV R S, MISHCHENKO T A, et al. Brain-Derived Neurotrophic Factor (BDNF) Preserves the Functional Integrity of Neural Networks in the β-Amyloidopathy Model in vitro[J]. Front Cell Dev Biol, 2020, 8: 582.
39. EGGERT S, KINS S, ENDRES K, et al. Brothers in arms: proBDNF/BDNF and sAPPα/Aβ-signaling and their common interplay with ADAM10, TrkB, p75NTR, sortilin, and sorLA in the progression of Alzheimer’s disease[J]. Biol Chem, 2022, 403(1): 43-71.
40. PIĄTKOWSKA-CHMIEL I, HERBET M, GAWROŃSKA-GRZYWACZ M, et al. Molecular and neural roles of sodium-glucose cotransporter 2 inhibitors in alleviating neurocognitive impairment in diabetic mice[J]. Psychopharmacology (Berl), 2023, 240(4): 983-1000.
41. ZHANG Z, YAN J, SHI H. Role of Hypoxia Inducible Factor 1 in Hyperglycemia-Exacerbated Blood-Brain Barrier Disruption in Ischemic Stroke[J]. Neurobiol Dis, 2016, 95: 82-92.
42. PIĄTKOWSKA-CHMIEL I, GAWROŃSKA-GRZYWACZ M, PAWŁOWSKI K, et al. Restoring Brain Pathways Involved in Diabetes-Associated Neurocognitive Disorders: The Potential of Dipeptidyl Peptidase 4 Inhibitors as a Therapeutic Strategy[J]. Curr Neuropharmacol, 2025, 23(4): 426-438.
43. 徐菁, 陈生弟. 阿尔茨海默病中Tau蛋白和Aβ相互作用的研究进展[J]. 中国神经精神疾病杂志, 2014, 40(4): 251-254.
44. ANTONYAN A, SCHLENZIG D, SCHILLING S, et al. Concerted action of dipeptidyl peptidase IV and glutaminyl cyclase results in formation of pyroglutamate-modified amyloid peptides in vitro[J]. Neurochem Int, 2018, 113: 112-119.
45. SIDDIQUI N, ALI J, PARVEZ S, et al. Linagliptin, a DPP-4 inhibitor, ameliorates Aβ (1-42) peptides induced neurodegeneration and brain insulin resistance (BIR) via insulin receptor substrate-1 (IRS-1) in rat model of Alzheimer’s disease[J]. Neuropharmacology, 2021, 195: 108662.
46. WANG Q, XU Y, CHEN J C, et al. Stromal cell-derived factor 1α decreases β-amyloid deposition in Alzheimer’s disease mouse model[J]. Brain Res, 2012, 1459: 15-26.
47. RAMAN D, MILATOVIC S Z, MILATOVIC D, et al. Chemokines, macrophage inflammatory protein-2 and stromal cell-derived factor-1α, suppress amyloid β-induced neurotoxicity[J]. Toxicol Appl Pharmacol, 2011, 256(3): 300-313.
48. SANFILIPPO C, CASTROGIOVANNI P, IMBESI R, et al. Postsynaptic damage and microglial activation in AD patients could be linked CXCR4/CXCL12 expression levels[J]. Brain Res, 2020, 1749: 147127.
49. KOSARAJU J, HOLSINGER R M D, GUO L, et al. Linagliptin, a Dipeptidyl Peptidase-4 Inhibitor, Mitigates Cognitive Deficits and Pathology in the 3xTg-AD Mouse Model of Alzheimer’s Disease[J]. Mol Neurobiol, 2017, 54(8): 6074-6084.
50. EL-SAHAR A E, SAFAR M M, ZAKI H F, et al. Sitagliptin attenuates transient cerebral ischemia/reperfusion injury in diabetic rats: Implication of the oxidative-inflammatory-apoptotic pathway[J]. Life Sci, 2015, 126: 81-86.
51. DARSALIA V, JOHANSEN O E, LIETZAU G, et al. Dipeptidyl Peptidase-4 Inhibitors for the Potential Treatment of Brain Disorders; A Mini-Review With Special Focus on Linagliptin and Stroke[J]. Front Neurol, 2019, 10: 493.
52. LI Y, TIAN Q, LI Z, et al. Activation of Nrf2 signaling by sitagliptin and quercetin combination against β-amyloid induced Alzheimer’s disease in rats[J]. Drug Dev Res, 2019, 80(6): 837-845.
53. JIANG X, LI J, YAO X, et al. Neuroprotective effects of dipeptidyl peptidase 4 inhibitor on Alzheimer’s disease: a narrative review[J]. Front Pharmacol, 2024, 15: 1361651.
54. HOBDAY A L, PARMAR M S. The Link Between Diabetes Mellitus and Tau Hyperphosphorylation: Implications for Risk of Alzheimer’s Disease[J]. Cureus, 2021, 13(9): e18362.
55. KIVIPELTO M, PALMER K, HOANG T D, et al. Trials and Treatments for Vascular Brain Health: Risk Factor Modification and Cognitive Outcomes[J]. Stroke, 2022, 53(2): 444-456.
56. ALTUNTAŞ Y. Approach Toward Diabetes Treatment in the Elderly[J]. Sisli Etfal Hastan Tip Bul, 2019, 53(2): 96-102.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)