首页 > 医疗资讯/ 正文
胰腺癌为恶性程度极高的实体肿瘤,其5年生存率约5-8%,且发病率和死亡率持续上升,全球范围内未见显著改善。主要病理类型为胰腺导管腺癌(PDAC),具有早期诊断难、易转移复发且对放化疗耐药等特点,成为临床治疗中的挑战。目前缺乏有效靶向药物及新型治疗策略,亟需开辟新途径。
铁死亡(ferroptosis)是一种依赖铁、由脂质过氧化驱动的程序性细胞死亡方式,与传统凋亡、坏死及自噬机制不同。其调控涉及多重代谢通路,包括多不饱和脂肪酸磷脂合成与过氧化、铁代谢以及谷胱甘肽过氧化物酶4(GPX4)及其它非GPX4抗铁死亡防御系统。铁死亡在肿瘤发生、转移以及抗药性形成中起着关键作用,成为肿瘤治疗潜在突破口。
目前已有多类铁死亡诱导剂(如Erastin、RSL3、FSP1抑制剂等)问世,但在体内疗效及临床应用上仍有限。鉴于胰腺癌高表达的ALDH1A1对肿瘤抗氧化和干细胞性质维护具有重要作用,且与治疗抵抗相关,ALDH1A1成为有潜力的治疗靶点。Sorcin作为一种钙结合蛋白,广泛参与钙稳态及多重信号通路调控,在多种肿瘤进展和多药耐药中被报道,但其作用机制尚有待深究。
近日,中国南开大学Quan Zhang课题组在Journal of Hematology & Oncology发表题为“Disruption of the sorcin‒PAX5 protein‒protein interaction induces ferroptosis by promoting the FBXL12-mediated ubiquitination of ALDH1A1 in pancreatic cancer”的原创研究。该研究系统揭示了Sorcin蛋白通过调控PAX5/FBXL12/ALDH1A1轴抑制胰腺癌细胞铁死亡的机制,攻克了胰腺癌治疗中的难题。更进一步,通过筛选天然产物库发现Celastrol能靶向Sorcin,破坏其与PAX5的结合,诱导铁死亡,提示该蛋白-蛋白相互作用为胰腺癌治疗的新靶点。研究意义重大,为抗肿瘤药物研发开辟新途径。

本研究基于TCGA及GEO数据库分析Sorcin在胰腺癌中的表达及临床相关性。细胞功能实验包括Sorcin及ALDH1A1基因敲减与过表达,检测铁死亡标志物(脂质ROS、MDA等)、肿瘤迁移、浸润能力和肿瘤干细胞特性。通过蛋白组学、共免疫沉淀(Co-IP)、染色质免疫沉淀(ChIP)、荧光素酶报告基因实验解析Sorcin调控机制。利用表面等离子共振(SPR)高通量筛选天然产物,结合细胞热稳定性检测(CETSA)、体内外结合实验验证Celastrol与Sorcin结合位点。体内利用细胞系和患者来源异种移植模型(CDX/PDX)评价药效。研究设计严谨,多角度验证发现。
研究结果
1. Sorcin高表达及其临床相关性
- TCGA数据分析显示胰腺癌患者Sorcin表达升高与OS、DSS、PFS、RFI均显著相关(p<0.05, 图.1A)。
- GEO多个数据集(GSE15471 等)验证Sorcin mRNA于癌组织显著高表达于正常组织(图.1B)。
- 免疫组化染色证明Sorcin蛋白在胰腺癌组织尤其高分期组织中表达增强,与较差预后显著相关(图.1C-E)。
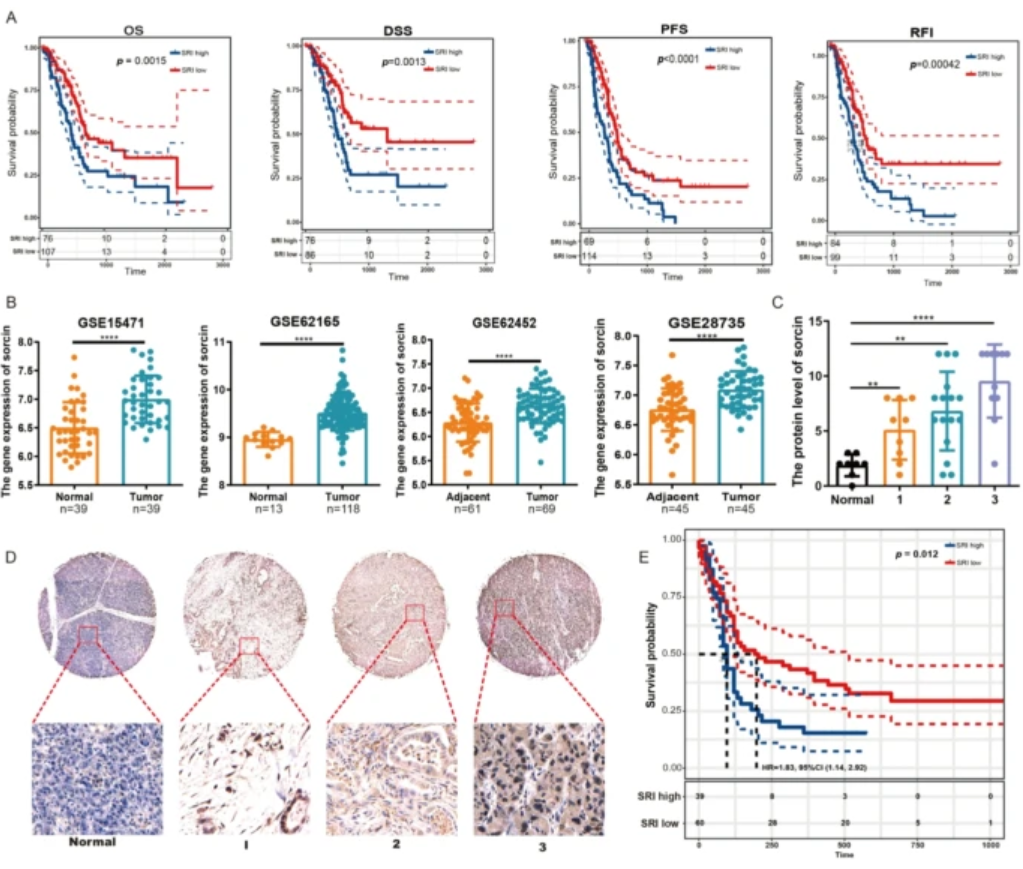
图1 Sorcin高表达与胰腺癌临床分期及患者生存相关
2. Sorcin促进胰腺癌细胞增殖、迁移和干性
- 多个胰腺癌细胞系Sorcin高表达,敲低Sorcin后ALDH1A1表达下调,过表达Sorcin则升高(图.2A-B)。
- Sorcin敲低抑制胰腺癌细胞迁移、侵袭能力,过表达相反(图.2C-E)。
- 干细胞样表型检测(肿瘤球形成,ALDH+比例)均指示Sorcin促进胰腺癌细胞干性维持(图.2F-J)。
- 小鼠异种移植模型中Sorcin敲低显著抑制肿瘤生长,并伴随ALDH1A1蛋白水平下降(图.2K-M)。
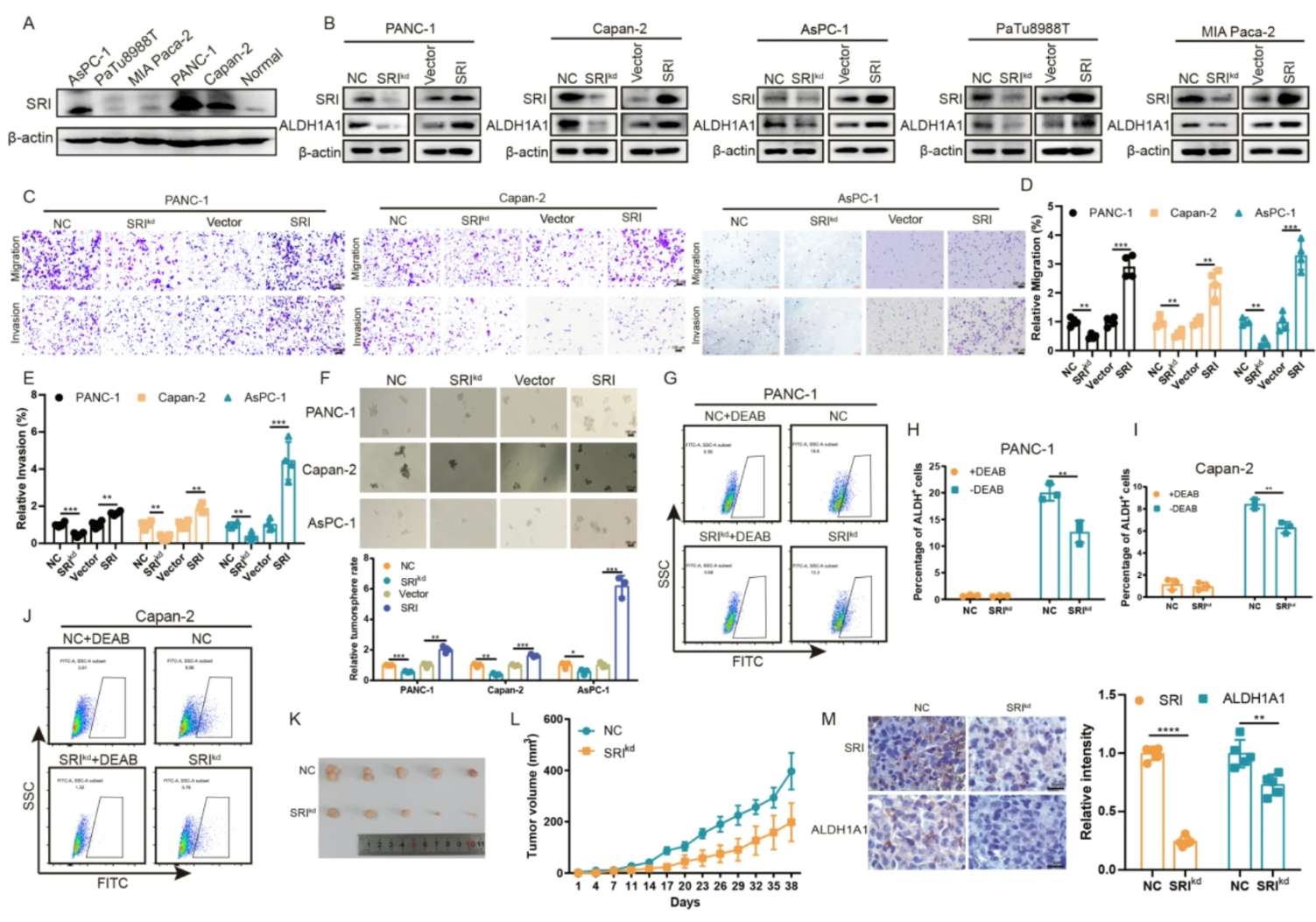
图2 Sorcin促进胰腺癌进展相关表型
3. Sorcin抑制胰腺癌细胞铁死亡
- Sorcin敲低提高脂质过氧化产物(脂质ROS、MDA)水平;过表达则降低(图.3A-J)。
- 电镜显示Sorcin敲低细胞线粒体典型铁死亡形态改变(皱缩、胼胝体减少)(图.3K)。
- Sorcin敲低引起GSDMD-N升高,提示与铁死亡相关的继发性催发的细胞焦亡(Pyoportosis),铁死亡抑制剂Liproxstatin1能抑制该过程(图.3M-N)。
- Sorcin敲低使细胞对铁死亡诱导剂(RSL3、Erastin)敏感性增强,过表达反之(图.4A-H)。
- Sorcin敲低与铁死亡诱导剂协同抑制细胞迁移和侵袭,铁死亡抑制剂减弱该效应(图.4I-N)。
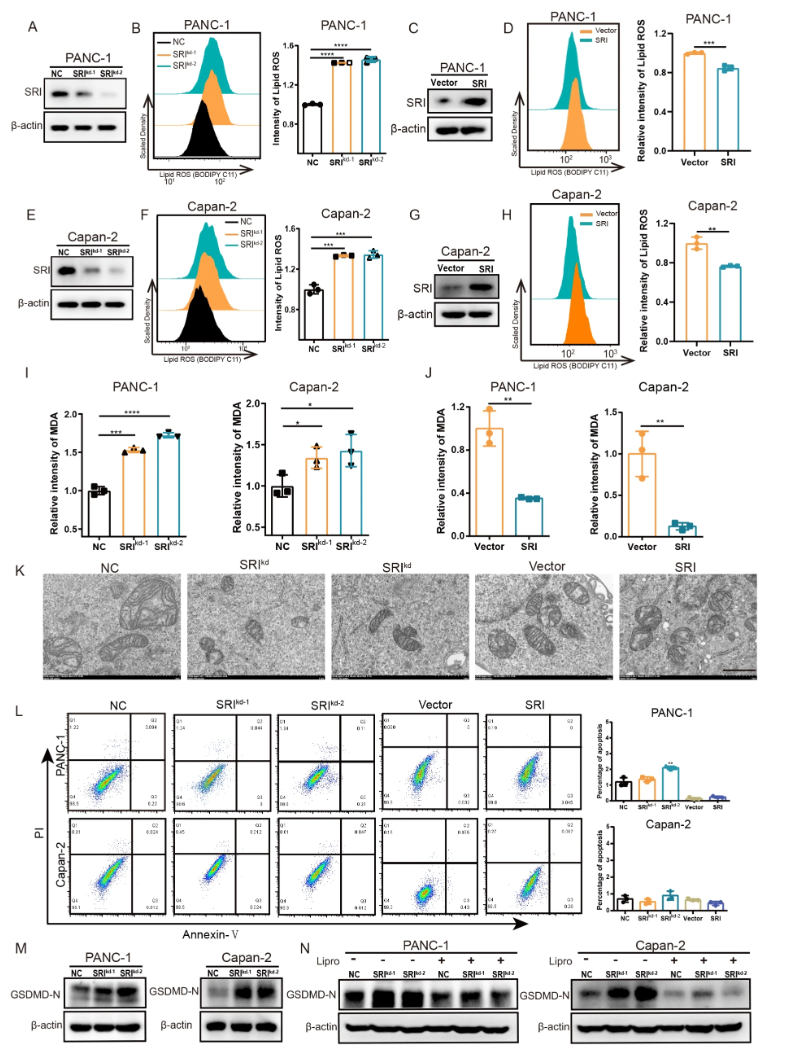
图3 Sorcin抑制铁死亡
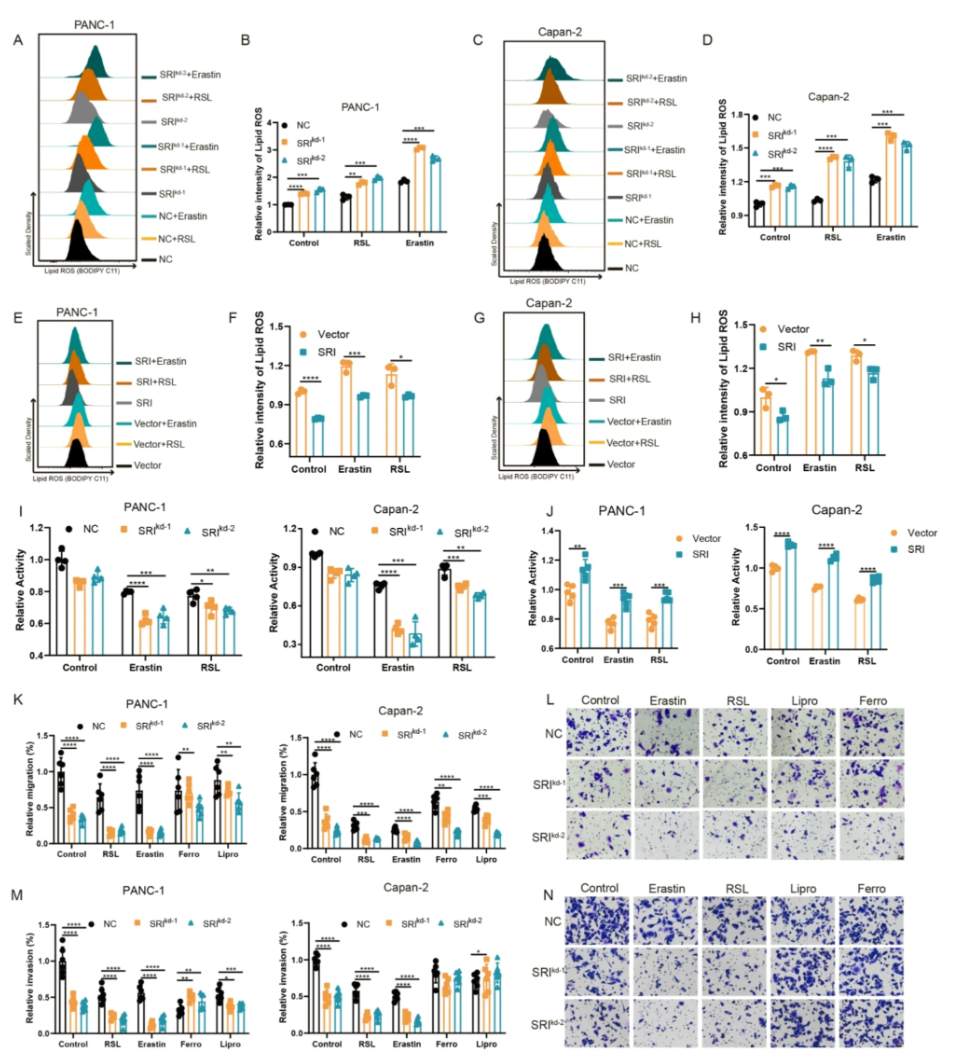
图4 Sorcin调控铁死亡敏感性
4. ALDH1A1在铁死亡中的功能及其调控
- ALDH1A1敲低增加脂质ROS和MDA,减少迁移侵袭能力,增敏铁死亡诱导剂(图.5A-M)。
- ALDH1A1酶抑制剂DSF和DEAB也诱导脂质过氧化,增强铁死亡诱导剂效果(图.5L-P)。
- ALDH1A1过表达能逆转Sorcin敲低诱导的铁死亡(图.5Q-R),表明Sorcin通过调节ALDH1A1实现抑制铁死亡。

图5 ALDH1A1介导铁死亡调控
5. Sorcin通过非钙结合机制调控FBXL12及ALDH1A1
- Sorcin敲低细胞内Ca2+升高;通过钙螯合剂BAPTA-AM实验显示Sorcin调控ALDH1A1非钙依赖(图.6A-C)。
- 蛋白组学提示Sorcin敲低显著上调E3泛素连接酶FBXL12表达(图.6D)。
- qPCR和免疫印迹证实Sorcin敲低上调,过表达下调FBXL12水平(图.6E-I)。
- IHC显示FBXL12在胰腺癌组织低表达,低FBXL12与不良预后相关(图.6J-L)。
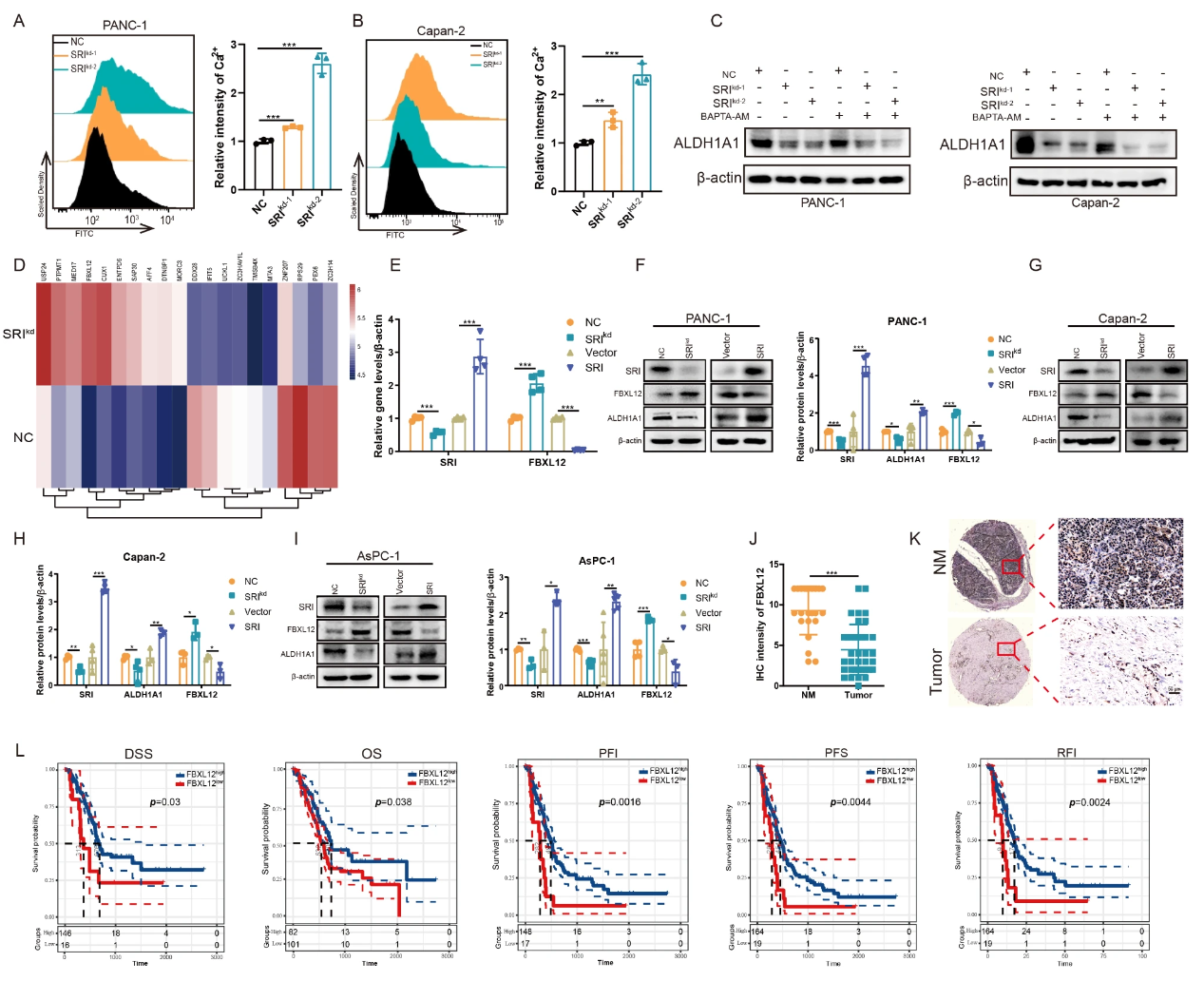
图6 Sorcin/FBXL12/ALDH1A1表达相关分析
6. FBXL12促进ALDH1A1泛素化降解,抑制胰腺癌进展
- FBXL12敲低增强胰腺癌细胞迁移、肿瘤球形成,ALDH1A1显著升高,反之减弱(图.7A-F)。
- FBXL12敲低能逆转Sorcin敲低诱导的ALDH1A1降低和铁死亡增加(图.7G-I)。
- Proteasome抑制剂MG132阻断ALDH1A1降解,cycloheximide促使ALDH1A1降解,被FBXL12敲低抵消(图.8A-F)。
- 免疫共定位及Co-IP证实FBXL12直接与ALDH1A1相互作用,并介导ALDH1A1泛素化(图.8G-K)。
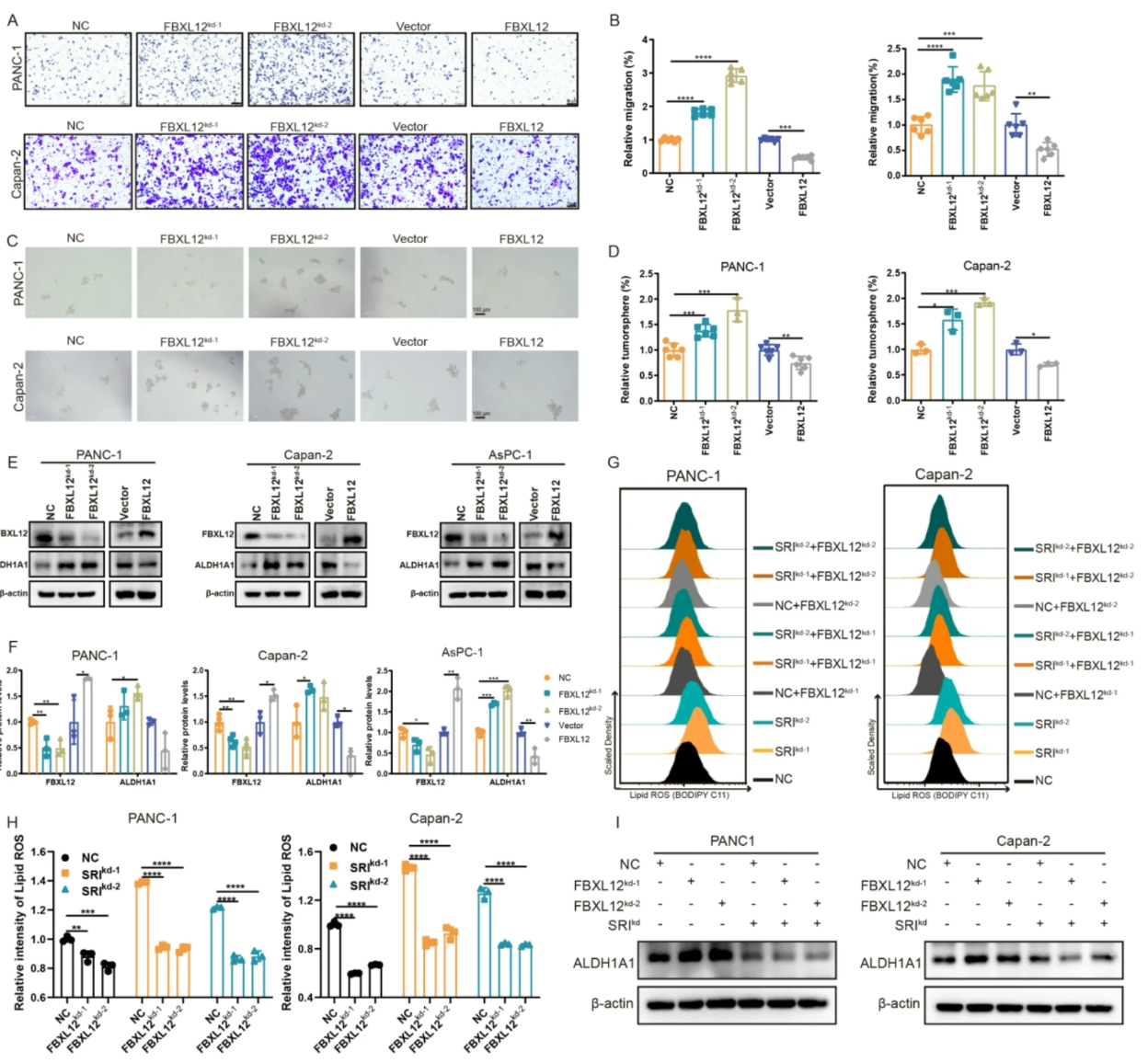
图7 FBXL12调控肿瘤特性
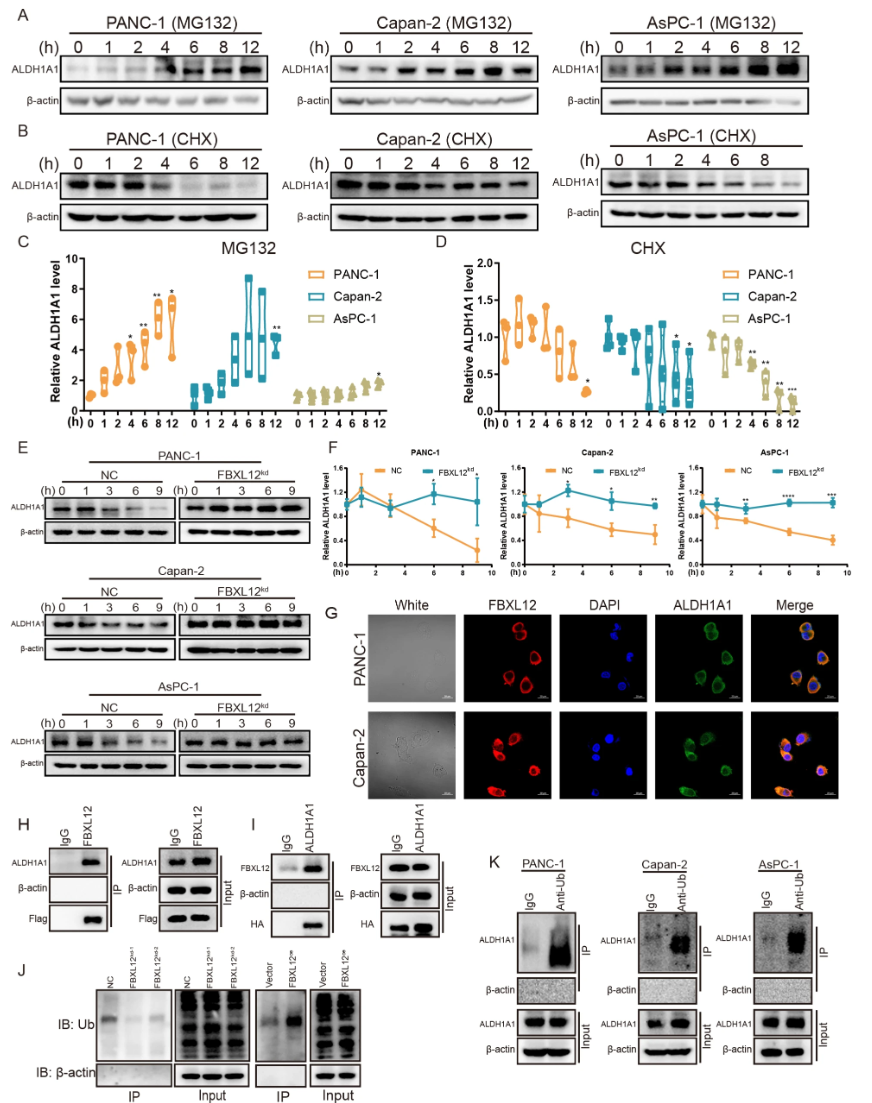
图8 FBXL12介导ALDH1A1泛素化降解
7. Sorcin通过抑制PAX5核转位调控FBXL12基因表达
- Promoter片段报告基因实验和ChIP明确PAX5结合FBXL12启动子核心区(P6片段,位点2为主要结合位点)(图.9C-G)。
- PAX5敲低降低,过表达上调FBXL12及下调ALDH1A1蛋白水平(图.9H)。
- Co-IP证实Sorcin与PAX5直接相互作用(图.9I-J)。
- Sorcin敲低促进PAX5核转位,过表达抑制(免疫荧光及核质分离Western blot)(图.9K-N)。
- 整体模型:Sorcin在细胞质结合PAX5阻碍其入核,减少FBXL12转录,稳定ALDH1A1蛋白,抑制铁死亡。
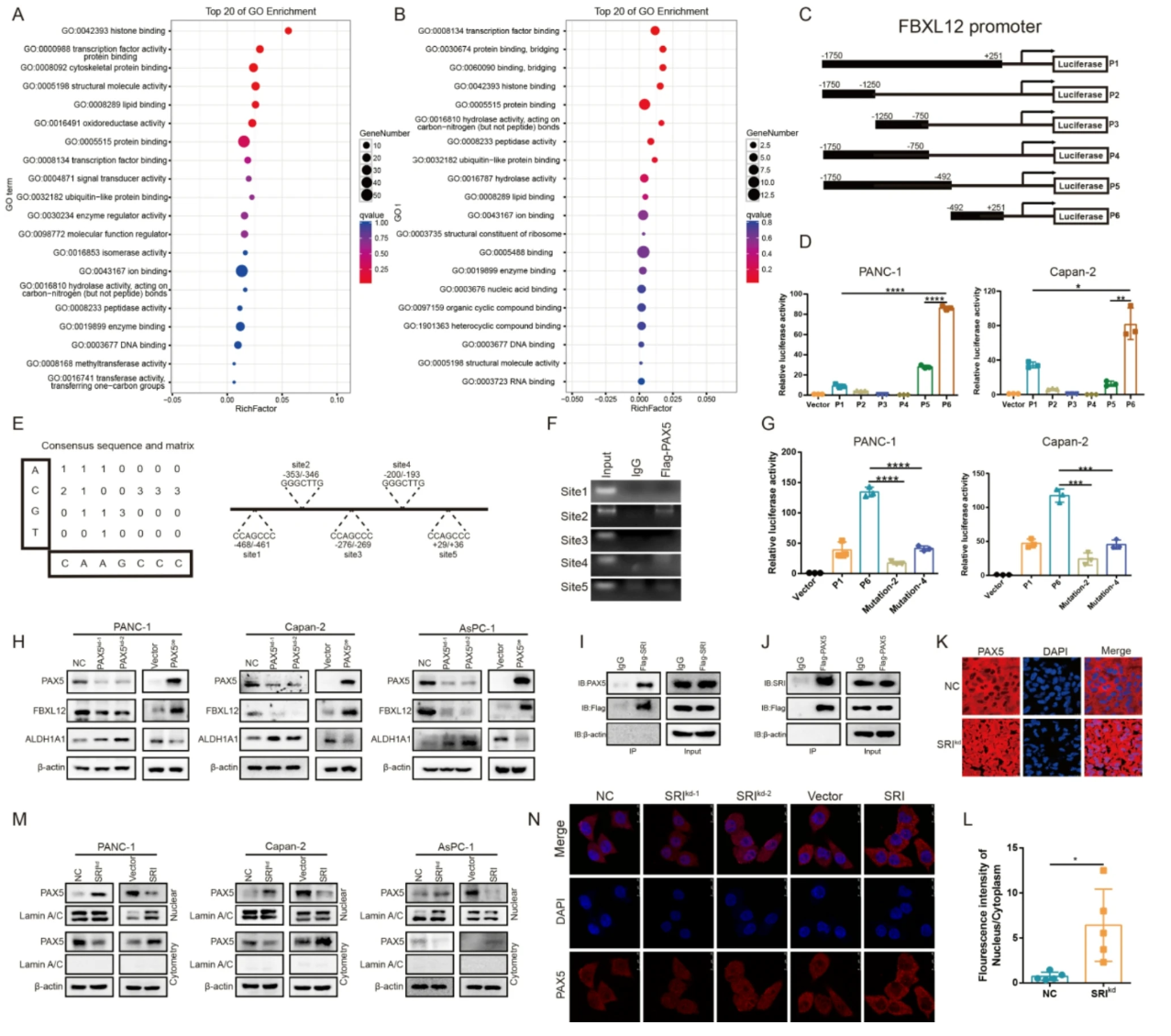
图9 Sorcin调控PAX5/FBXL12轴
8. Celastrol作为新型天然铁死亡诱导剂靶向Sorcin
- SPR筛选304种天然产物,发现Celastrol对Sorcin亲和力最高(Kd=2.13 µM)(图.10A-C)。
- Celastrol抑制多株胰腺癌细胞增殖,减少克隆形成,抑制肿瘤迁移(图.10D-G)。
- CETSA实验显示Celastrol提高Sorcin热稳定性,表明直接结合(图.10H-J)。
- 室内click chemistry和生物素标记探针1进一步确认Celastrol细胞内外均特异结合Sorcin(图.10K-Q)。
- 分子对接定位Celastrol以共价键结合Sorcin Cys194,Cys194S突变显著降低结合(图.10R-U)。
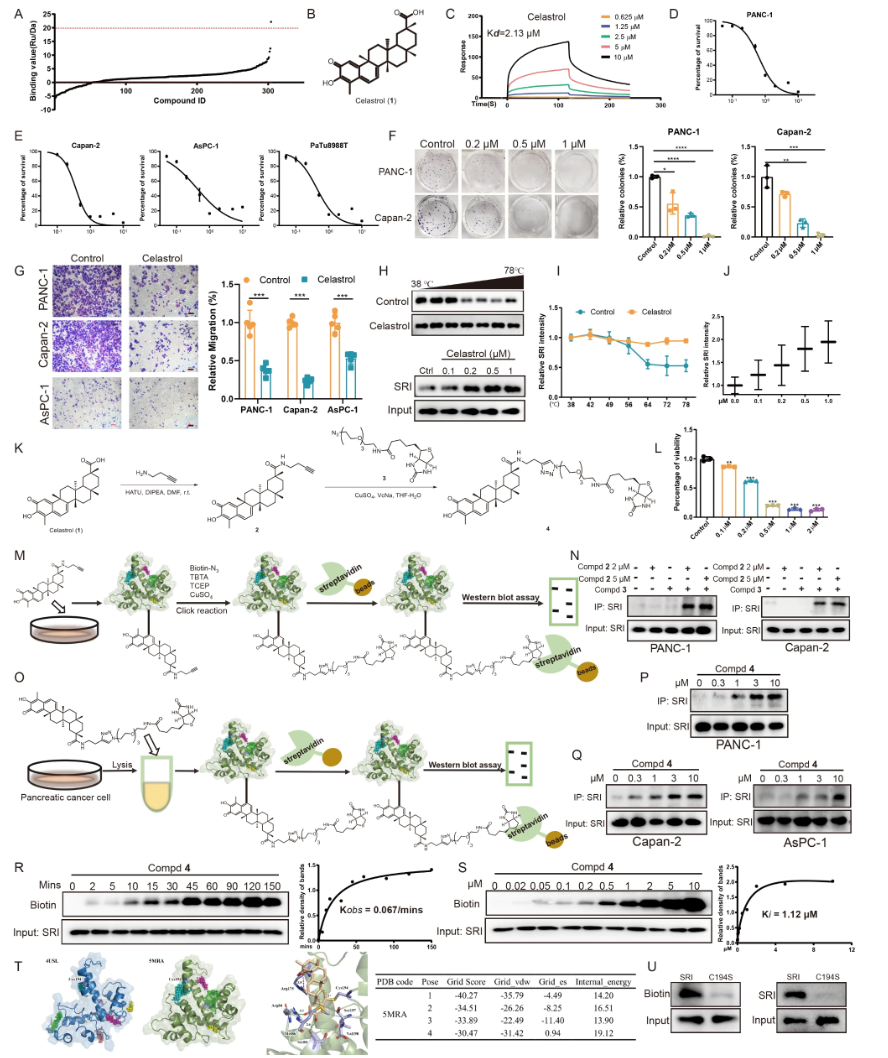
图10 Celastrol靶向Sorcin结合验证
9. Celastrol破坏Sorcin‒PAX5相互作用促进铁死亡
- Co-IP显示Celastrol明显抑制Sorcin与PAX5的相互作用(图.11A)。
- Celastrol促进PAX5核转位,增加FBXL12表达,降低ALDH1A1蛋白,增强ALDH1A1泛素化(图.11B-F)。
- Celastrol诱导脂质过氧化及MDA积累,与RSL3、Erastin等铁死亡诱导剂协同促进细胞死亡,铁死亡抑制剂法人和ferrostatin逆转Celastrol效应(图.11G-O)。

图11 Celastrol诱导铁死亡机制及功能验证
10. Celastrol体内抗肿瘤疗效
- CDX和PDX动物模型中,Celastrol(5mg/kg)显著抑制肿瘤生长,降低肿瘤体积与重量,无明显毒性(图.12A-J)。
- 肿瘤组织IHC显示Celeastrol降低ALDH1A1,升高FBXL12表达。

图12 Celastrol抑瘤及靶点表达改变
研究意义与展望
本研究首次阐明Sorcin蛋白作为胰腺癌铁死亡上游抑制因子的分子机制,开创了Sorcin‒PAX5‒FBXL12‒ALDH1A1轴调控铁死亡的新范式。铁死亡作为克服胰腺癌耐药性的新兴细胞死亡方式,开发针对Sorcin的药物具有重要的临床转化潜力。研究发现的天然产物Celastrol能够靶向Sorcin的关键位点Cys194,从而破坏Sorcin与PAX5的结合,激活铁死亡信号通路,显示出了宝贵的药物开发前景。
胰腺癌目前缺乏有效治疗手段,Sorcin‒PAX5相互作用作为新型药物靶点为胰腺癌特别是耐药肿瘤治疗提供了新方向。未来可通过Celastrol结构优化提高特异性和安全性,同时验证机制在其他癌种中通用性。此外,结合纳米递送系统或免疫治疗,进一步增强铁死亡诱导剂的疗效亦具应用价值。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)