首页 > 医疗资讯/ 正文
肝细胞癌(HCC)对免疫治疗的总体反应率适中,免疫治疗耐药机制尚不完全清楚。
2025年6月27日,华中科技大学张必翔、丁则阳、张万广、黄昭共同通讯在Science Immunology在线发表题为“Riplet promotes lipid metabolism changes associated with CD8 T cell exhaustion and anti–PD-1 resistance in hepatocellular carcinoma”的研究论文,该研究表明,在HCC中,E3泛素连接酶Riplet被启动子高甲基化普遍沉默。
Riplet的缺失调节脂肪酸代谢,促进CD8 T细胞的终末耗竭。Riplet损失阻碍了脂肪酸合酶(FASN)K48连接的多泛素化,从而加速了HCC中脂肪酸的产生。肿瘤细胞衍生的游离脂肪酸,特别是棕榈酸(PA/C16:0),通过增强T细胞中的棕榈酰化来激活STAT3(信号转导子和转录激活子3),从而引发CD8 T细胞的终末耗竭。具有Riplet缺陷的HCC细胞对抗PD-1治疗有抵抗力,用FASN抑制剂治疗可以克服抵抗力。该研究显示了Riplet如何改变脂质代谢,诱导CD8 T细胞耗竭和抗PD-1耐药性,从而为治疗Riplet缺陷型HCC患者的联合疗法提供了途径。

建议将基于免疫疗法的治疗作为晚期肝细胞癌(HCC)的一线全身治疗。然而,只有15%至35%的晚期HCC患者对基于免疫疗法的全身治疗有反应。细胞毒性细胞的耗竭以及肿瘤微环境(TME)内的细胞毒性细胞耗竭与HCC对免疫疗法的耐药性有关。然而,TME形成促进疲劳和免疫治疗耐药性发展的机制仍在探索中。因此,需要确定更好的生物标志物来预测HCC患者对免疫疗法的反应。
脂肪酸代谢的重新编程与癌症免疫逃避有关。免疫反应通常可分为原发性肿瘤或抗肿瘤,两者都涉及不同比例的免疫细胞,如自然杀伤细胞(NK细胞)、T细胞、巨噬细胞、树突细胞(DCs)和髓源性抑制细胞(MDSCs)。肥胖诱导的脂肪酸积累导致NK细胞的代谢缺陷,并通过抑制细胞毒性分子运输与抗肿瘤功能的丧失有关。肿瘤浸润性CD4调节性T细胞(Treg细胞)中细胞外脂质摄取的增加通过调节代谢适应性促进了它们的丰度和抑制活性。树突状细胞中异常的脂质积聚会削弱其与抗肿瘤T细胞结合并激活抗肿瘤T细胞的能力,或促进中性粒细胞或MDSCs中的肿瘤免疫反应。此外,越来越多的证据表明,CD8 T细胞,抗肿瘤免疫的关键执行者,受到TME中积累的脂肪酸的严格调节。例如,亚油酸可以通过改善代谢适应性来增强CD8 T细胞的抗肿瘤活性。微生物群衍生的短链脂肪酸,如戊酸酯和丁酸酯,通过诱导代谢和表观遗传重编程增强CD8 T细胞活化和效应子功能。然而,CD36对脂肪酸摄取的增加通过诱导脂质过氧化、铁死亡和p38激酶的下游激活抑制了CD8 T细胞效应子功能和肿瘤控制。肥胖诱导的TME脂肪酸积累也损害了CD8 T细胞的浸润和功能。这些发现表明,脂肪酸对CD8 T细胞的影响是复杂的,这可能与特定的T细胞亚群和肿瘤类型有关。因此,阐明脂肪酸对CD8 T细胞抗肿瘤免疫的作用和潜在机制对癌症免疫治疗具有潜在的意义。
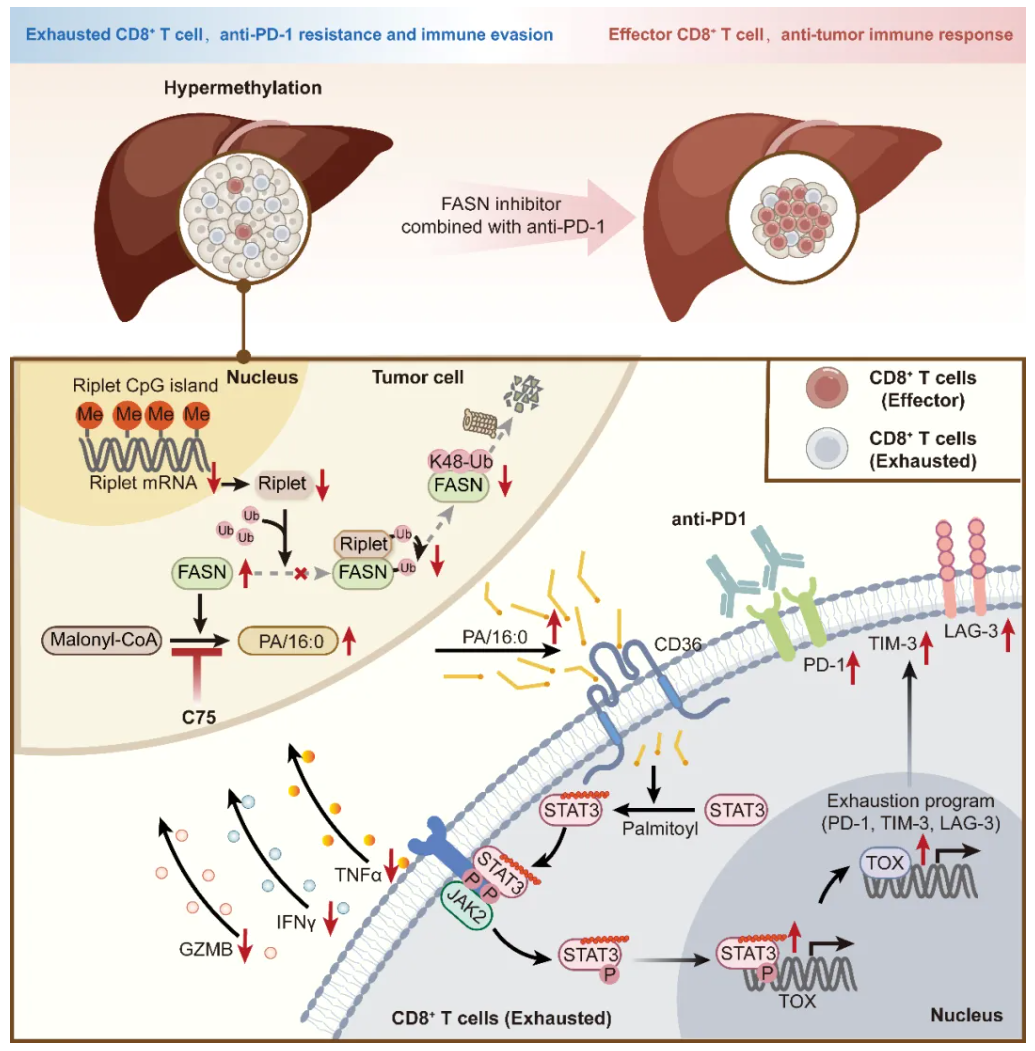
机理模式图(图源自Science Immunology)
Riplet是一种环指结构域E3泛素连接酶,通过泛素化RIG-I在抗病毒和炎症反应中发挥关键作用。一项生物信息学研究表征了HCC中Riplet基因启动子的高甲基化。此外,这项研究表明,Riplet表达的减少与HCC中免疫细胞浸润的减少有关。然而,Riplet在HCC中的确切作用及其潜在机制尚不清楚。
在这项研究中,研究人员确定Riplet缺陷的HCC细胞表现出脂肪酸代谢重排,其特征是脂肪酸合酶(FASN)介导的脂肪酸合成增强,导致TME中游离脂肪酸(FFAs)的积累。HCC细胞来源的 FFA,尤其是棕榈酸(PA/C16:0),通过CD36激活的信号转导和转录激活因子3(STAT3)信号传导促进CD8 T细胞末端耗竭。总之,该研究鉴定Riplet为调控HCC脂肪酸合成的关键因子,其缺失通过改变脂质代谢诱导CD8+ T细胞耗竭和抗PD-1耐药性,从而为Riplet缺陷型HCC患者的联合治疗策略奠定了理论基础。
参考信息:
https://www.science.org/doi/10.1126/sciimmunol.ado3485#tab-contributors
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)