首页 > 医疗资讯/ 正文
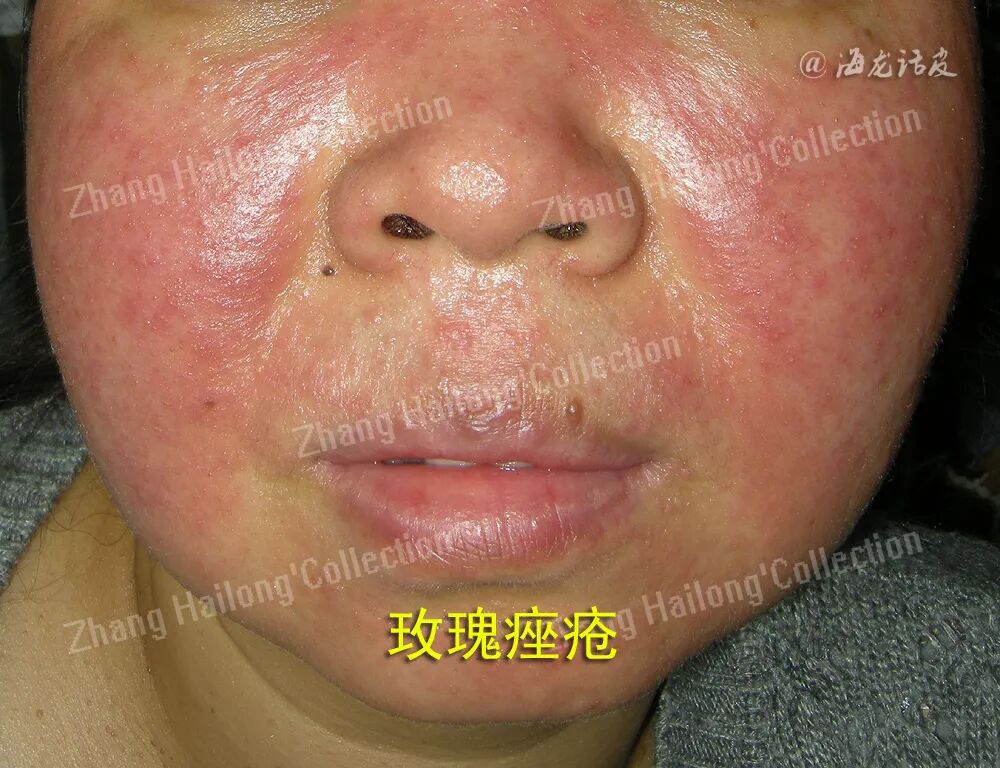
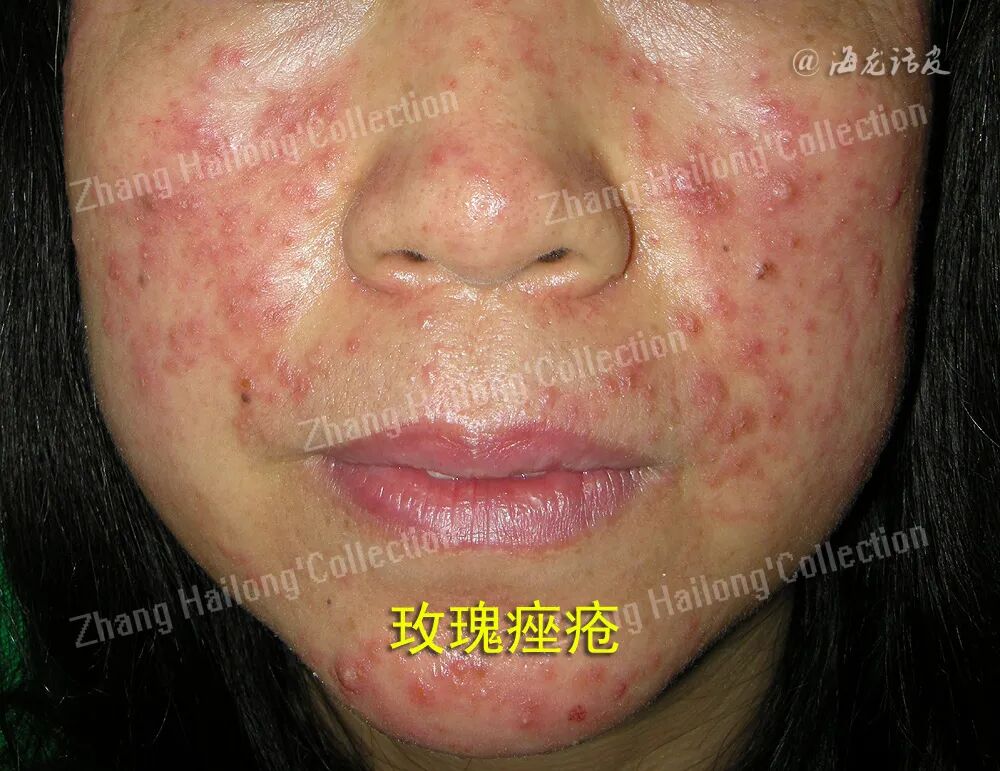
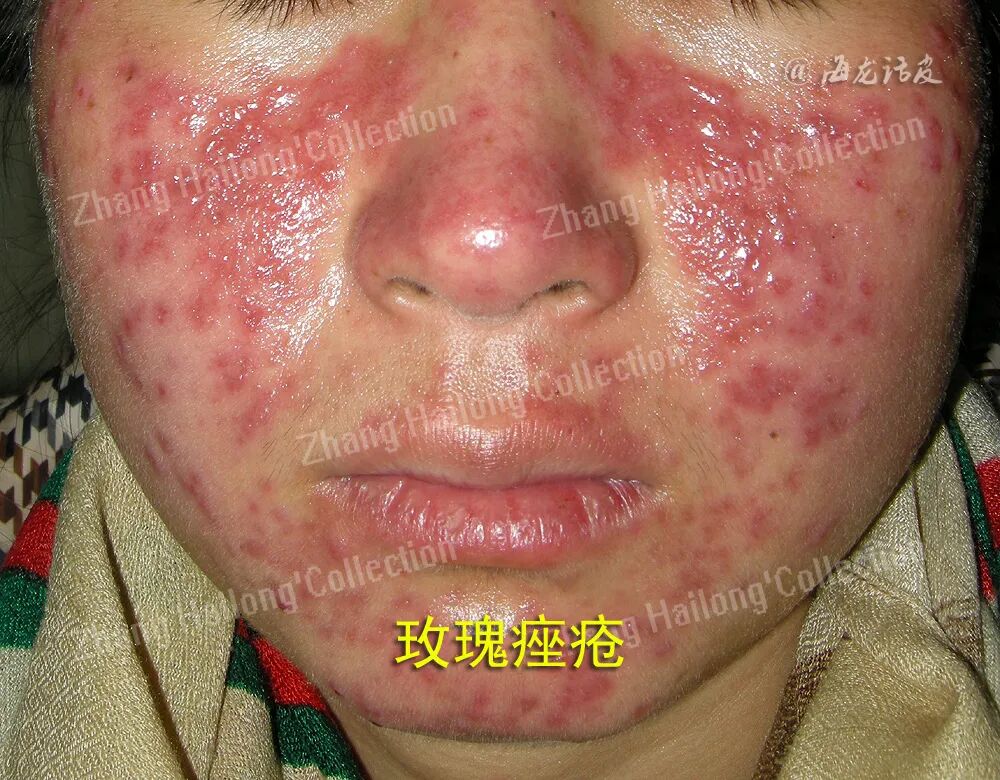
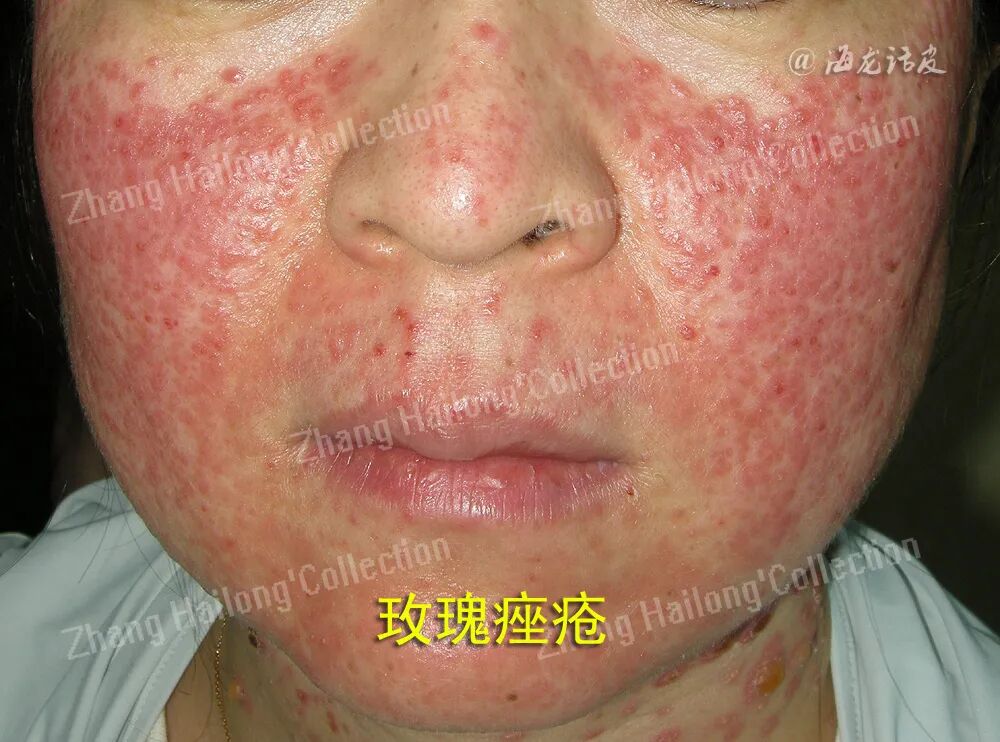
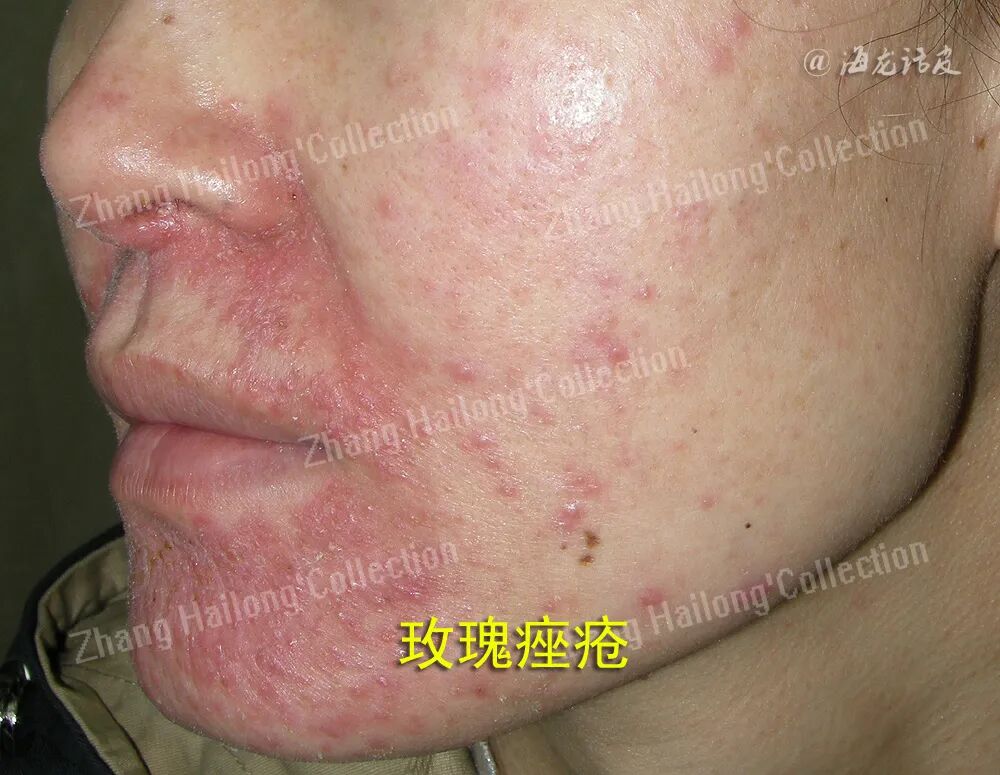
玫瑰痤疮是一种经常累及面中部的慢性炎症性皮肤病,其主要临床表现为面部皮肤阵发性潮红,可出现红斑、毛细血管扩张,并伴有丘疹、脓疱以及局部增生等,部分患者有视物模糊、睑缘毛细血管扩张、巩膜炎、角膜炎等眼部表现。患者常自觉面部皮肤干燥、灼热、瘙痒、刺痛、紧绷或肿胀等不适。我国67.11%的玫瑰痤疮患者存在自卑或尴尬等消极情绪。
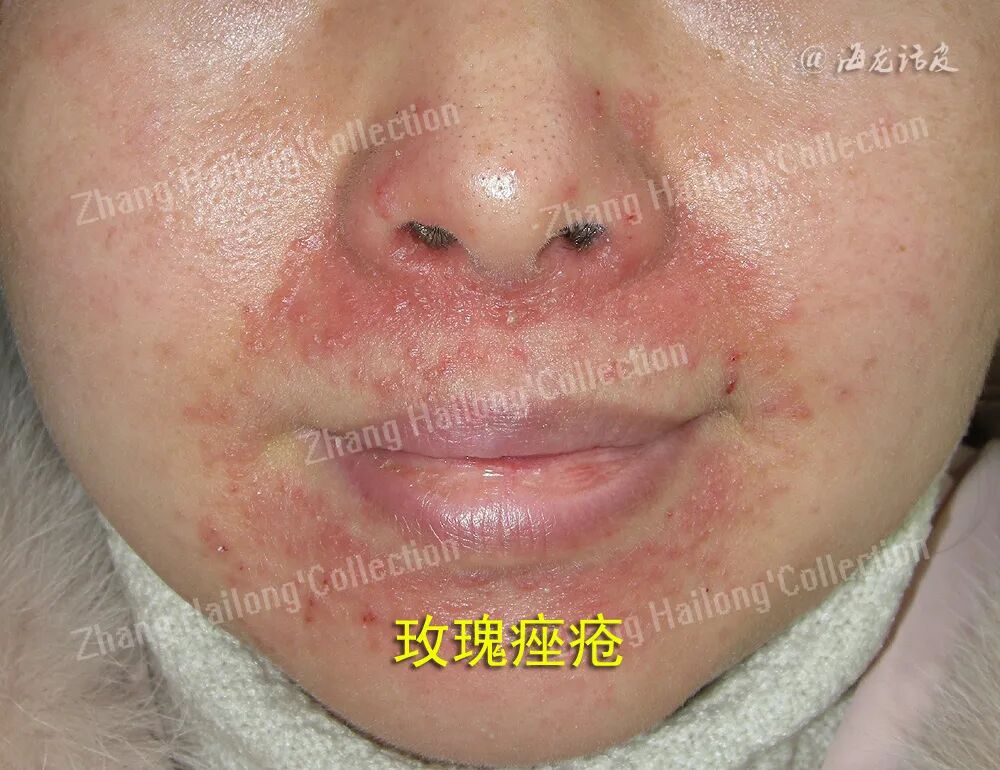
玫瑰痤疮的发病机制目前还不完全清楚,涉及遗传因素、环境因素、微生物感染、皮肤屏障受损、神经元和血管功能障碍以及免疫系统破坏等复杂的相互作用。紫外线(ultraviolet,UV)照射是引起玫瑰痤疮发生和发展的重要环境因素。
玫瑰痤疮通常在肤色白皙的个体中更易观察到,白种人中的凯尔特和北欧人种更容易发生玫瑰痤疮。玫瑰痤疮可由急性UV照射、晒伤引发,在接受光化学疗法治疗的患者中也有报道。UV辐射能够引起玫瑰痤疮患者的皮肤炎症、血管新生、毛细血管扩张和纤维化,加剧面部潮红,使玫瑰痤疮症状恶化。玫瑰痤疮的皮损常见于鼻、脸颊、前额,这可能是因为面部中心更容易暴露于UV中,而颏下和眶上区域等阳光照射较少部位的皮损则较为少见。上述临床证据均提示,UV是玫瑰痤疮的诱发和加重的重要因素。
UV损伤皮肤的机制
UV的波长范围为100~400nm,分为UVA(320~400nm)、UVB(290~320nm)和UVC(200~290nm)。UVA因其波长较长可以穿透真皮,UVB通常被表皮和真皮上层吸收,而UVC常被大气层阻隔难以到达地面。UV对皮肤中的组织、细胞,以及DNA、脂质和蛋白质等分子成分均有影响,可能导致氧化损伤、眼损伤、晒伤、退行性衰老、炎症和皮肤癌等。
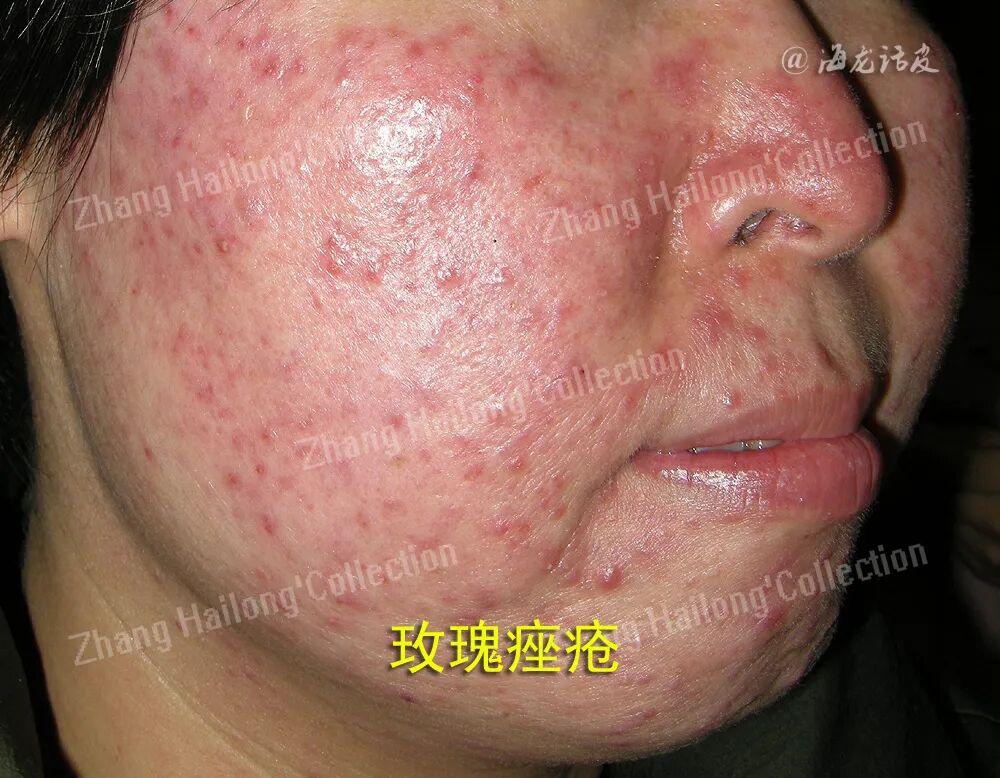
1、UV造成DNA损伤:
细胞及细胞中的分子在UV照射后,以复杂的方式与其发生相互作用,其中DNA是主要受影响的细胞成分。对DNA造成损害的主要是UVB,表皮中的角质形成细胞(keratinocyte,KC)和朗格汉斯细胞里的DNA能直接吸收UVB,导致DNA链中相邻嘧啶之间形成(6-4)嘧啶-嘧啶酮和环丁烷嘧啶二聚体(cyclobutane pyrimidine dimers,CPD)2种嘧啶二聚体。这2种光产物被认为是UV诱导的DNA损伤的标志性病变产物。它们都对DNA结构具有破坏性,可使DNA螺旋发生扭曲,从而抑制RNA聚合酶的功能并降低基因表达。虽然在UVA的波长范围内DNA对其吸收很少,但UVA能够通过氧化应激介导DNA的损伤。UVA诱导产生的活性氧(reactive oxygen species,ROS)使鸟嘌呤的8位生成8-氧鸟嘌呤,从而损伤DNA。UVA还能诱导产生CPD,加剧DNA损伤。UV诱导的DNA损伤会损害DNA复制的协调过程,导致基因组不稳定和细胞死亡。
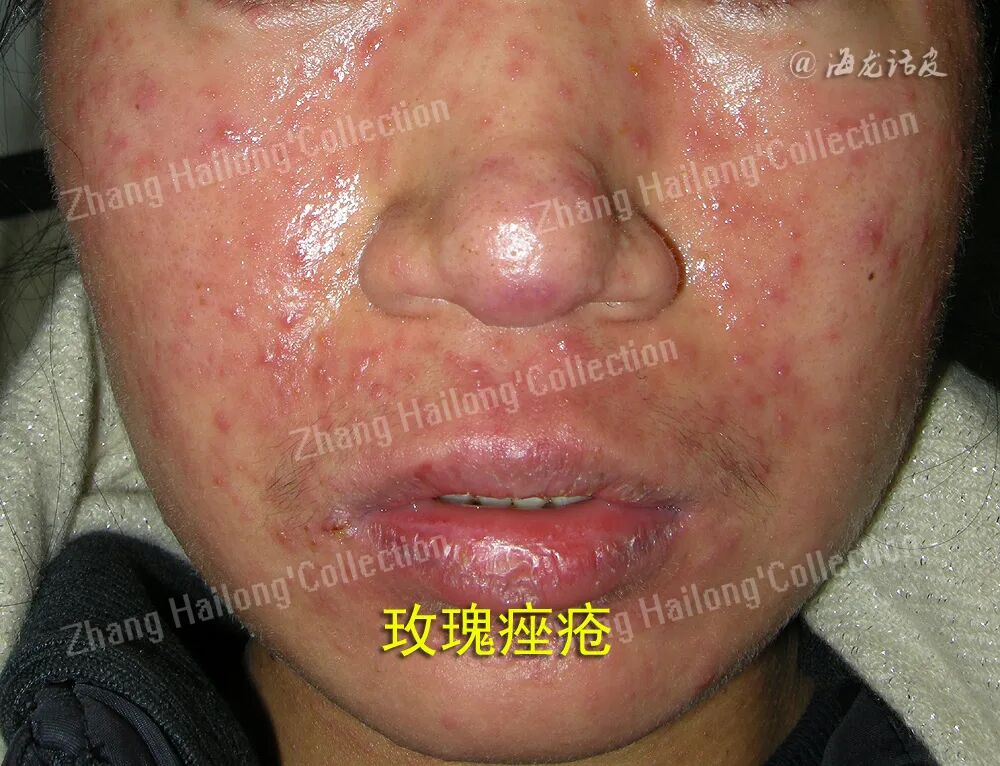
2、UV引起细胞凋亡:
UVB可导致G1期和G2期细胞周期阻滞,因此细胞周期可能在DNA复制(G1/S检查点)或染色体分离(G2/M检查点)之前停止。由于细胞在进行DNA合成时更容易发生凋亡,而KC比黑素细胞增殖更频繁,因此KC更易受到UV的伤害。在UV暴露后,可以在组织学上观察到凋亡KC或晒伤细胞。KC在UV照射后,发生细胞凋亡,出现无法修复的严重DNA损伤,形成晒伤细胞,晒伤细胞和由膜包裹的片段DNA组成凋亡小体,进而被巨噬细胞吞噬清除。这是身体的一种保护机制,能够清除可能有恶性转化风险的细胞,但也可能提高皮肤癌的易感性。
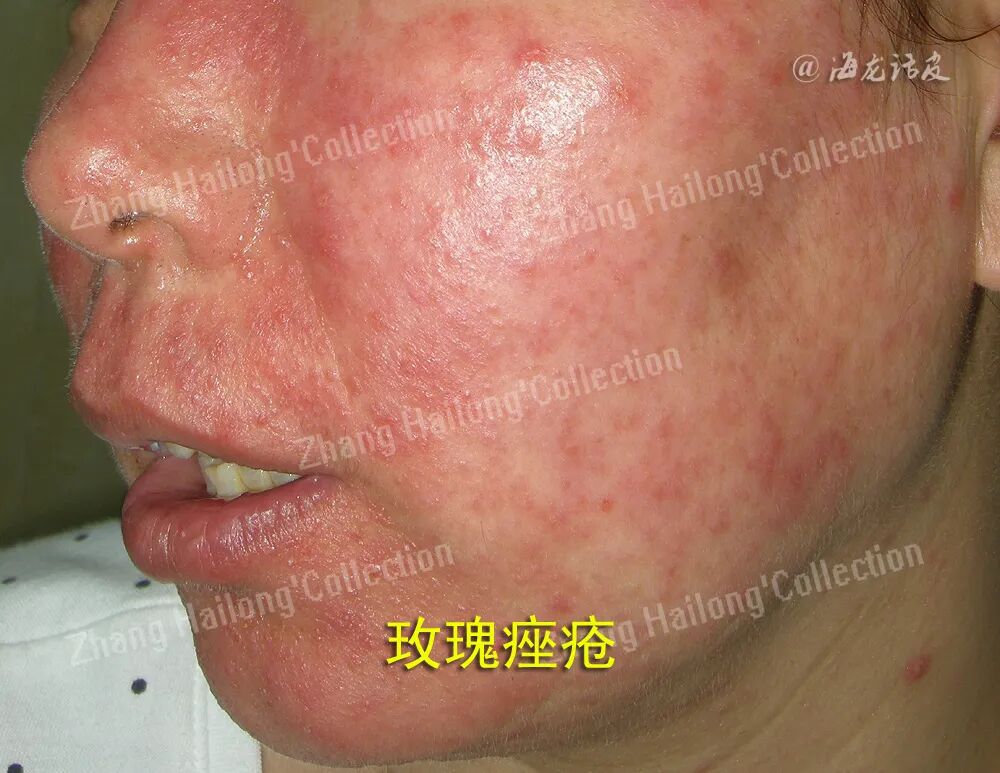
3、UV造成氧化损伤:
分子氧与UV结合产生ROS,包括氧自由基(如超氧阴离子自由基、羟基自由基)和非自由基氧化剂(如过氧化氢和单线态氧)。自由基是原子或具有不成对电子的分子,具有极强的化学反应性,往往引起组织氧化损伤。ROS在细胞中主要由线粒体产生,过量的ROS通过介导炎症信号通路导致线粒体功能障碍和KC的炎症反应,可破坏角质层游离脂质和细胞膜,还可通过直接或间接的方式氧化脂质。受损的脂质膜在活细胞中通过酶促和非酶促反应进行加工,导致应激反应基因的表达或前列腺素的产生,从而介导炎症反应。
4、UV对蛋白质的破坏:
UV对蛋白质的影响不如对DNA和脂质的影响严重,可能是由于皮肤有多种不同的蛋白质,而这些蛋白质处于不断被破坏和重新制造的过程中。然而,皮肤中的蛋白质成分可能被ROS氧化破坏。ROS可破坏胶原蛋白,分解弹性蛋白纤维,导致真皮结构支持和体积减少,使表皮出现皱纹。UV还可以交联真皮中的胶原蛋白、弹性蛋白等蛋白质,导致这些蛋白质被破坏,从而产生皮肤光老化。此外,一些蛋白质是细胞表面受体,UV的吸收可能导致受体聚集和下游通路的变化,继而导致细胞外信号的产生,引起细胞过度活化。
UV在玫瑰痤疮发病过程中的作用
1、UV使LL-37表达增加:
UVB可诱导人体皮肤中维生素D合成,生成的维生素D通过结合位于LL-37基因启动子的功能性维生素D反应元件,快速上调LL-37 表达。LL-37反过来又可加剧UVB的促炎和促血管生成作用,使玫瑰痤疮患者对UV照射更为敏感。UVB辐射通过炎症小体引起白细胞介素(interleukin,IL)-1β的分泌增加,LL-37则作用于KC上的嘌呤能P2X7受体导致细胞内钙浓度增加,进而增强UVB对炎症小体的激活作用,使IL-1β的释放水平升高。增多的IL-1β还能与LL-37协同作用,提高内皮细胞的血管生成潜能。UVB也能促使非编码双链RNA释放,继而上调细胞间黏附分子1(intercellular adhesion molecule1,ICAM1)、血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM1)和E选择素(E-selectin,SELE)等黏附分子以及肿瘤坏死因子(tumour necrosis factor,TNF)、C-X-C基序配体10(C-X-C motif ligand10,CXCL10)、C-C基序趋化因子配体5(C-C motif chemokine ligand 5,CCL5)和干扰素β(interferon beta,IFN-β)等促炎蛋白的表达,进而损伤KC。LL-37能与双链RNA共同作用,从而增加人内皮细胞和小鼠真皮血管上黏附分子和趋化因子的表达。
因此,UVB可促进LL-37表达,而玫瑰痤疮患者中高表达的LL-37又可增加其光敏性。此外,LL-37还能调节白细胞趋化和细胞因子分泌等过程,介导玫瑰痤疮患者皮肤中肥大细胞脱颗粒和炎症介质的释放。LL-37皮下注射可引起小鼠皮肤红斑、血管扩张及炎症细胞浸润等类似于玫瑰痤疮的皮肤反应,因此其在玫瑰痤疮发病机制中具有重要作用。
2、UV促进基质金属蛋白酶的合成:
基质金属蛋白酶(matrix metalloproteinases,MMP)是参与组织重塑、器官发育和炎症过程调节的酶,UV可导致皮肤MMP-1和MMP-9表达增加,从而使细胞外基质中的胶原蛋白降解,并且导致血管周围结构完整性的丧失,继而引起毛细血管增生、 扩张。已证实MMP-1、MMP-3和MMP-9在以红斑毛细血管扩张为主要表现的玫瑰痤疮患者真皮层中表达增加,而MMP-8和MMP-9在以眼炎表现为主的玫瑰痤疮患者泪液中活性增加。此外,玫瑰痤疮患者皮损部位的抗菌肽组织蛋白酶抑制素 (cathelicidin)和激肽释放酶5(kallikrein 5,KLK5)的表达水平均显著高于正常对照。增加的MMP能够通过切割原酶激活 KLK5,也能使无生物学活性的cathelicidin裂解为表皮活性肽形式的LL-37,从而增加LL-37的含量,最终引起玫瑰痤疮的发病。
3、UV诱导血管内皮生长因子表达:
血管内皮生长因子(vascular endothelial growth factor,VEGF)由包括KC在内的多种细胞分泌,能够刺激内皮细胞增殖,从而促进血管生成。此外,VEGF还能诱导内皮型一氧化氮合酶,通过产生更多的一氧化氮而引起血管扩张。VEGF与细胞表面的跨膜酪氨酸激酶受体相互作用发挥其生物学效应,这些受体包括选择性表达在血管内皮细胞上的VEGF受体(VEGF receptor,VEGFR)-1和VEGFR-2,以及表达在神经元和血管内皮细胞上的神经素受体-1和神经素受体-2,其中VEGFR-2是VEGF引起血管生成效应的主要受体。玫瑰痤疮患者的皮肤可出现血流量增加、血管持续扩张、血管高反应性、血管周围炎症浸润、血管通透性增加和血管新生等异常改变。其中,毛细血管前小动脉扩张引起红斑,毛细血管后小静脉扩张导致蛋白质泄漏和免疫细胞募集,进而引起水肿,VEGF在其中起着重要作用。玫瑰痤疮患者皮损部位的VEGF、VEGFR-1和VEGFR-2在表皮和腺上皮中均有表达,也表达于周围浸润的单核细胞中,而真皮层的血管内皮主要表达VEGFR-1和VEGFR-2,鲜有表达VEGF。
另一项研究发现,玫瑰痤疮患者的皮损部位与非皮损部位相比,皮损部位真皮中VEGF的表达显著增加。Hayran等发现玫瑰痤疮患者全血中VEGF基因多态性发生率较健康对照组更高,且以丘疹脓疱或以红斑毛细血管扩张为主要表现的玫瑰痤疮严重程度与VEGF基因+405C/G多态性呈正相关。UVB具有显著的促血管生成特性,在人和小鼠的表皮KC中均可上调VEGF和VEGFR-2的表达。小鼠在暴露于UVB的早期即出现VEGF表达增加,引起急性的光损伤。通过全身或局部的VEGF抗体给药破坏VEGF信号转导,可显著减少急性UVB诱导的水肿、红斑和血管增多。此外,UVB照射会增加IL-1α、IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的表达,而IL-1β可通过p38-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径诱导VEGF表达,TNF-α可通过哺乳动物雷帕霉素靶蛋白途径诱导VEGF表达。因此,UV诱导的VEGF表达升高可能在玫瑰痤疮患者皮肤中的血管生成和红斑形成过程中发挥重要作用。
4、UV引起ROS生成:
UV可直接引起ROS的产生,也可通过降低还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶和环氧合酶(cyclooxygenase,COX)的活性以剂量依赖性方式增加角质形成细胞中ROS的产生,从而引起氧化应激及DNA损伤。MMP抑制剂可由ROS激活MAPK途径后灭活,造成MMP表达上调,皮肤胶原蛋白降解。核因子κB(nuclear factor-κB,NF-κB)也可被ROS以MAPK信号通路激活,继而影响多种炎症细胞因子的生成,并诱导血红素氧合酶-1的合成,间接增加细胞中游离铁的水平,从而通过芬顿反应促进ROS的进一步产生。在以丘疹脓疱为主要表现的玫瑰痤疮患者的毛囊中发现较多的中性粒细胞,而中性粒细胞是炎症过程早期ROS的重要来源。玫瑰痤疮患者的面部皮肤ROS水平明显升高,在玫瑰痤疮小鼠模型中也出现了皮肤ROS水平的升高。因此,UV照射引发了玫瑰痤疮发病过程中氧化和抗氧化途径之间的不平衡。
结语
UV通过影响LL-37、MMP、VEGF和ROS等因子而重塑脉管系统及真皮基质,介导炎症反应,是玫瑰痤疮的发病因素和加重因素。今后需要对UV在玫瑰痤疮发病中的作用机制进行进一步研究,同时研究相应的治疗及防护措施,以提高玫瑰痤疮的治疗效果,降低发病率。
参考文献:
1.谢昱明,胡越,黄俊可,刘娟,张庆.紫外线在玫瑰痤疮发病机制中作用的研究进展[J].中南大学学报(医学版),2025,50(3):396-401.
2.中华医学会皮肤性病学分会玫瑰痤疮研究中心,中国医师协会皮肤科医师分会玫瑰痤疮专业委员会.中国玫瑰痤疮诊疗指南(2021版)[J].中华皮肤科杂志,2021,54(4):279-288.
3..Yu ZW, Zheng M, Fan HY, et al. Ultraviolet (UV) radiation: a double-edged sword in cancer development and therapy[J].Mol Biomed,2024,5(1):49.
4.其他文献略。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)