首页 > 医疗资讯/ 正文
沙门菌(Salmonella)是一种常见的人畜共患革兰阴性杆菌[1],也是全球最重要的食源性病原体之一。目前已鉴定出2600种血清型,主要可分为伤寒沙门菌,甲、乙、丙型副伤寒沙门菌及非伤寒沙门菌。该类病原体可引发胃肠炎、菌血症、败血症和局灶性感染等多种临床表现[2-4]。在非伤寒沙门菌引起的胃肠炎患者中,约5%会发展为肠外侵袭性感染,进而导致菌血症;而伤寒沙门菌感染则常表现为持续性发热和多器官受累,严重时甚至导致死亡[5-6]。美国疾病控制与预防中心数据显示,美国每年约有135万例沙门菌感染病例,其中死亡病例约420例,相关医疗费用高达33亿美元[7],给社会和医疗卫生系统带来了沉重负担。
近年来,沙门菌的耐药水平在全球范围内呈显著上升趋势,尤其在亚洲地区,其多重耐药( MDR)率高达50.96%[8]。随着沙门菌感染的广泛流行及临床抗菌药物的不合理使用,该菌的耐药谱已由MDR逐渐发展为广泛耐药。广泛耐药沙门菌比例的持续攀升显著增加了临床抗感染治疗的难度,并对公共卫生安全构成严重威胁[9-10]。鉴于其日益严峻的耐药形势,世界卫生组织已将其列入细菌优先病原体清单[8,11]。
目前虽然部分研究对特定地区沙门菌的优势血清型及耐药特征进行了监测分析[12-13],但在全国范围内开展的系统性、多区域主动监测研究仍相对有限。本研究收集了我国7大地域、26个省市/自治区、53所医院的沙门菌分离株,并进行多中心系统分析,旨在探讨其在不同性别、年龄、标本类型、科室及地域间的耐药特征,以全面掌握我国沙门菌的耐药现状,并为公共卫生干预和抗菌药物合理使用提供科学依据。
1 资料与方法
1.1 材料
1.1.1 数据来源
本研究为回顾性多中心横断面研究。连续收集2021年1月1日至2022年12月31日,国内7大地域(华北、东北、华东、华中、华南、西南、西北)26个省市/自治区(安徽、北京、重庆、福建、广东、甘肃、海南、河北、河南、黑龙江、湖北、湖南、吉林、江苏、江西、辽宁、内蒙古自治区、宁夏回族自治区、山东、山西、陕西、四川、天津、西藏自治区、新疆维吾尔自治区、云南)的53所医院(三级以上医院52所,二级医院1所)分离获得的非重复沙门菌菌株。
本研究已通过河北医科大学第二医院伦理委员会审批(审批号:2020-R524-01),并豁免患者知情同意。
1.1.2 仪器与试剂
1.1.2.1 仪器
生化培养箱(上海跃进医疗器械有限公司);基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF MS)(青岛融智生物科技有限公司);SAST60全自动药敏分析仪(珠海迪尔生物工程有限公司);数字式浊度计(珠海迪尔生物工程股份有限公司);纯水仪(德国Merck公司);生物安全柜(上海博迅医疗生物仪器股份有限公司);全自动高压蒸汽灭菌仪(日本ALP有限公司)。
1.1.2.2 试剂
质谱裂解液(青岛融智生物科技有限公司);质谱基质液(青岛融智生物科技有限公司);药敏指示剂(珠海迪尔生物工程有限公司);沙门血清(宁波天润有限公司);哥伦比亚血琼脂培养基(济南百博生物技术股份有限公司);肠道菌SS琼脂培养基(温州市康泰生物科技有限公司),所有试剂和材料均在有效期内使用。
1.2 方法
1.2.1 菌株鉴定及血清分型
首先将待复核菌株接种于哥伦比亚血琼脂培养基和/或选择性SS琼脂(沙门菌-志贺菌琼脂)培养基上完成初代培养,继而进行二次传代,并于37 ℃条件下培养18~20 h,获得纯培养单菌落。经质谱复核确认为沙门菌后,所有菌株均依据统一的标准操作程序(SOP)进行血清分型以确定菌种。
具体操作如下:在洁净的载玻片上滴加一滴生理盐水,将待测纯菌落混合于生理盐水水滴内,制备成均一性的混浊悬液,将载玻片轻轻摇动30~60 s后,在黑色背景下观察反应结果。若出现明显菌体凝集颗粒,则该菌株为自凝性,血清学分型无效,记录为“自凝”并结束本操作;若无凝集现象,则采用沙门菌多价血清进行玻片凝集试验,待阳性反应时,再与相应的单价因子(包括沙门菌O单价因子、H单价因子、Vi因子)血清作玻片凝集试验,于1 min内判读结果。根据与单价血清的凝集结果,报告沙门菌的血清分型。
1.2.2 药敏试验
测试抗菌药物共12种,包括氨苄西林(青霉素类)、氨苄西林/舒巴坦(β-内酰胺/酶抑制剂)、环丙沙星(氟喹诺酮类)、左氧氟沙星(氟喹诺酮类)、氯霉素(酰胺醇类)、头孢他啶(头孢菌素类)、头孢曲松(头孢菌素类)、米诺环素(四环素类)、亚胺培南(碳青霉烯类)、美罗培南(碳青霉烯类)、厄他培南(碳青霉烯类)、复方新诺明(磺胺类)。药敏试验及结果判读严格遵循美国临床和实验室标准化协会(CLSI)《药物敏感试验指南M100第34版》进行。质控菌株为大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853。对上述抗菌药物所属的3类及以上类别药物均耐药(每类中至少一种药物耐药)的菌株被判定为MDR菌株[14]。
1.3 统计学处理
采用Excel和SPSS 24.0软件进行统计学分析。分类变量以频数或百分数表示。组间耐药率的比较采用χ2检验或Fisher精确概率法。所有统计分析均为双侧检验,检验水准设定为 α= 0.05,以P<0.05为差异具有统计学意义。鉴于本研究的探索性目的,未进行多重比较校正。
2 结果
2.1 沙门菌流行病学特征
共纳入605株沙门菌菌株。菌株来源方面:粪便519株 (85.8%),血液62株 (10.2%),清洁尿5株 (0.8%),分泌物2株 (0.3%),痰液2株 (0.3%),脑脊液1株(0.2%),支气管肺泡灌洗液1株(0.2%),导管尿1株(0.2%),其他标本12株 (2.0%)。地区分布方面:华中158株 (26.1%),华北119株 (19.7%),西北117株 (19.3%),西南72株 (11.9%),东北51株 (8.4%),华南47株 (7.8%),华东41株 (6.8%)。患者性别方面:男性351例 (58.0%),女性254例 (42.0%)。患者年龄方面:0~5岁311例 (51.4%),6~17岁44例 (7.3%),18~65岁191例 (31.6%),>65岁59例 (9.7%)。
2.2 沙门菌血清分型及其标本类型
2.2.1 血清型分布特征
605株沙门菌中,597株鉴定出血清型,共鉴定出42种血清型分属于5个群,其中B群占比最高(43.6%),D群占比次之(35.4%),C群占比13.4%,E群和A群占比较少,分别为5.6%和0.7%,42个血清型中鼠伤寒沙门菌占比最高,达37.7%,为全国地区优势血清型,其次为肠炎沙门菌,占比34.0%(表1)。
表1 605株沙门菌血清型及血清群分布情况

2.2.2 不同血清型沙门菌的标本类型分布
605株沙门菌中,分离自血液标本62株,脑脊液1株,支气管肺泡灌洗液1株,导管尿1株,整体侵袭性感染率为10.7%(65/605)。进一步按血清型分析来源分布发现:肠炎沙门菌主要来源于粪便标本(72.3%, 149/206)和血液标本(21.4%, 44/206);鼠伤寒沙门菌(98.2%, 224/228)和其他血清型(85.4%, 146/171)沙门菌主要来源于粪便标本;值得注意的是,4株甲型副伤寒沙门菌中有3株分离自血液标本。
2.3 沙门菌耐药特征
2.3.1 总体耐药特征
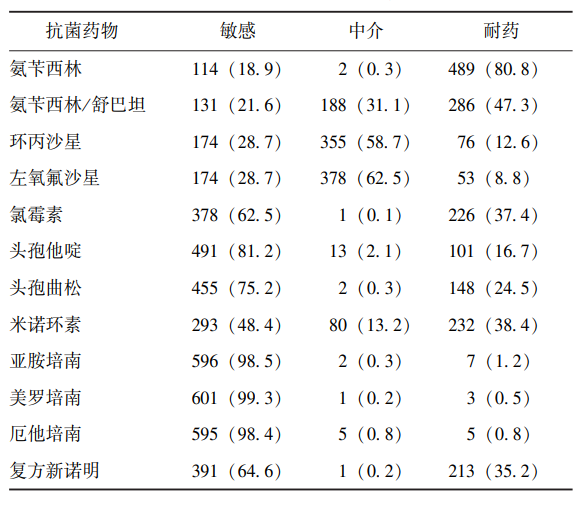
605株沙门菌对氨苄西林的耐药率最高(80.8%),其次是氨苄西林/舒巴坦(47.3%)、米诺环素(38.4%)和氯霉素(37.4%),而左氧氟沙星(8.8%)、亚胺培南(1.2%)、厄他培南(0.8%)、美罗培南(0.5%)的耐药率均<10%(表2)。
表2 605株沙门菌菌株药敏试验结果[n(%)]
2.3.2 沙门菌不同血清型的耐药分布特征
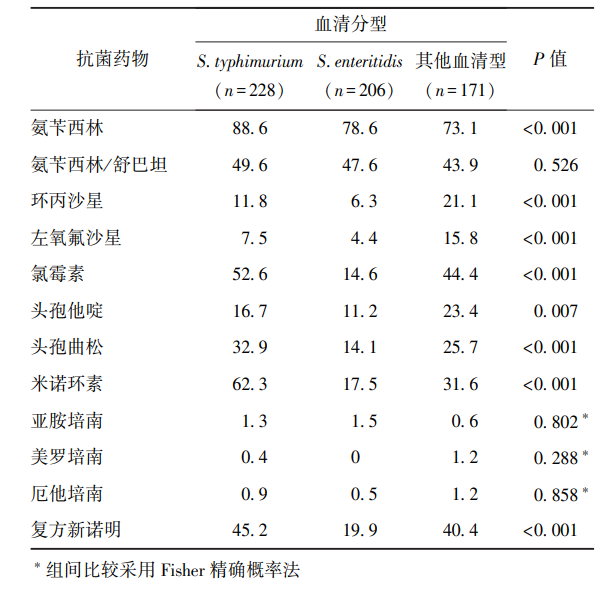
鼠伤寒沙门菌、肠炎沙门菌以及其他血清型沙门菌对氨苄西林、环丙沙星、左氧氟沙星、氯霉素、头孢他啶、头孢曲松、米诺环素、复方新诺明的耐药性均具有统计学差异(P均<0.05),鼠伤寒沙门菌对上述抗菌药物耐药率均高于肠炎沙门菌(表3)。
表3 鼠伤寒沙门菌、肠炎沙门菌以及其他血清型沙门菌对抗菌药物耐药率比较(%)
除斯坦利沙门菌、韦太夫雷登沙门菌、乙型副伤寒沙门菌、巴尔多沙门菌、圣保罗沙门菌外,其余均对1种及以上的抗菌药物具有较高的耐药性(图1)。
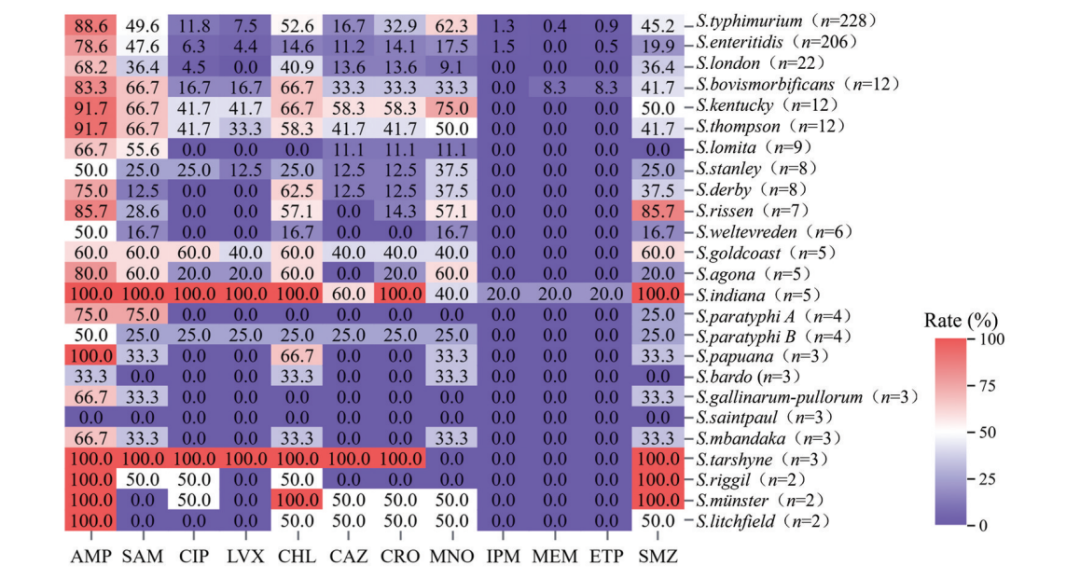
图1 不同血清型沙门菌对抗菌药物的耐药热图
AMP:氨苄西林;SAM:氨苄西林/舒巴坦;CIP:环丙沙星;LVX:左氧氟沙星;CHL:氯霉素;CAZ:头孢他啶;CRO:头孢曲松;MNO:米诺环素;IPM:亚胺培南;MEM:美罗培南;ETP:厄他培南;SMZ:复方新诺明
2.3.3 沙门菌耐药特征与分离患者年龄及性别的关系
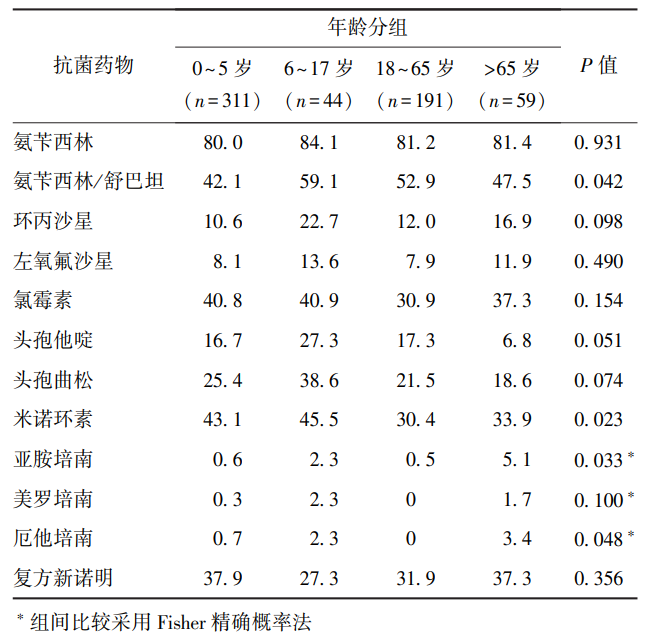
沙门菌对氨苄西林/舒巴坦、米诺环素、亚胺培南、厄他培南在不同年龄阶段的耐药性差异均有统计学意义(P均<0.05)。6~17岁人群分离株对氨苄西林/舒巴坦(59.1%)和米诺环素(45.5%)的耐药率较高,65岁以上人群分离株对亚胺培南(5.1%)和厄他培南(3.4%)的耐药率较高(表4)。患者性别与各抗菌药物耐药性关联无统计学意义(P>0.05)。
表4 不同年龄分组中沙门菌的耐药率比较(%)
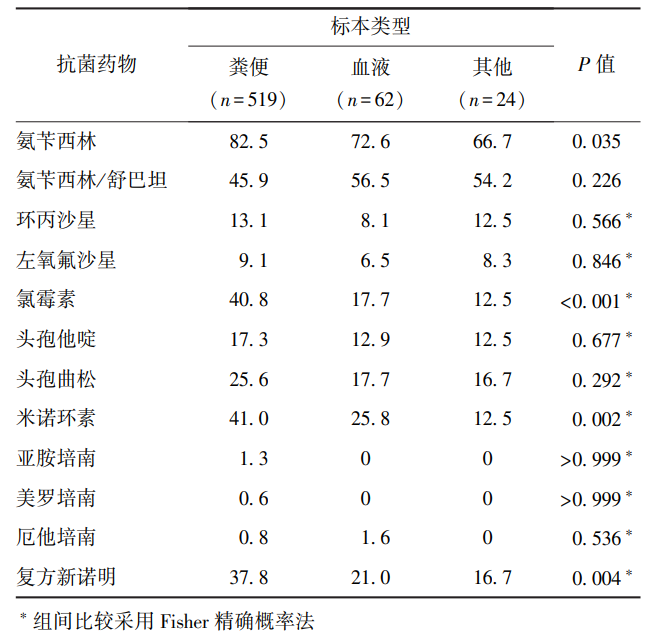
2.3.4 沙门菌耐药特征与标本类型的关系
不同标本类型的沙门菌对氨苄西林、氯霉素、米诺环素、复方新诺明的耐药性存在显著差异(P均<0.05)。粪便标本分离菌株对氨苄西林(82.5%)、氯霉素(40.8%)、米诺环素(41.0%)、复方新诺明(37.8%)的耐药率最高(表5)。
表5 不同标本类型分离的沙门菌耐药率比较(%)
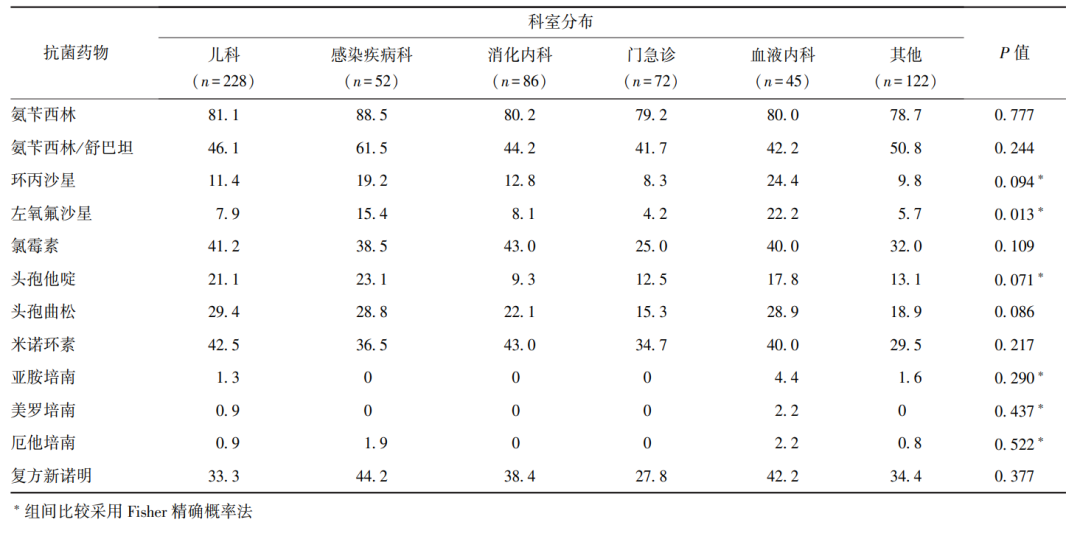
2.3.5 沙门菌耐药特征与分离科室的关系
不同科室分离的沙门菌对左氧氟沙星的耐药性差异具有统计学意义(P<0.05),血液内科来源沙门菌对左氧氟沙星的耐药率最高(22.2%)(表6)。
表6 不同科室分离的沙门菌耐药率比较(%)
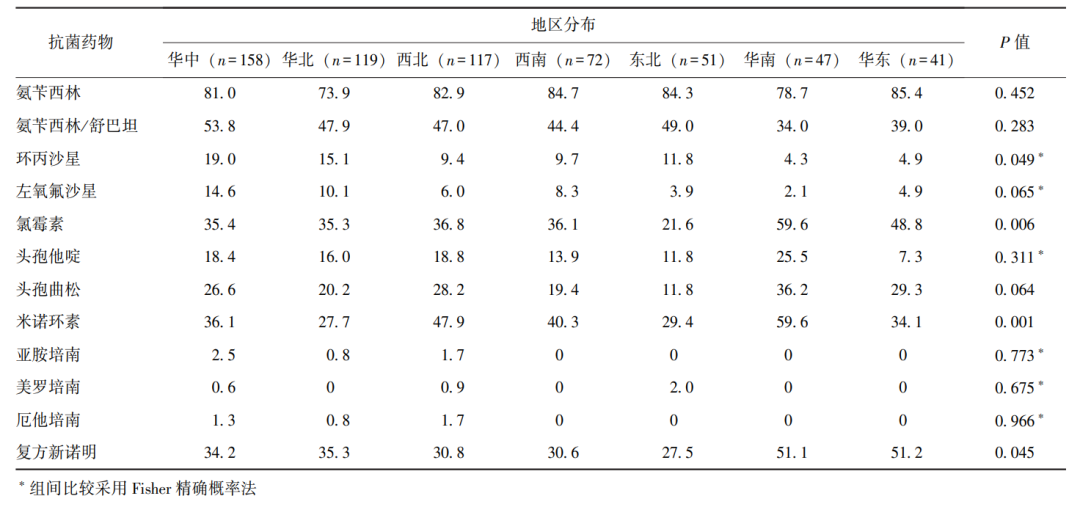
2.3.6 沙门菌耐药特征与分离区域的关系
不同地理区域分离的菌株对环丙沙星、氯霉素和米诺环素、复方新诺明的耐药性均有统计学差异(P均<0.05),其中华中地区分离菌株对环丙沙星耐药率最高(19.0%),华南地区分离菌株对氯霉素(59.6%)和米诺环素(59.6%)耐药率最高,华东地区分离菌株对复方新诺明的耐药率最高(51.2%)(表7)。
表7 不同地区分离的沙门菌耐药率比较(%)
2.3.7 沙门菌的MDR特征
271株沙门菌为MDR(44.8%),MDR模式共48种,其中包含青霉素类(A)的MDR模式46种,数量最多的一种MDR模式为青霉素类(A)+酰胺醇类(F)+四环素类(G)+磺胺类(H),占比为15.9%(表8)。
表8 沙门菌多重耐药模式

3 讨论
急性腹泻是我国重要的公共卫生问题,沙门菌作为急性腹泻的主要病原体之一,尤其对于5岁以下儿童具有更高的感染风险和更严重的临床表现[15]。本研究中来源于5岁以下患儿标本的占比最高,达51.4%(311/605),可能与该年龄段儿童免疫系统发育尚未完善、对病原体易感性较高有关[16-17]。临床工作中应特别重视5岁以下儿童的沙门菌感染监测管理,以提升针对该人群的早期诊断能力和防范意识。
沙门菌作为典型的粪-口传播病原体,其流行病学特征已被广泛证实[18]。本研究基于全国多中心临床分离株分析发现,粪便来源的菌株占比高达85.8%(519/605),进一步证实了其主要经消化道传播的特点。因此,沙门菌耐药监测体系应将粪便来源菌株作为重点监测对象,以便精准追踪感染传播扩散轨迹。
鼠伤寒沙门菌是全国范围内的优势血清型之一,这一分布特征与多项研究结果一致[19-20]。其流行与抗菌药物滥用、耐药基因水平转移、基因突变等多种机制密切相关。目前,该血清型已进化为兼具强致病性和MDR的全球性病原体[21]。因此,建立针对鼠伤寒沙门菌的耐药监测网络,并规范抗菌药物使用,对于遏制该菌株的传播具有重要意义。
本研究对总体沙门菌耐药性监测显示,沙门菌对氨苄西林的耐药率高达80.8%(489/605),与国内外多项研究结果类似[22-25]。早在20世纪50年代末,欧洲就已出现由耐氨苄青霉素沙门菌引发的疾病暴发事件[26],目前,氨苄西林已不再作为临床治疗沙门菌感染的经验用药[27]。值得注意的是,碳青霉烯类药物耐药率仍然较低,MDR沙门菌可选用碳青霉烯类抗菌药物进行治疗[28],然而,常用药物如复方新诺明、氯霉素的耐药率仍处于较高水平,提示亟需建立完善的耐药监测体系,并加快开发新型抗菌药物,以应对日益严峻的耐药挑战。
本研究在鼠伤寒沙门菌和肠炎沙门菌以及其他血清型沙门菌对抗菌药物的耐药分析中,鼠伤寒沙门菌对氨苄西林、环丙沙星、左氧氟沙星、氯霉素、头孢他啶、头孢曲松、米诺环素及复方新诺明的耐药率均高于肠炎沙门菌。进一步分析发现,不同血清型沙门菌的耐药表型存在差异,提示在临床治疗和公共卫生监测中,可建立根据血清型分类的特异性耐药监测网络,并优化对高耐药血清型如鼠伤寒沙门菌的抗菌药物使用策略。
本研究中分离的印第安纳沙门菌对氨苄西林、氨苄西林/舒巴坦、环丙沙星、左氧氟沙星、氯霉素和复方新诺明均表现出耐药性(图1)。多项研究表明,该血清型沙门菌具有显著的MDR特征,尤其对四环素类、喹诺酮类、磺胺类、酰胺醇类及青霉素类等抗菌药物普遍存在耐药性[29-32]。尽管印第安纳沙门菌的致病性较鼠伤寒沙门菌和肠炎沙门菌低[33],但其MDR特性已成为公共卫生的严峻挑战,必须高度重视该血清型沙门菌的流行趋势及其耐药性演变,以制订有效的防控策略。
本研究结果显示,除氨苄西林/舒巴坦外,粪便来源沙门菌的耐药率普遍高于血液来源菌株,与广州地区儿童沙门菌感染研究报道一致[24],究其原因,可能与沙门菌在肠道微环境中更易通过质粒、转座子等可移动遗传元件发生耐药基因的水平转移有关[34]。此外,肠道局部免疫屏障较血液系统清除能力更弱,为细菌定植和耐药性转移提供了有利条件[35-36]。
本研究中沙门菌的MDR率为44.8%(271/605),整体呈现较严重的MDR现象,但略低于既往对湖南、上海等地的研究结果[12,37-38]。在临床实践中,针对MDR沙门菌感染,可考虑采用新型抗菌药物或联合益生菌等辅助治疗手段[39-41],以提高治疗效果并减少耐药性发展。
各地区沙门菌耐药性差异可能由抗菌药物使用、经济水平及流行情况等共同作用所致。针对这一现象,建议华中地区重点监管氟喹诺酮类药物的使用,华南地区应特别关注酰胺醇类和四环素类药物的耐药情况,华东地区则应重点关注磺胺类药物的耐药情况。同时,各地区均应持续完善沙门菌耐药性监测体系,为临床合理用药提供科学依据。
4 小结
我国临床分离沙门菌的血清型分布多样,以鼠伤寒沙门菌和肠炎沙门菌为主要优势型别,且整体耐药水平较高,MDR现象普遍。不同年龄、标本类型、科室及地区来源的菌株对常用抗菌药物的耐药率存在差异,临床应依据药敏结果合理选用抗菌药物,以减缓耐药性发展。
参考文献
[1]Qamar F N, Hussain W, Qureshi S. Salmonellosis including enteric fever[J]. Pediatr Clin North Am, 2022, 69(1): 65-77.
[2]Ferrari R G, Rosario D K A, Cunha-Neto A, et al. Worldwide epidemiology of Salmonella serovars in animal-based foods: a meta-analysis[J]. Appl Environ Microbiol, 2019, 85(14): e00591-19.
[3]Lu J E, Wu H, Wu S B, et al. Salmonella: infection mechanism and control strategies[J]. Microbiol Res, 2025, 292: 128013.
[4]Chen Z, Toro M, Moreno-Switt A I, et al. Unveiling the genomic landscape of Salmonella enterica serotypes Typhimurium, Newport, and Infantis in Latin American surface waters: a comparative analysis[J]. Microbiol Spectr, 2024, 12(5): e0004724.
[5]Dhanoa A, Fatt Q K. Non-typhoidal Salmonella bacterae-mia: epidemiology, clinical characteristics and its' associa-tion with severe immunosuppression[J]. Ann Clin Microbiol Antimicrob, 2009, 8: 15.
[6]Meiring J E, Khanam F, Basnyat B, et al. Typhoid fever[J]. Nat Rev Dis Primers, 2023, 9(1): 71.
[7]Lamichhane B, Mawad A M M, Saleh M, et al. Salmonellosis: an overview of epidemiology, pathogenesis, and innovative approaches to mitigate the antimicrobial resistant infections[J]. Antibiotics (Basel), 2024, 13(1): 76.
[8]Wang Y N, Xu X B, Jia S L, et al. A global atlas and drivers of antimicrobial resistance in Salmonella during 1900—2023[J]. Nat Commun, 2025, 16(1): 4611.
[9]Chaudhari R, Singh K, Kodgire P. Biochemical and molecular mechanisms of antibiotic resistance in Salmonella spp.[J]. Res Microbiol, 2023, 174(1/2): 103985.
[10]Wu J T, You L, Liu Y M, et al. Dynamic serotype distribution and antimicrobial resistance of Salmonella isolates from 2019 to 2023 in Guizhou, China[J]. Infect Drug Resist, 2025, 18: 993-1006.
[11]Jesudason T. WHO publishes updated list of bacterial priority pathogens[J]. Lancet Microbe, 2024, 5(9): 100940.
[12]王小龙, 邹文燕, 朱莉勤, 等. 苏州市沙门氏菌血清型、耐药及多位点序列分型分析[J]. 微生物学通报, 2024, 51(10): 4245-4256.
[13]徐礼扬, 仝志琴, 李会, 等. 2017—2021年河南省洛阳市腹泻患者沙门氏菌血清型分布及耐药与分子分型研究[J]. 现代疾病预防控制, 2023, 34(5): 345-349.
[14]Khor W B, Lakshminarayanan R, Periayah M H, et al. The antibiotic resistance profiles of Pseudomonas aeruginosa in the Asia Cornea Society Infectious Keratitis Study[J]. Int Ophthalmol, 2024, 44(1): 361.
[15]Zhu X H, Tian L, Cheng Z J, et al. Viral and bacterial etiology of acute diarrhea among children under 5 years of age in Wuhan, China[J]. Chin Med J (Engl), 2016, 129(16): 1939-1944.
[16]陈建, 张金金, 杨虹, 等. 深圳市腹泻患者沙门菌感染状况和耐药性分析[J]. 中国人兽共患病学报, 2018, 34(6): 532-536.
[17]Tian L, Zhu X H, Chen Z J, et al. Characteristics of bacterial pathogens associated with acute diarrhea in children under 5 years of age: a hospital-based cross-pal study[J]. BMC Infect Dis, 2016, 16: 253.
[18]Sachu A. Prevalence and antimicrobial susceptibility pattern of Salmonella and Shigella in stool among patients presenting with diarrhea in a tertiary care centre in South India[J]. Iran J Microbiol, 2023, 15(2): 236-242.
[19]Wang Y N, Liu Y, Lyu N, et al. The temporal dynamics of antimicrobial-resistant Salmonella enterica and predominant serovars in China[J]. Natl Sci Rev, 2022, 10(3): nwac269.
[20]Xiao L L, Qin X J, Xiao H, et al. Molecular epidemiological investigation of Salmonella isolated from the environment, animals, foods and patients in China[J]. Food Res Int, 2024, 196: 115013.
[21]Sun R Y, Fang L X, Dai J J, et al. Antimicrobial resistance and population genomics of emerging multidrug-resistant Salmonella 4,[5],12:i:- in Guangdong, China[J]. mSystems, 2024, 9(6): e0116423.
[22]Mai Q D, Lai W M, Deng W Y, et al. Prevalence, serotypes and antimicrobial resistance of Salmonella isolated from children in Guangzhou, China, 2018—2023[J]. Infect Drug Resist, 2024, 17: 4511-4520.
[23]Peruzy M F, Murru N, Carullo M R, et al. Antibiotic-resistant Salmonella circulation in the human population in Campania region (2010—2023)[J]. Antibiotics (Basel), 2025, 14(2): 189.
[24]Gao F, Huang Z T, Xiong Z L, et al. Prevalence, serotype, and antimicrobial resistance profiles of children infected with Salmonella in Guangzhou, southern China, 2016—2021[J]. Front Pediatr, 2023, 11: 1077158.
[25]Chiou C S, Chen B H, Lauderdale T L, et al. Epidemiological trends and antimicrobial resistance in Salmonella enterica serovar Typhimurium clones in Taiwan between 2004 and 2019[J]. J Glob Antimicrob Resist, 2023, 35: 128-136.
[26]Tran-Dien A, Le Hello S, Bouchier C, et al. Early transmissible ampicillin resistance in zoonotic Salmonella enterica serotype Typhimurium in the late 1950s: a retrospective, whole-genome sequencing study[J]. Lancet Infect Dis, 2018, 18(2): 207-214.
[27]陈玲, 陈小丽, 吴佳音, 等. 小儿沙门菌感染临床特点及耐药性分析[J]. 中国当代儿科杂志, 2018, 20(11): 921-924.
[28]石国露, 李中跃. 儿童非伤寒沙门菌感染临床特征及抗生素治疗进展[J]. 中华实用儿科临床杂志, 2020, 35(11): 874-877.
[29]Zhang Z F, Chang J, Xu X B, et al. Phylogenomic analysis of Salmonella enterica serovar Indiana ST17, an emerging multidrug-resistant clone in China[J]. Microbiol Spectr, 2022, 10(4): e0011522.
[30]Lu Y, Zhao H Y, Liu Y Q, et al. Characterization of quinolone resistance in Salmonella enterica serovar Indiana from chickens in China[J]. Poult Sci, 2015, 94(3): 454-460.
[31]Lu Y, Zhao H Y, Sun J, et al. Characterization of multidrug-resistant Salmonella enterica serovars Indiana and Enteritidis from chickens in Eastern China[J]. PLoS One, 2014, 9(5): e96050.
[32]Du P C, Liu X B, Liu Y, et al. Dynamics of antimicrobial resistance and genomic epidemiology of multidrug-resistant Salmonella enterica serovar Indiana ST17 from 2006 to 2017 in China[J]. mSystems, 2022, 7(4): e0025322.
[33]Wang X F, Xu H H, Wang Y, et al. Systematic evaluation of potential pathogenicity of Salmonella Indiana[J]. Vet Microbiol, 2020, 247: 108759.
[34]Yan J, Doublet B, Wiedemann A. Trends in horizontal gene transfer research in Salmonella antimicrobial resistance: a bibliometric analysis[J]. Front Microbiol, 2024, 15: 1439664.
[35]Deng L, Wang S H. Colonization resistance: the role of gut microbiota in preventing Salmonella invasion and infection[J]. Gut Microbes, 2024, 16(1): 2424914.
[36]Holmes CL, Albin OR, Mobley HLT, et al. Bloodstream infections: mechanisms of pathogenesis and opportunities for intervention[J]. Nat Rev Microbiol, 2025,23(4):210-224.
[37]骆玲飞, 刘芸, 王小光. 上海市闵行区293株沙门菌血清型分布及耐药分析[J]. 中国卫生检验杂志, 2022, 32(18): 2222-2228.
[38]刘方, 王岚, 湛志飞, 等. 湖南省815株沙门菌血清型和耐药性分析[J]. 预防医学, 2023, 35(2): 134-136.
[39]Naveed M, Wang Y D, Yin X, et al. Purification, characterization and bactericidal action of lysozyme, isolated from Bacillus subtillis BSN314: a disintegrating effect of lysozyme on gram-positive and gram-negative bacteria[J]. Molecules, 2023, 28(3): 1058.
[40]Siddique A, Azim S, Ali A, et al. Lactobacillus reuteri and Enterococcus faecium from poultry gut reduce mucin adhesion and biofilm formation of cephalosporin and fluoroquinolone-resistant Salmonella enterica[J]. Animals (Basel), 2021, 11(12): 3435.
[41]Chou S H, Wan T W, Shiau C W, et al. Repurposing the tyrosine kinase inhibitor nilotinib for use against intracellular multidrug-resistant Salmonella Typhimurium[J]. J Microbiol Immunol Infect, 2023, 56(3): 490-498.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)