首页 > 医疗资讯/ 正文
胰腺导管腺癌(PDAC)是临床上预后极差的恶性肿瘤,传统预后评估主要依赖TNM分期,但其对患者个体化预后预测能力有限。PDAC的肿瘤微环境(TME)具有显著的脱分化纤维化反应,形成实体瘤物理屏障,阻碍免疫细胞浸润及药物渗透,导致治疗效果不佳。近年来,肿瘤浸润淋巴细胞(TIL)作为多种实体瘤的重要预后生物标志物受到关注,尤其是CD8+细胞的浸润密度与患者生存显著相关,但传统手动评估耗时且主观性强,限制了临床推广。空间免疫组学技术的发展为揭示TIL与肿瘤空间分布提供新思路,但PDAC中相关研究尚未系统开展,尤其缺乏统一且高效的分析工具。

本研究首次采用人工智能(AI)辅助全切片图像分析技术,精准量化PDAC的TILs空间分布,并基于TIL密度将肿瘤免疫表型(IP)分为免疫炎症型(IIP)、免疫排斥型(IEP)和免疫荒漠型(IDP),系统评估其与患者生存期的关联。结果显示,IIP患者生存时间最长,IDP患者预后最差,且高的肿瘤内TIL密度显著关联整体生存期(OS)和无复发生存期(RFS)的延长,提示AI辅助空间TIL分析有望成为PDAC术后预后评估的实用、可推广的生物标志物。
研究人员纳入2017年1月至2020年12月在韩国三星医疗中心接受R0切除的304例PDAC患者。利用AI驱动的全切片图像分析软件Lunit SCOPE IO对术后传统苏木精-伊红(H&E)染色切片进行空间TIL密度定量,自动区分肿瘤细胞区和间质区,识别TIL,进而计算肿瘤内及间质TIL密度,并根据空间分布特征将患者分为IIP、IEP和IDP三种免疫表型。研究对比三组患者的整体生存期(OS)和无复发生存期(RFS),结合临床病理信息进行多变量Cox回归分析,评估免疫表型的独立预后价值。为探究免疫细胞亚群特征,利用TCGA胰腺癌基因表达数据通过CIBERSORTx算法分析免疫细胞组成及免疫细胞毒活性。
结果显示,304例患者平均年龄66.8岁,男性占56.3%,临床I期占54.3%,II期占45.7%。TILs主要分布于间质区,中位间质TIL密度为734.88/mm²,肿瘤内TIL密度较低(中位100.64/mm²)。基于空间TIL分布,免疫排斥型(IEP)占85.2%,免疫炎症型(IIP)占9.9%,免疫荒漠型(IDP)占4.9%。生存分析显示,IIP组患者OS和RFS均未达到中位数,显著优于IEP和IDP组(P<0.001)。
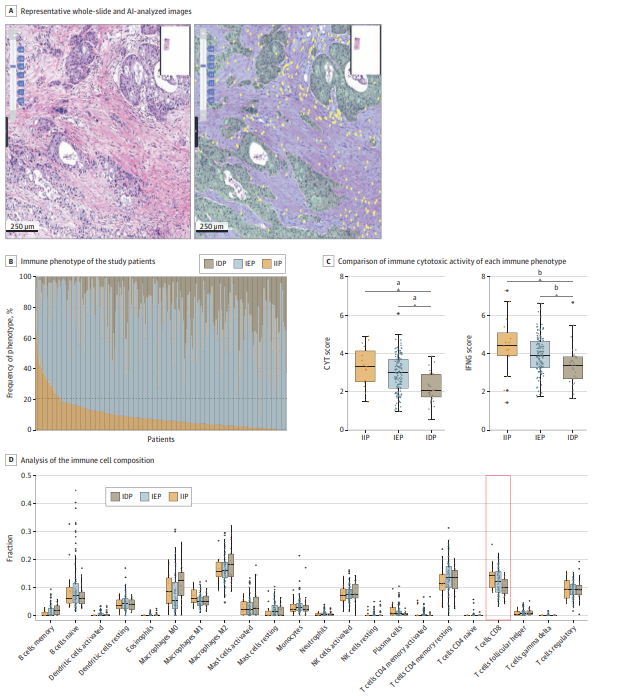
图:免疫表型分布及肿瘤浸润淋巴细胞
肿瘤内TIL高密度患者(最高四分位)OS中位数52.47个月,显著长于其他患者(32.83个月,P=0.004),RFS中位数也显著延长。多变量分析显示,免疫荒漠型患者死亡风险最高(OS风险比5.02),免疫排斥型次之(风险比2.41),免疫炎症型预后最佳。结合病理分期分析,II期免疫炎症型患者生存优于I期非炎症型患者,提示免疫表型与传统分期联合使用可优化预后评估。
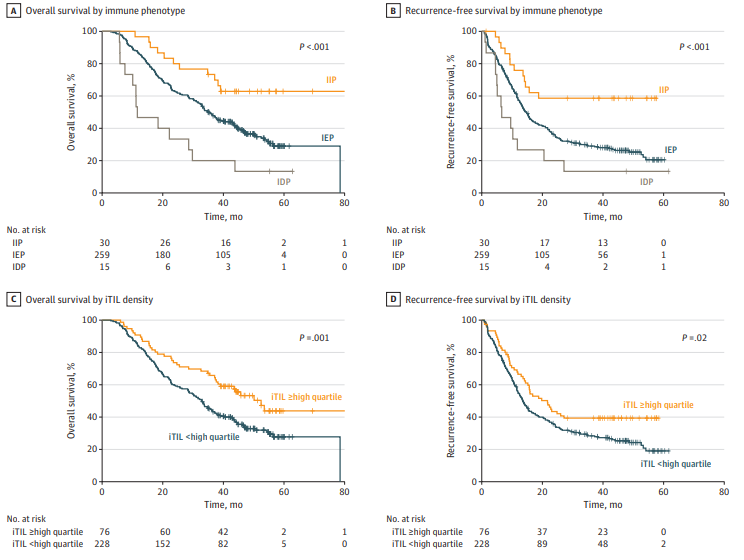
图:Kaplan-Meier分析结果图
综上,本研究首次利用AI实现对胰腺癌术后肿瘤切片中TIL空间分布的高效、自动化分析,显著简化传统人工TIL评估的繁复工作,避免主观差异,提升评估一致性。免疫炎症型表型对应肿瘤微环境中有效的免疫细胞浸润,显著改善患者生存,反映肿瘤免疫状态对预后的重要作用。该技术仅需常规H&E染色切片,无需额外免疫组化,具备良好的临床可操作性。未来,结合免疫表型进行个体化治疗决策,尤其是在术后辅助治疗方案选择及免疫治疗适应症评估中具有潜在价值。
原始出处
Kim H, Choi JH, Lim Y, et al. Artificial Intelligence-Powered Spatial Analysis of Immune Phenotypes in Resected Pancreatic Cancer. JAMA Surg. 2025;160(8):884-892. doi:10.1001/jamasurg.2025.1999
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)