首页 > 医疗资讯/ 正文
急性淋巴细胞白血病(ALL)是一种起源于骨髓和髓外部位的淋系祖细胞疾病。尽管急性淋巴细胞白血病是儿童中最常见的肿瘤类型,但从整体上看,它仍是一种罕见疾病。目前的治疗主要依靠为期2至3年的多药化疗,儿童患者的长期生存率可达80%至90%,而成人患者的长期生存率则为40%至50%。
儿童患者和成人患者在治疗结果上的差异是由多种因素导致的。成人患者常常伴有其他疾病,导致对强化化疗的耐受性较差。此外,成人患者更常表现出高危疾病特征,例如不良的遗传亚型以及表观遗传修饰因子的更多改变,因此更容易对化疗产生耐药性,导致治疗反应率较低以及复发率较高。相比之下,儿童患者的细胞遗传学和分子异常更“有利”(如超二倍体、ETV6::RUNX1易位/t(12;21)),并且具有较少的侵袭性特征(如BCR::ABL1样表型的发生率较低)。此外,儿童患者对治疗的耐受性更好,药物代谢也更佳,因此与成人相比能够实现更高的总体药物剂量强度。这些差异表明,需要为成人患者设计创新的治愈性治疗方案。
在过去十年中,对疾病发病机制的更深入了解导致新疗法的发展,伴随疾病预后的改善和根据风险调整治疗的利用,导致了总体预后的改善。例如,费城染色体(Ph)阳性B细胞ALL的预后曾极差,后随着TKI、贝林妥欧单抗、奥加伊妥珠单抗等新药的使用,5年生存率可达80%以上。对于Ph阴性B细胞ALL,能够接受治疗的患者的4年生存率也提高至80%至85%。对于T细胞ALL,异基因造血干细胞移植和BCL2抑制剂也改善了患者预后,生存率达70%。此外,成熟B细胞ALL和前体B细胞ALL的生存率也达到80%。
《American Journal of Hematology》近日发表综述,MD安德森癌症中心Hagop Kantarjian 和Elias Jabbour教授阐述了成人ALL诊断、治疗和监测的最新内容。因内容过多,分为两部分发表,目前为上半部分,包括临床表现、诊断评估、形态学和免疫表型、细胞遗传学和基因组分类以及费城染色体阳性ALL的治疗。下半部分包含费城染色体阴性ALL及特殊情况、MRD监测、挽救治疗。

临床表现
ALL患者可能会出现各种非特异性体征和症状。例如,患者可能会出现全身症状(发热、夜间盗汗、不明原因的体重减轻)、感染、容易出血/瘀伤、呼吸困难和/或疲劳。在体格检查中,患者可能会因血细胞减少而出现瘀点、面色苍白或瘀斑。儿童患者可能会因白血病细胞浸润关节囊或关节液而出现四肢和关节疼痛,此外,幼儿还可能出现发育里程碑倒退(例如,走路能力下降)。与急性髓系白血病(AML)不同,白血病细胞在血管内异常聚集和凝集的白血病淤滞现象在ALL中较为罕见,即使在严重白细胞增多的情况下也是如此;可能是因为淋巴母细胞相对较小且黏性较低,与髓母细胞相比差异明显。
髓外疾病较为常见。大约20%的患者在诊断时会出现脾大和/或肝大,这是由于器官被白血病细胞浸润所致。其他豁免部位包括睾丸和中枢神经系统(CNS)。纵隔是T细胞ALL患者的常见髓外部位。值得注意的是,成熟B细胞ALL(Burkitt病)患者可能会出现广泛的淋巴结肿大,尤其是在腹部,并且在治疗开始之前就存在高风险的肿瘤溶解综合征和急性肾损伤。在最初存在CNS受累的患者中,5%至8%的患者会出现颅神经病变和脑膜浸润。大约40%至50%的Burkitt样ALL患者可能会存在下巴、下唇以及颊黏膜和牙龈黏膜麻木;这是一种感觉神经病变,是由于下颌骨髓腔扩张压迫(或直接累及)三叉神经的下牙槽分支所致。
诊断评估
ALL的诊断需要骨髓中淋巴母细胞的比例≥20%。进一步的关键评估包括多参数流式细胞术(MFC)免疫表型分析,以正确识别B细胞系或T细胞系疾病(下表)。B细胞ALL更为常见,占成人病例的75%至80%。还应进行细胞遗传学和分子分析,以检测费城染色体[Ph,t(9;22)]及其他细胞遗传学异常的存在,以便进行正确的风险分层。
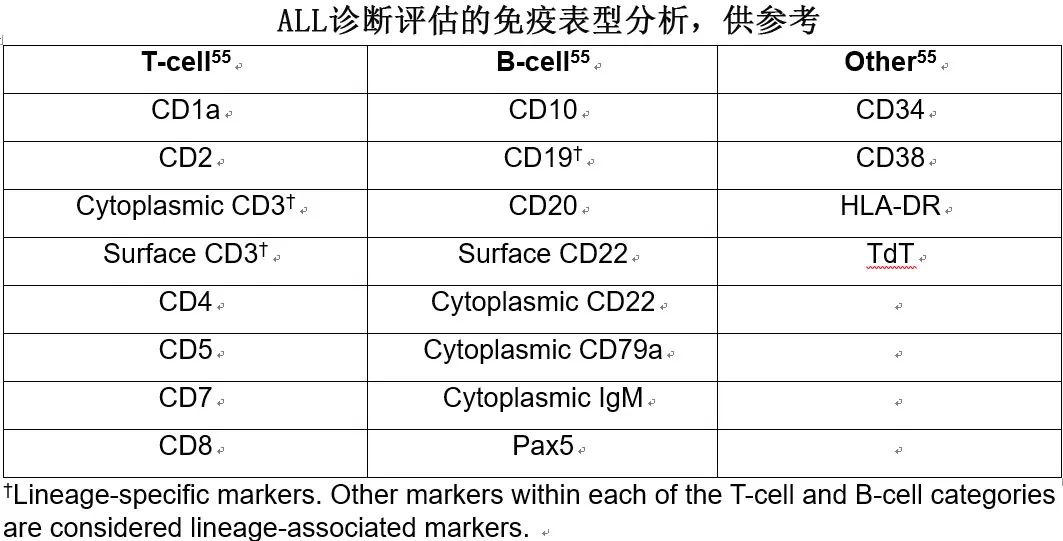
形态学和免疫表型
WHO血液和淋巴肿瘤分类第5版(WHO-HAEM5)将B细胞ALL定义为一种前体B细胞系肿瘤,其特征包括淋巴母细胞表达CD19、CD22、CD79a和/或PAX5,同时表达未成熟标志物,包括TdT和CD34,并且缺乏表面免疫球蛋白的表达。WHO-HAEM5对B细胞ALL的分类优先识别表1总结的定义性遗传改变。当无法检测到常见遗传改变时,诊断将归为B细胞ALL,非特指型(NOS)。最常见的B细胞ALL类型包括超二倍体、低二倍体以及具有已知遗传驱动因素的类型,例如iAMP21、BCR::ABL1、KMT2A重排或特定融合基因。WHO-HAEM5新增的实体包括B细胞ALL伴TCF3::HLF,由于其具有侵袭性的临床过程,因此与类似的TCF3::PBX1融合分开归类;以及B细胞ALL伴ETV6::RUNX1样特征,其与ETV6::RUNX1 B细胞ALL具有共同特征。此外,WHO-HAEM5还对具有其他已定义遗传改变的B细胞ALL进行分类,这些改变代表临时的生物学B细胞ALL类型。

髓系肿瘤和急性白血病的国际共识分类(ICC)分为23种B细胞ALL亚型,而WHO仅定义了13种亚型,两者的显著差异包括将BCR::ABL1样白血病分为三个不同亚型,包括ABL1类重排、JAK–STAT激活以及BCR::ABL1样白血病,NOS。此外,ICC根据通过荧光原位杂交(FISH)在粒细胞中检测到BCR::ABL1(代表多系受累)或仅在淋巴母细胞中检测到(代表仅淋系受累),将BCR::ABL1阳性ALL分为两个亚型,以区分更接近CML-LBP(CML淋巴母细胞相)的亚组与BCR::ABL1阳性ALL。ICC中其他亚型包含B细胞ALL伴MYC重排(仅在WHO的B细胞淋巴瘤中包含)、DUX重排、MEF2D重排、ZNF384(362)重排、NUTM1重排、HLF重排(与WHO中的TCF3::HLF融合相对)、UBTF::AXN7L3/PAN3/CDX2“CDX2/UBTF”、IKZF1 N159Y以及PAX5 P80R突变,此外还包括许多临时亚型。
WHO-HAEM5将T细胞ALL定义为一种前体T细胞系肿瘤,其特征为淋巴母细胞表达表面和/或细胞质CD3、CD5、CD7以及其他T细胞系相关标志物,例如CD2、CD4和/或CD8,TdT和CD34也通常表达。该分类包括T细胞ALL,NOS以及早期T细胞前体(ETP)ALL;后者是基于原始细胞表达特定的免疫表型来定义的,包括CD1a表达缺失、CD8表达缺失、CD5表达缺失或低表达(<75%)、以及对1个或多个髓系(CD11b、CD13、CD33、CD65、CD117)和/或干细胞(CD34、HLA-DR)标志物呈阳性。ETP-ALL是一种高危类别,其特征为诱导缓解失败率和复发率高(ETP-ALL的10年复发率为72%,而典型T细胞ALL为10%);这在一定程度上是由于该亚型在基因病变的数量和大小上表现出高度的基因组不稳定性。ICC将ETP-ALL分为ETP-ALL,NOS以及ETP-ALL伴BCL11B重排。虽然“near-ETP ALL”并非独立亚型,但其免疫表型与ETP-ALL相似,只是CD5表达更高(>75%的细胞)。near-ETP ALL患者的预后与非ETP ALL患者更相似,而非ETP-ALL,因此其不视为高危亚型。
细胞遗传学和基因组分类
细胞遗传学和基因组学分析可为B细胞ALL和T细胞ALL患者提供关键预后信息。费城染色体[Ph,t(9;22)]的检测已从预后指标演变为直接影响治疗选择的因素,将BCR::ABL1酪氨酸激酶抑制剂(TKI)纳入治疗基石。Burkitt白血病[t(8;14)、t(8;2)、t(8;22)]以其对化疗的敏感性和CNS受累的高风险为特征,也具有治疗意义。尽管初始治疗选择可能不会受到影响,但全面的细胞遗传学分析对于正确的预后判断以及确定是否在首次缓解时进行异基因干细胞移植(SCT)是必要的。不良预后的细胞遗传学异常包括低二倍体(<44条染色体)和复杂核型(≥5条染色体异常),以及其他特定异常,包括IgH、HLF、MEF2D、ZNF384和KMT2A[t(4;11)或其他]的重排等(见表1)。低二倍体B细胞ALL会导致RAS信号通路和磷脂酰肌醇3激酶(PI3K)通路的激活,可能对PI3K抑制剂敏感。根据下游信号传导的差异,低二倍体B细胞ALL进一步细分为近单倍体(near-haploid;24–31条染色体)和低亚二倍体(low-hypodiploid;32–39条染色体)。在近单倍体ALL中观察到酪氨酸激酶和RAS信号通路(71%)以及IKZF3基因(13%)的改变,而TP53(91%)、IKZF2(53%)和RB1(41%)的突变则特征性地出现在低亚二倍体ALL中。ZNF384重排ALL具有独特的免疫表型,表达CD13和/或CD33,其临床特征取决于融合伴侣。
除了细胞遗传学异常外,TP53和IKZF1突变,以及构成费城染色体-BCR::ABL1样ALL的基因融合和突变也是高危特征。尽管TP53突变通常出现在低亚二倍体患者中,但TP53突变本身即预示着预后不良。对107例TP53突变成人ALL患者的回顾性分析显示,无论是否存在低亚二倍体,生存结局均较差(中位总生存期为17个月对19个月,p=0.89)。等位基因频率(AF)在此队列中也显示出预后价值,TP53 AF>0.5的患者中位总生存期为13个月,而TP53 AF<0.5的患者为25个月(p=0.03);该结果与之前报告TP53突变不影响患者生存的回顾性分析形成对比。在13例TP53基因缺失的患者中观察到生存更差(28个月vs 未达到;p=0.2)。TP53突变ALL还在ALL治疗后独立增加成人患者发生治疗相关髓系肿瘤的风险(9% vs 1%,p=0.008),尤其是对于老年患者(相对于TP53野生型ALL患者,60岁以上且TP53突变携带者有25%的风险在后期发展为AML或MDS)。BCR::ABL1样ALL是一种以造血干细胞基因表达增加和B细胞系基因表达减少为特征的亚型,尽管为Ph阴性,但BCR::ABL1样ALL患者的基因表达谱与Ph阳性患者相似,包括IKZF1基因突变和酪氨酸激酶通路激活。在BCR::ABL1样ALL患者中常见的基因融合和突变包括CRLF2重排或过表达(>50%的患者)、JAK突变以及ABL1、ABL2、CSF1R和PDGFRB融合等;其对商业化激酶抑制剂(例如在ABL类融合的情况下使用BCR::ABL1 TKI;该亚型占Ph样ALL的10%–20%)和JAK抑制剂敏感。将有效的靶向药物(小分子抑制剂、靶向CD19和CD22的抗体)纳入BCR::ABL1样ALL的治疗可预后。
ETP-ALL是T细胞ALL中的一种独特亚型,常携带至少一个DNMT3A、FLT3、IDH1、IDH2和ETV6的遗传病变,NOTCH1突变频率低,并且存在调节细胞因子受体和RAS信号通路的基因激活突变(67%)。它还以破坏造血发育(58%)和组蛋白修饰基因(48%)的失活病变为特征。其突变谱与髓系恶性肿瘤相似,转录谱与正常和髓系白血病造血干细胞相似。
总之,ALL的基因组分析已导致新的预后标志物(如IKZF1、TP53)、治疗靶点(如ABL1)和新的ALL亚型的发现。将靶向治疗纳入ALL治疗模式有望改善某些疾病亚型(如BCR::ABL1样ALL、ETP-ALL)的不良预后。具有高危特征的患者,包括低亚二倍体(无论是否存在TP53突变)、复杂核型(≥5条染色体异常)、KMT2A重排、具有CRLF2改变和JAK1/2突变的BCR::ABL1样ALL、在贝林妥欧单抗治疗后通过NGS检测仍为MRD阳性的患者,或ETP-ALL患者,应在首次完全缓解(CR)时考虑进行异基因干细胞移植。
费城染色体阳性ALL
费城染色体(Ph)阳性ALL治疗的成功依赖于将靶向BCR::ABL1的酪氨酸激酶抑制剂(TKI)联合不同强度的细胞毒化疗方案或贝林妥欧单抗。多药化疗方案Hyper-CVAD一直是治疗该疾病的传统基础方案。最近,贝林妥欧单抗联合达沙替尼和泊那替尼显示出积极的结果,可能取代多药细胞毒性化疗的基础方案。无论使用哪种基础方案,都应强调持续使用TKI的重要性。一旦确认为Ph阳性疾病,应立即开始使用TKI,并持续给药,而非间歇性给药。管理TKI相关的特异性毒性对于最佳给药也至关重要,并应在选择TKI时予以考虑。
基于伊马替尼的方案
伊马替尼联合Hyper-CVAD的方案最初在54例新诊断或复发/难治性(R/R)Ph阳性ALL患者中进行评估。联合治疗方案在一线治疗中取得93%的完全缓解(CR)率和43%的5年总生存(OS)率。其中16例患者(30%)接受了异基因干细胞移植。这些结果与仅使用化疗历史数据相比,显示出在长期预后方面的显著改善。
英国UKALLXII/ECOG2993试验评估了在诱导治疗期间或序贯给药时将伊马替尼加入强化疗的效果。与单纯化疗相比,加入伊马替尼后CR从82%提高到92%(p=0.004),4年OS从22%提高到38%(p=0.003),能够接受异基因SCT的患者数量也从50%增加到71%。比较在诱导治疗期间使用伊马替尼或稍后使用伊马替尼治疗患者的预后发现,早期使用伊马替尼更获益。
2期GMALL试验评估了,单独使用伊马替尼治疗6周,然后加入低强度化疗进行第二次诱导治疗,随后用化疗进行巩固治疗,最终进行异基因SCT。在174例中位年龄为42岁(范围18-55岁)的成人患者中,85%的患者单独使用伊马替尼即达到CR,巩固治疗后42%的患者达到完全分子学缓解(CMR,对于p210蛋白,BCR::ABL1(IS)≤0.01%;对于p190蛋白,BCR::ABL1转录本水平降低>4个对数)。大多数患者(98%)在中位治疗4个月后在CR1时接受了异基因SCT。中位随访时间为52个月时,3年OS为76%,在达到缓解的患者中,3年持续缓解率为89%;异基因SCT后3年OS为81%。治疗相关死亡率为16%,与患者年龄是否超过45岁无关。
在一项随机试验中,268例中位年龄为47岁(范围18-59岁)的成人患者在诱导治疗的第1-14天接受伊马替尼联合低强度化疗(长春新碱+地塞米松)或高强度化疗(Hyper-CVAD)。两组患者的主要分子学缓解率(MMR,BCR::ABL1转录本水平降低≥3个对数)、OS和无事件生存率(EFS)相似,但高强度化疗组的早期死亡率更高(6.7% vs 0.7%;p=0.01)。异基因SCT与无复发生存率(RFS)(HR,0.69;p=0.036)和OS(HR,0.64;p=0.02)显著改善相关;然而在达到MMR的患者中,自体SCT或异基因SCT后的预后并无差异。与该结果一致,MD安德森癌症中心的长期随访结果显示,无论是否接受异基因SCT,患者的OS相似,尤其是在残留分子疾病被清除的患者中。因此,异基因SCT可能并非所有Ph阳性ALL患者的必要选择,该观点将在下文进一步讨论。
基于二代BTK的方案
达沙替尼和尼洛替尼是第二代BCR::ABL1 TKI,比伊马替尼更有效且更具选择性,且均已在与化疗方案联合使用中进行了研究,尽管尚未有直接比较这些药物的头对头研究。
与伊马替尼类似,达沙替尼也与Hyper-CVAD方案联合使用进行了评估,在72例新诊断Ph阳性ALL成人患者中,CR率为96%,5年OS率为46%。完全细胞遗传学缓解(CCyR)率为83%,CMR率为65%;12例患者(16%)接受了异基因SCT。一项多中心SWOG研究在94例接受Hyper-CVAD和达沙替尼治疗的患者中显示出类似的CR率(88%)和3年OS率(69%);值得注意的是,41例患者(44%)无论分子学缓解状态如何,均接受了异基因SCT,并且与未接受异基因SCT的患者相比,其无复发生存率(RFS,p=0.038)和OS(p=0.037)显著提高。尼洛替尼的研究中,联合交替使用减低强度和常规化疗(大剂量甲氨蝶呤,±大剂量阿糖胞苷)的方案,序贯SCT和伊马替尼维持治疗。尽管由于在省略大剂量阿糖胞苷的组中观察到更高的复发率而提前终止,但在接受常规化疗和大剂量阿糖胞苷的患者中,总体CMR率为83%,4年OS率为79%。早期死亡率较低(<5%),支持将尼洛替尼加入化疗方案的安全性。总体而言,无论是达沙替尼还是尼洛替尼与强化疗联合使用,均显示出类似的CR率(96%–100%)、CMR率(60%–83%)和长期生存率(约45%)。在低强度治疗中,达沙替尼和尼洛替尼的长期生存率分别为36%和47%。尽管达沙替尼和尼洛替尼的疗效和耐药模式(主要由T315I突变驱动)相似,但安全性特征不同,达沙替尼与胸腔积液相关,而尼洛替尼与更多的血管动脉闭塞事件和代谢问题相关。
鉴于Ph阳性ALL的发病率随年龄增长而增加,以及第二代和第三代TKI的强效性,将TKI与低强度方案联合使用以提高耐受性而不影响疗效的探索仍在继续。EWALL-PH01研究纳入≥55岁新诊断Ph阳性ALL患者,治疗包括达沙替尼联合长春新碱和地塞米松用于诱导治疗,随后进行低剂量巩固和维持治疗。96%的患者达到CR,24%的患者达到CMR,5年OS率为36%。在24例复发时接受ABL1激酶突变检测的患者中,18例(75%)存在T315I突变。GIMEMA小组研究的另一种低强度方案包括仅用达沙替尼和类固醇进行诱导治疗,结果CMR率为18%,5年OS率为56%;在第85天获得分子学缓解以及没有额外的IKZF1联合CDKN2A/B和/或PAX5缺失的患者中观察到更好的预后。EWALL-PH02研究了尼洛替尼与长春新碱和地塞米松方案联合使用的效果,结果CR率为94%,4年OS率为47%,与EWALL-PH01研究相似。这些研究结果表明,部分达到CMR的患者可在没有强化疗的情况下实现长期生存,强调了强效且耐受性良好的TKI的必要性。
在伊马替尼和第二代TKI中,唯一的随机试验是一项比较伊马替尼和达沙替尼的试验,纳入189例儿童患者,≤18岁患者随机接受伊马替尼300 mg/m²/天或达沙替尼80 mg/m²/天的化疗。选择达沙替尼的剂量是为了增强CNS渗透性。达沙替尼的4年EFS和OS率显著更好(分别为71%和88.4%),而伊马替尼则为49%(p=0.005)和69.2%(p=0.04);达沙替尼的任何复发的累积风险显著更低(4年时分别为19.8%和34.4%;p=0.01),孤立CNS复发风险也低(4年时分别为2.7%和8.4%;p=0.06)。
尽管化疗和TKI联合治疗后进行异基因SCT取得了进展,但Ph阳性ALL的长期生存率仍然有限,5年生存率仅为40%至65%。这一结果由两个因素驱动:(1)与低强度或高强度化疗联合时,CMR率仅为20%至50%;(2)T315I ABL1激酶结构域突变的出现,据报道在经过第一代和第二代TKI治疗后复发的Ph阳性ALL患者中,该突变的发生率高达75%。因此,使用更有效的第三代TKI可能会通过诱导更高的CMR率和抑制T315I突变的出现,进一步改善预后。
基于泊那替尼的方案
泊那替尼是第三代TKI,对野生型和突变型ABL1激酶结构域的Ph阳性白血病(包括T315I突变)均具有强效活性。
泊那替尼联合Hyper-CVAD用于Ph阳性ALL患者的一线治疗的研究中,在发生两例致命的缺血性心肌事件后实施了一种基于风险的泊那替尼给药策略。患者在诱导治疗的第1–14天继续接受泊那替尼45 mg,但在巩固治疗阶段泊那替尼的剂量从45 mg降低到30 mg。一旦患者达到CMR,泊那替尼剂量进一步降低至每日15 mg。采用这种给药策略后,未再观察到额外的血管事件。在接受Hyper-CVAD和泊那替尼治疗的86例患者(中位年龄46岁;范围39–61岁)中,所有在入组时有活动性疾病的患者(n=68)均达到CR,且未报告早期死亡。总体CMR率为84%,20例患者(23%)在CR1时接受了异基因SCT。估计的6年OS率为75%;6个月里程碑分析未显示接受异基因SCT者与未接受者的6年OS率有差异(分别为70%和87%)。这些令人鼓舞的结果表明,Ph阳性ALL的治疗模式可能发生转变,即在达到CMR时可能不需要异基因SCT。PONALFIL试验纳入30例新诊断Ph阳性ALL患者(中位年龄50岁;范围19–59岁),接受每日30 mg泊那替尼联合强化疗。诱导治疗后的CR率为100%,总体CMR率为71%。26例患者(87%)接受了异基因SCT。4年EFS率和OS率分别为66%和92%。与之前使用伊马替尼报告的3年OS率53%相比,该方案显示出显著改善。在中位年龄为66岁(范围26–85岁)的44例患者中进行的2期GIMEMA 1811试验中,泊那替尼联合类固醇用于低强度治疗,总体CMR率为41%,估计的2年OS率为66%。
一项倾向评分匹配分析比较了Hyper-CVAD联合泊那替尼或达沙替尼,结果显示泊那替尼组在3个月时的CMR率(84% vs 63%)和3年OS率(83% vs 56%;p=0.03)更高。一项包含26项临床试验的荟萃分析也显示,与伊马替尼或第二代TKI相比,泊那替尼的CMR率(79% vs 34%)和3年OS率(79% vs 50%)更高。
一项多中心3期随机试验(PhALLCON)比较了泊那替尼或伊马替尼联合低强度化疗的效果,结果显示泊那替尼组在诱导治疗结束时的可测量残留病(MRD)阴性率更高(34% vs 17%;p=0.002),并且泊那替尼组的深度分子学缓解(DMR)率也更高(42% vs 21%)。两组的动脉闭塞事件发生率较低且相似(泊那替尼/伊马替尼,2%/1%)。
贝林妥欧单抗联合BCR::ABL1 TKI
贝林妥欧单抗是一种双特异性T细胞接合剂(BiTE),靶向CD3和CD19,在Ph阴性和Ph阳性ALL患者中均显示出单药活性。在45例经过多线治疗的Ph阳性ALL患者中,36%的患者获得缓解,其中88%的缓解者通过单独使用贝林妥欧单抗达到CMR。整个队列的中位OS为7.1个月。一项对接受贝林妥欧单抗联合TKI治疗的复发性Ph阳性ALL或CML-LBP患者的回顾性分析显示,CMR率为75%,1年OS率为73%,且安全性可耐受。
这些令人鼓舞的结果推动了贝林妥欧单抗联合TKI用于Ph阳性ALL一线治疗的开发(表2)。
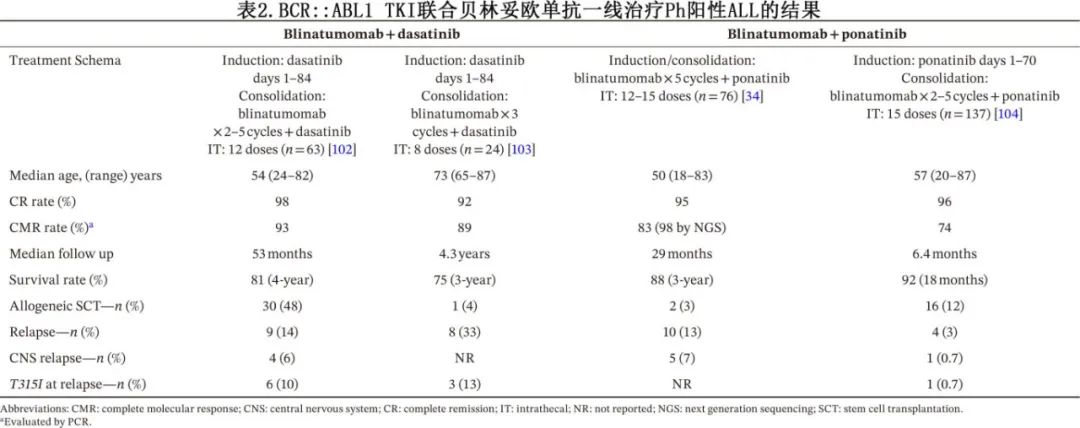
D-ALBA试验评估了贝林妥欧单抗联合达沙替尼在63例新诊断Ph阳性ALL患者(中位年龄54岁;范围24–82岁)中的疗效。患者先接受皮质类固醇和单独达沙替尼治疗85天,随后加入2–5个周期的贝林妥欧单抗,并持续使用达沙替尼,同时接受总共12剂预防性鞘内(IT)化疗。分子学缓解率从诱导治疗后的29%增加到两个贝林妥欧单抗周期结束时的60%。24例患者(38%)在CR1接受了异基因SCT。中位随访53个月时,4年DFS率为76%,4年OS率为81%。在9例复发的患者中,4例为孤立性CNS复发。
鉴于泊那替尼和贝林妥欧单抗在Ph阳性ALL中均显示出单药临床活性,MD安德森癌症中心开展了一项2期试验,以评估该联合方案在一线治疗中的效果。与D-ALBA试验不同,贝林妥欧单抗在诱导治疗期间与泊那替尼同时开始,并且患者接受12–15剂IT化疗。在53例有活动性疾病的患者中,97%达到CR或不完全恢复计数的CR(CRi)。诱导治疗后,59%的患者达到CMR,总体CMR率为83%。此外,98%的患者通过二代测序(NGS)检测(灵敏度为1×10⁻⁶)达到MRD阴性。中位随访29个月时,10例患者复发,其中5例为CNS复发。3年EFS率为78%,3年OS率为88%。2例患者持续检测到BCR::ABL1转录本(0.01%–0.05%),因此在首次缓解时接受了异基因SCT。该队列中异基因SCT的较少使用突显了这种高效联合方案可能减少一线治疗中对异基因SCT的依赖,尤其是在能够达到并维持CMR的患者中。随着随访时间的延长,CNS复发主要出现在白细胞计数≥70×10³/µL的患者中,可能与省略大剂量化疗有关。目前正在开发针对CNS的策略,以降低CNS复发风险(下文讨论)。
同样,GIMEMA小组启动了3期ALL2820试验,以评估泊那替尼+贝林妥欧单抗对比伊马替尼+化疗。目前仅报告了实验组(贝林妥欧单抗+泊那替尼)的结果。与之前的D-ALBA方案类似,诱导治疗包括类固醇预处理,随后使用单药TKI(泊那替尼 30–45 mg每日一次)治疗70天,然后加入贝林妥欧单抗。在137例患者(中位年龄57岁;范围20–87岁)中,96%达到CR。诱导治疗后46%的患者达到CMR,并在第二个贝林妥欧单抗疗程后增加到74%。12%的患者接受了异基因SCT。中位随访6.4个月(范围0.1–32.3个月)时,估计的18个月OS率为92%;4例患者(3%)复发,其中包括1例CNS复发。另一项正在进行的3期随机试验(NCT04530565)正在比较Hyper-CVAD与贝林妥欧单抗的效果,每种方案均联合达沙替尼或泊那替尼,预计今年完成入组。
将贝林妥欧单抗纳入Ph阳性ALL的一线治疗改善了预后,同时避免了传统化疗的毒性(图1)。与泊那替尼的联合使用显示出高CMR率和可耐受的安全性,改善了预后,同时避免了大多数患者对异基因SCT的需求。在这一人群中省略大剂量化疗导致CNS复发增加,也促使增加该人群的IT化疗,并重新考虑在初诊时白细胞计数≥70×10³/µL患者中给予CNS穿透性化疗。
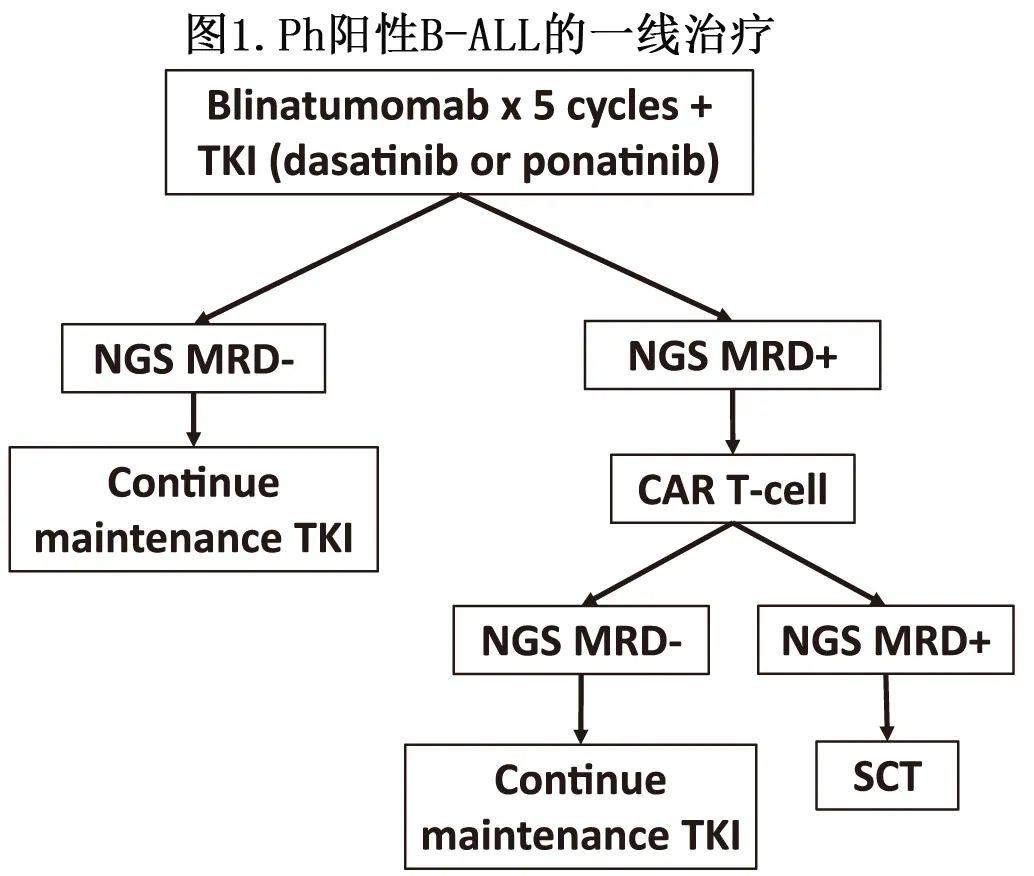
新药
阿思尼布通过结合ABL1激酶的别构位点——ABL肉豆蔻酰口袋来抑制其活性,与其余的BCR::ABL1 TKI不同,后者是结合BCR::ABL1癌蛋白的ATP结合位点。阿思尼布在24例新诊断Ph阳性ALL(n=22)或CML-LBP(n=2)患者中与达沙替尼(每日140 mg)和皮质类固醇联合进行了研究。由于在每日160 mg剂量下观察到的剂量限制性毒性包括淀粉酶和脂肪酶升高(无胰腺炎),因此阿思尼布的推荐2期剂量为每日80 mg。3个月时MR4率为26%,2年OS率为75%。
奥雷巴替尼是一种新型第三代泛BCR::ABL1 TKI,在Ph阳性ALL和CML患者中显示出疗效。在一项2期试验中,31例患者(中位年龄40岁;范围20至66岁)接受奥雷巴替尼(每两天40 mg)联合维奈克拉、长春新碱和泼尼松治疗。完全血液学缓解率为100%,3个月时的CMR率为61.3%。该联合方案耐受性良好,大多数不良事件为1-2级。一项回顾性研究回顾了153例患者,包括髓系急变期CML(CML-MBP;n=68)、CML-LBP(n=39)或复发/难治性(R/R)Ph阳性ALL(n=46),患者接受奥雷巴替尼单药治疗(19%)或联合化疗(81%)。其中20例患者(13%)为新诊断患者,63例患者(41%)之前接受过≥2种TKI治疗,37%的患者存在T315I突变。在CML-LBP患者中,3个月时的完全血液学缓解率为79%,在R/R ALL患者中为83%(p=0.007)。与CML-MBP(中位EFS为3个月,中位OS为9个月)或R/R ALL(中位EFS为7个月,中位OS为15个月)相比,CML-LBP患者的EFS(中位24个月,p=0.013)和OS(未达到,p=0.021)最长。接受异基因SCT的患者与未接受者相比,1年EFS率(72% vs 27%;p<0.001)和OS率(84% vs 40%;p<0.001)显著更长。23例患者(16%)发生心血管相关不良事件(例如,高血压、心力衰竭、深静脉血栓形成、脑梗死)。
未来的研究需要将贝林妥欧单抗与阿思尼布或奥雷巴替尼联合使用。此外,皮下注射(SC)贝林妥欧单抗在复发/难治性ALL患者中显示出有希望的早期活性。如果SC 贝林妥欧单抗在更长时间的随访中保持安全性和有效性,它可能会取代静脉注射贝林妥欧单抗用于Ph阳性ALL患者的治疗。
疾病生物学对预后和治疗策略的影响
在Ph阳性ALL中,复发性遗传异常(如IKZF1和CDKN2A/2B缺失)与不良预后相关。在D-ALBA试验的更新中,与仅存在IKZF1缺失或无IKZF1缺失的患者相比,具有IKZF1plus基因型的患者在53个月时的DFS更差。这表明,在接受贝林妥欧单抗联合达沙替尼治疗的患者中,IKZF1plus异常预示着更差的预后,该现象也在接受达沙替尼和类固醇治疗的患者中存在,突显了这些患者需要替代治疗策略的需求。IKZF1联合CDKN2A/B和/或PAX5缺失是OS(p=0.005)和DFS(p=0.0008)的最重要负面预后因素。
在接受贝林妥欧单抗联合泊那替尼治疗的76例患者中,VPREB1缺失与复发风险增加相关(52% vs 17%;p=0.048)。通过多变量分析,唯一显著的复发风险预测因素为基线白细胞计数(WBC)≥70×10³/µL,而IKZF1plus异常不影响[风险比(HR):2.37(95%置信区间:0.59,9.53);p=0.22]。正在进行的ALL2820试验中,泊那替尼单药治疗序贯贝林妥欧单抗联合泊那替尼,尚未报告与IKZF1plus影响相关的结局;异基因SCT的建议是基于基线时存在IKZF1plus。
在IKZF1plus患者中比较Hyper-CVAD联合泊那替尼治疗与Hyper-CVAD联合达沙替尼,接受泊那替尼治疗的患者5年OS率数值更高(62% vs 44%)。然而,在非IKZF1plus(无IKZF1缺失或仅IKZF1缺失)组中,与接受Hyper-CVAD联合达沙替尼治疗相比,接受Hyper-CVAD联合泊那替尼治疗的患者5年OS率显著提高(97% vs 41%)。一项正在进行的随机试验(GIMEMA ALL2820)正在评估在这种情况下SCT的作用。
异基因造血干细胞移植
异基因SCT传统上被认为是所有Ph阳性ALL的治疗金标准。然而随着新型TKI与贝林妥欧单抗联合治疗的发展,长期预后显著改善,对异基因SCT的依赖也大大减少,从而引发了是否可以在新诊断Ph阳性ALL患者中选择性地安全推迟异基因SCT的问题。对于继续接受异基因SCT的患者,应在移植后30至90天内(根据移植后的恢复情况)开始使用低剂量TKI进行维持治疗,并持续3年,前提是患者保持CMR。相比之下,不接受异基因SCT的患者应无限期地继续TKI治疗。
在作者的实践中,对于通过NGS和PCR维持CMR至少5年的患者,可能会考虑停止治疗。在Ph阳性ALL患者中,停止TKI治疗是可行的,但需要在前瞻性临床试验中进行测试。
Chalandon等评估了自体SCT在新诊断的Ph阳性ALL治疗中的作用。在达到MMR的患者中,异基因SCT并未改善RFS或OS,表明对于达到MMR的患者,自体SCT后使用TKI维持可作为可行选择。同样,治疗开始后3个月内达到CMR的重要性也得到证实。一项对新诊断Ph阳性ALL患者进行的分析显示,在3个月内达到CMR且未接受异基因SCT的患者的4年OS率为66%,中位OS为127个月。多变量分析显示,3个月内达到CMR是OS的唯一预后因素(风险比[HR]:0.42;p=0.01)。在随后对84例接受Hyper-CVAD联合TKI一线治疗的Ph阳性ALL患者的多变量分析中,在3个月内达到CMR的患者显示出5年PFS为68%,5年OS率为72%。使用泊那替尼治疗是多变量分析中唯一有利且独立的预测复发(HR:0.39;p=0.03)或OS(HR:0.38;p=0.04)的因素,而异基因SCT则不影响。一项包括230例接受TKI为基础的方案(强化和非强化)治疗的Ph阳性ALL患者的大型回顾性多中心研究显示,在诊断后3个月内达到CMR的患者中,接受异基因SCT(n=98)与未接受(n=132)的患者相比,RFS(HR:0.86;p=0.53)或OS(HR:1.05;p=0.86)并无改善。研究还进行了倾向评分分析,以平衡两组之间基线风险因素和TKI使用。结果仍证实多变量分析的发现,即接受或未接受异基因SCT的患者之间5年OS(68%对61%;p=0.63)和RFS(63%对52%;p=0.42)相似。
除了3个月内达到CMR外,MRD的存在也可用于识别可能从异基因SCT中受益的患者。在Ph阳性ALL成年患者中,治疗第2周期后MRD阳性(定义为IG/TR > 0.01%)是一个与更差DFS独立相关的因素。基线白细胞计数(WBC)≥30×10³/µL也是DFS更差的预后因素。具有这些特征之一的患者为“高危”患者,其DFS和OS低于其余人群。在“高危”患者中,异基因SCT显著改善DFS(HR:0.33;p<0.001)和OS(HR:0.29;p=0.001),但在标危患者中则无影响。
总体而言,使用贝林妥欧单抗和泊那替尼的无化疗方案在达到CMR的患者中取得极佳的预后。具有高危特征的患者,包括IKZF1plus、初诊时高WBC(≥70×10³/µL)以及VPREB1缺失,以及未能达到CMR的患者,可能会从系统化疗、异基因SCT以及CAR-T细胞治疗中获益。
CNS预防
随TKI纳入化疗方案用于治疗Ph阳性ALL,缓解持续时间和OS得到改善,但同时也观察到多达10%至15%的患者出现了晚期和孤立性CNS复发。因此,针对Ph阳性ALL患者的治疗方案需要增加预防性IT化疗的使用。例如,Hyper-CVAD方案将Ph阳性患者的预防性IT化疗剂量从8剂增加到12剂,该调整显著提高了3年和6年的CNS RFS(3年:100% vs89%,p=0.049;6年:100% vs 91%,p=0.040),且CNS复发显著减少(风险比[HR]:0.12;p=0.04)。
值得注意的是,贝林妥欧单抗联合TKI的无化疗方案缺乏针对CNS的强化疗(大剂量甲氨蝶呤和阿糖胞苷),仅依靠预防性IT化疗来覆盖CNS,可能导致CNS复发的风险更高。在接受贝林妥欧单抗联合达沙替尼治疗的63例患者中,有4例(6.3%)出现CNS复发;在接受贝林妥欧单抗联合泊那替尼治疗的76例患者中,有4例(5.3%)出现CNS复发。来自贝林妥欧单抗和泊那替尼 2期试验的分析表明,初诊时白细胞计数(WBC)≥70×10⁹/L是复发的唯一预测因素,且复发大多为髓外复发。
目前针对接受贝林妥欧单抗和泊那替尼治疗的患者采用的持续策略包括:(1)将IT化疗剂量从12剂增加到15剂;(2)在巩固治疗中加入1至2个周期的大剂量甲氨蝶呤和阿糖胞苷;(3)考虑使用CAR-T细胞治疗或异基因SCT进行巩固治疗,可选择是否联合颅脊照射。这些方法可以考虑用于接受贝林妥欧单抗-TKI联合治疗且有较高CNS复发风险的患者。
参考文献
Kantarjian, H. and Jabbour, E. (2025), Adult Acute Lymphoblastic Leukemia: 2025 Update on Diagnosis, Therapy, and Monitoring. Am J Hematol. https://doi.org/10.1002/ajh.27708
猜你喜欢
- 中药连翘中神秘成分连翘苷,直击发热根源:GAPDH、MDH2、IDH2三靶点深度解析,让你重新认识中医智慧!
- 男性性功能障碍应注意些什么?预防性功能障碍男性注意这几个事项
- 女人出轨有哪些表现 发现女伴有6种情况可能是出轨了
- 如何改善孩子的入园分离焦虑的情况
- 上海大学陈雨/陈付学/冯炜团队AM: 六氰高铁酸钙(III)纳米催化剂实现自闭症谱系障碍治疗的氧化还原稳态
- 流行饮料使肠癌风险“加倍”,少喝点!
- eClinicalMed:iR2方案(依鲁替尼+来那度胺+利妥昔单抗)在复发性/难治性DLBCL中的疗效和安全性
- 除了套套,你还用过其他的避孕方式吗?
- 多项改革举措减轻患者负担
- Lancet Neuro:降压药对小血管疾病患者微血管功能的影响——TREAT-SVDs研究
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)