首页 > 医疗资讯/ 正文
慢性乙型肝炎(CHB)影响全球约2.57亿人,具有晚期纤维化(AF)、肝硬化和HCC的风险。在慢性乙型肝炎中,伴有房颤或肝硬化的患者(Metavir评分,F3‐F4)应该接受监测,因为与无/轻度‐中度纤维化(F0‐F2)的患者相比,他们有肝脏失代偿和HCC的风险。线粒体在炎症、先天免疫和抗病毒反应中发挥重要作用,这两个过程都需要健康的线粒体。线粒体来源的危险信号促进肝脏炎症,直接激活肝星状细胞(HSCs),并驱动NASH小鼠和患者肝纤维化的进展。16.5‐kbp线粒体DNA (mtDNA)是双链环状DNA,编码线粒体呼吸链的关键亚基。复制OH和OL起始点之间的mtDNA区域与突变和不稳定热点区域一致。与染色体DNA不同,mtDNA更容易受到氧化损伤,因为它缺乏保护性组蛋白,并且它附着在线粒体内膜上,而线粒体内膜是细胞中氧自由基的主要来源。

在各种肝脏疾病和进行性神经系统疾病中,氧化损伤的mtDNA复制导致点突变和多种mtDNA缺失,损害线粒体呼吸。线粒体功能障碍以及线粒体适应和保护机制已在多种慢性肝病中得到描述。这些机制包括线粒体生物发生、线粒体裂变/融合、线粒体未折叠蛋白反应(mtUPR)、线粒体自噬和线粒体抗氧化能力/途径的诱导,所有这些都维持线粒体稳态并最终维持细胞存活。
线粒体融合由有丝分裂蛋白1和2 (MFN1和MFN2)以及线粒体动力蛋白样GTPase (OPA1)介导,而线粒体分裂需要动力蛋白相关蛋白1 (utrophin;UTRN)。线粒体生物发生维持线粒体质量,并受过氧化物酶体增殖物激活受体γ辅助激活因子1α(PPARGC1α)和线粒体转录因子A(TFAM)的调节。PPARGC1α和TFAM控制mtDNA的复制和转录。帕金森少年病蛋白2 (PRKN)和磷酸酶和紧张素诱导的推定激酶1 (PINK1)介导的线粒体自噬可清除缺陷线粒体。mtUPR涉及线粒体(HSPD1)/应激70蛋白,线粒体(热休克蛋白家族A [Hsp70])成员9 (HSPA9)伴侣和LONP1肽酶,控制核和线粒体基因组编码的线粒体蛋白之间的化学计量平衡,确保线粒体质量和蛋白酶,并感知线粒体蛋白错误折叠。线粒体抗氧化剂包括还原性谷胱甘肽(GSH)过氧化物酶、锰超氧化物歧化酶(MnSOD)和过氧化物还毒素。
虽然线粒体形成了大量的超氧自由基阴离子,但MnSOD加速了其畸变为过氧化氢,过氧化氢被线粒体GSH过氧化物酶解毒进入水中。通过降低超氧化物稳态水平,MnSOD限制了活性氮物种(RNS)的形成,如过氧亚硝酸盐(一种由超氧化物与一氧化氮(NO)反应产生的强氧化剂)。MnSOD可被活性氧(ROS)和细胞因子诱导,但被过氧亚硝酸盐灭活。过氧亚硝酸盐和过氧亚硝酸盐产生的反应中间体可以使蛋白质硝酸盐化,损害脂质和DNA,并被证明与mtDNA耗竭有关。与诱导型NO合成酶(iNOS)在肝脏病变中的作用以及MnSOD减少过氧亚硝酸盐形成的能力相一致,MnSOD的过表达可以防止小鼠肝脏线粒体氧化应激(OS)。
体外和体内研究表明HBV或乙型肝炎病毒X蛋白(HBx)引起OS并改变线粒体动力学和稳态。HBV诱导的OS可能加速慢性乙型肝炎患者mtDNA的氧化损伤。如果这一假设是正确的,那么CHB患者的mtDNA就会受到严重的氧化损伤。由此产生的线粒体功能障碍和线粒体动力学的相关改变将有利于这些患者纤维化的进展。相反,房颤和肝硬化本身可能加重HBV诱导的mtDNA损伤和线粒体功能障碍。为了验证这一假设,我们将慢性乙型肝炎患者与NASH、慢性丙型肝炎(CHC)患者和健康对照者进行了比较。我们在此提供了一组CHB、NASH和CHC患者的线粒体病变与房颤或肝硬化的关联。在体外复制HBV或表达野生型或突变HBx蛋白的人HepG2肝细胞中,进一步探索HBV或HBx相关线粒体OS、mtDNA损伤和线粒体功能障碍的可能潜在机制。
CHB、CHC、NASH和对照组患者的特征
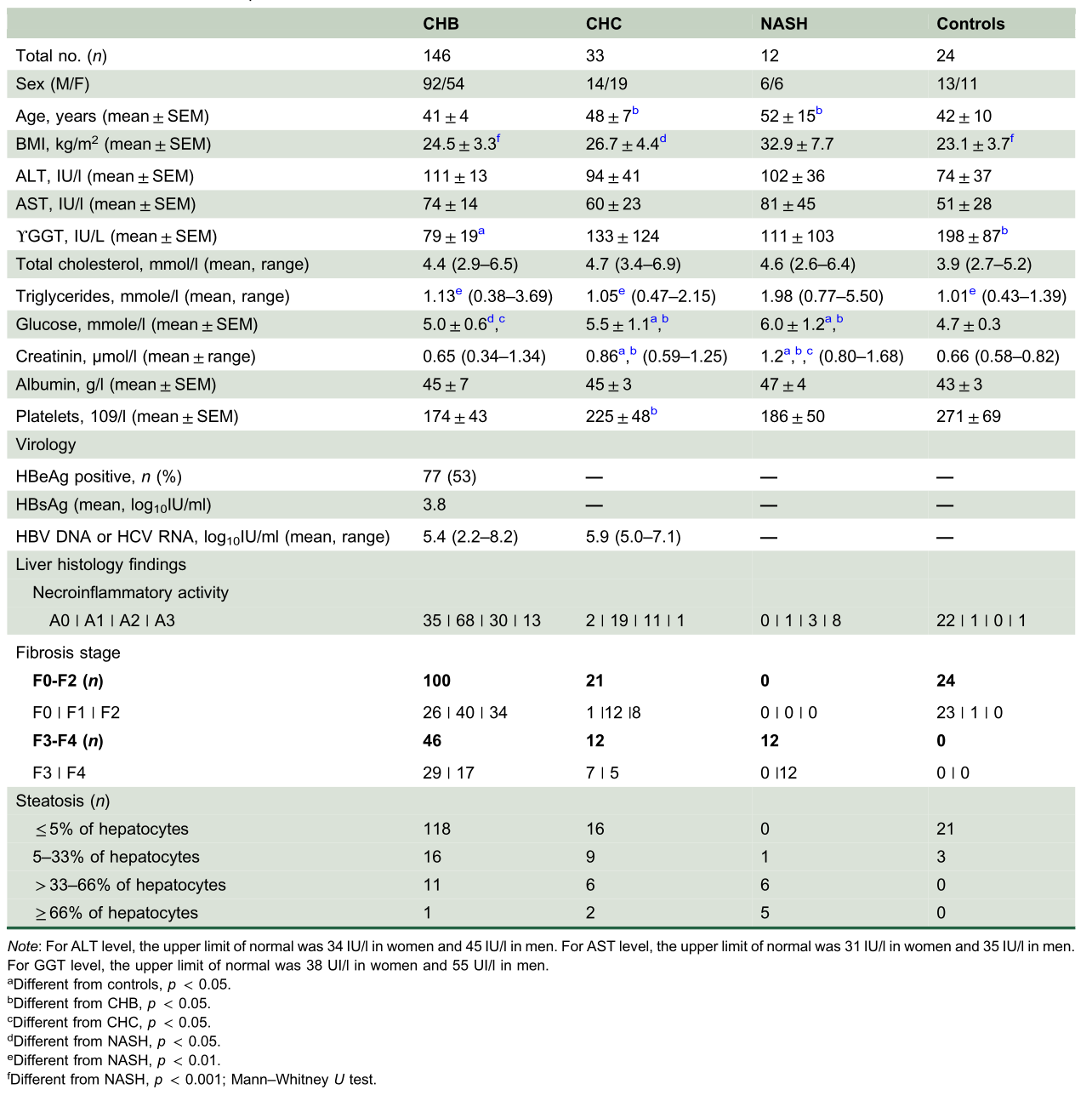
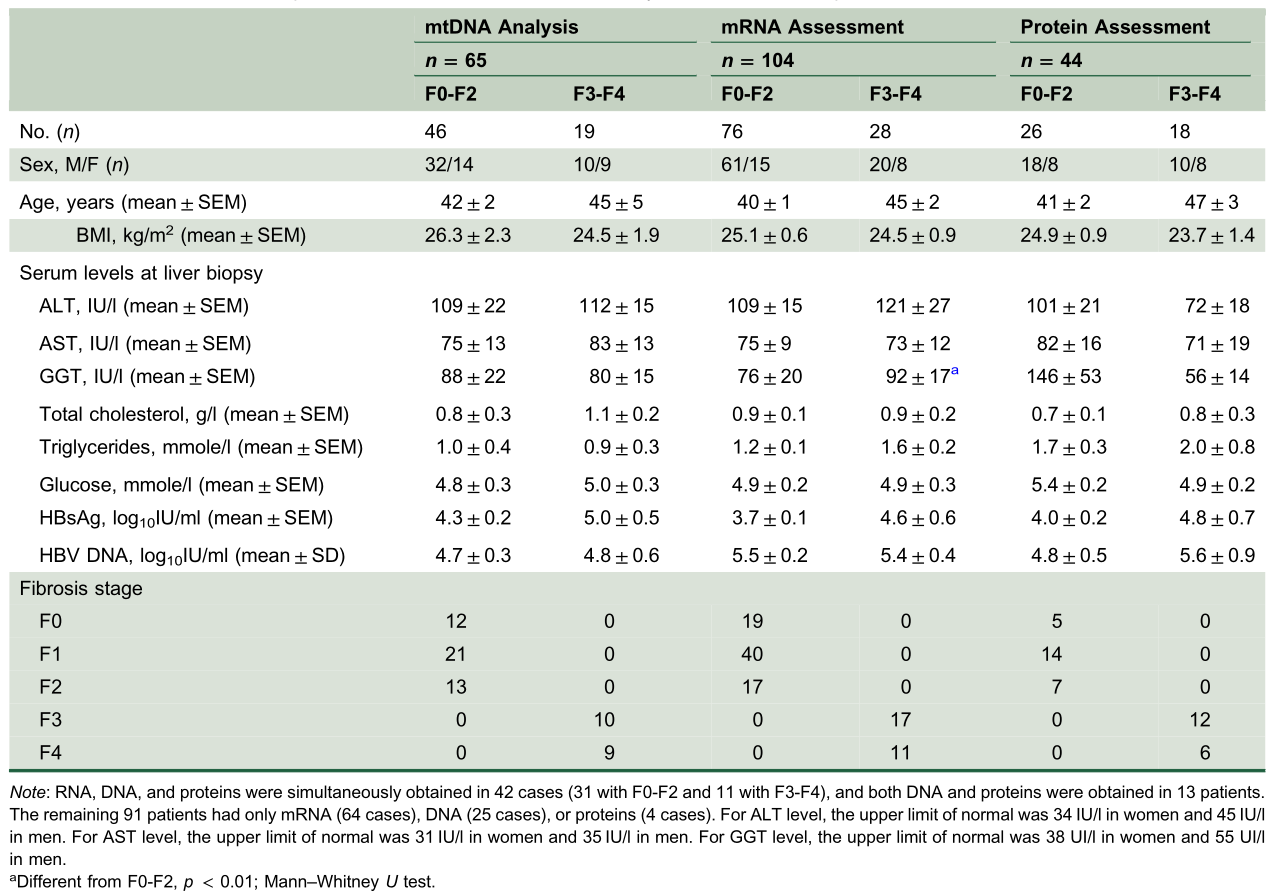
CHB患者的特征及mtDNA分析、mrna和/或蛋白质评估
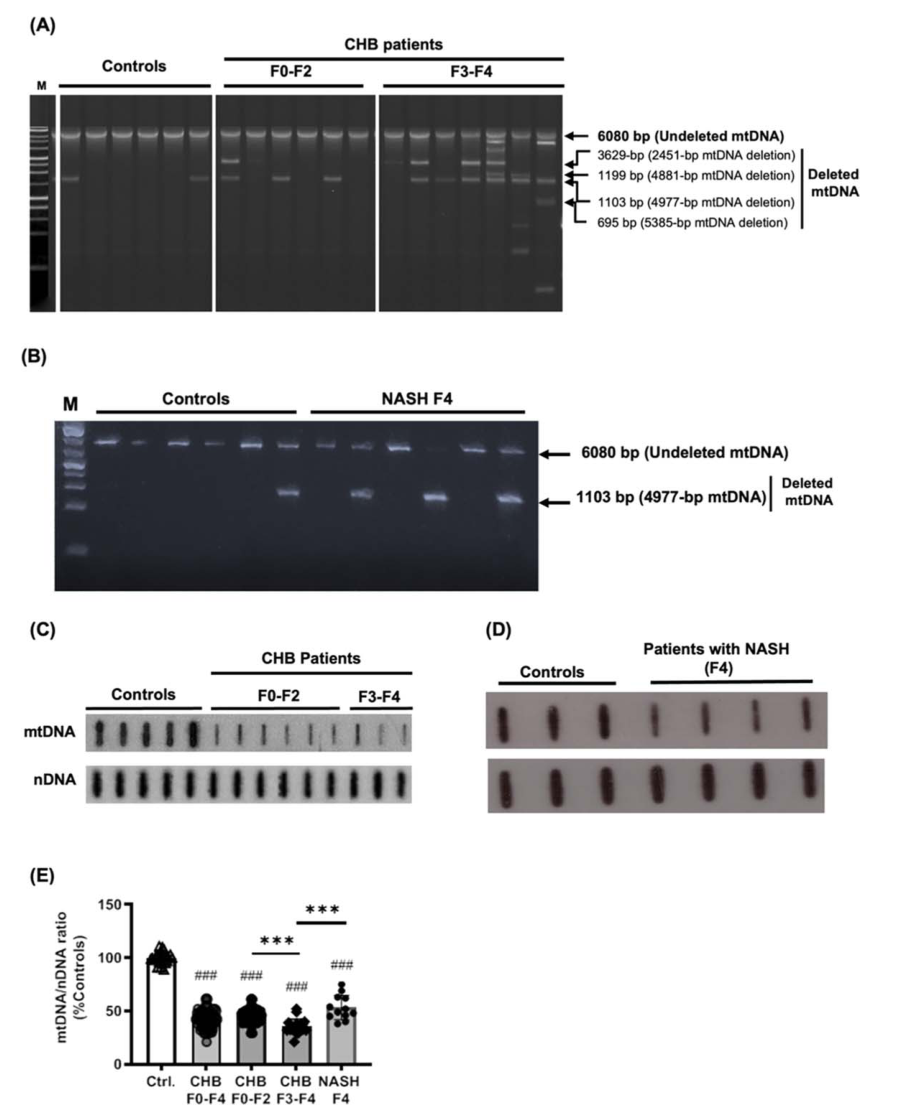
肝脏mtDNA水平和mtDNA缺失。(A,B) LPCR检测对照组、CHB患者和NASH患者mtDNA缺失的代表性凝胶。在CHB患者中,引物A - B给出了从未缺失的mtDNA扩增的6080‐bp产物和从缺失的mtDNA扩增的3629‐,1199‐,1103‐或695‐bp产物(根据这些患者随后表征的5385‐,4977‐,4881‐和2451‐bp mtDNA缺失确定了确切的大小)(A)。获得4977‐bp缺失对应的1103‐bp片段(B)。(C,D,E) 65例CHB患者(46例F0‐F2和19例F3‐F4)和12例NASH患者的代表性槽印迹(C,D)和mtDNA/nDNA比率(平均值±SEM)以24个控制值(E)的百分比表示。与对照组不同,p < 0.001;***不同于F0‐F2或NASH患者;p < 0.001, Mann-Whitney U检验。Ctrl,控制。
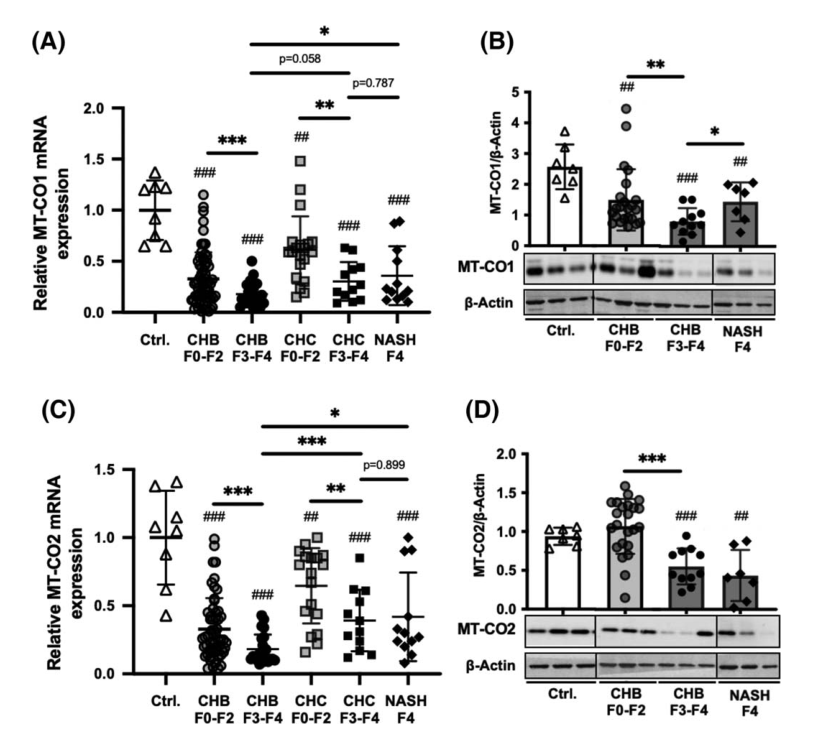
肝脏mtDNA编码的MT - CO1和MT - CO2 mRNA和蛋白水平。(A,B) MT‐CO1 mRNA和蛋白水平。太CO1应承担的mRNA水平比较慢性乙肝患者,F3 F4 (n = 21)或者F0 F2 (n = 66),患者CHC和F3 F4 (n = 12)或者F0 F2 (n = 12),纳什和肝硬化患者(n = 12),和控制(n = 8) (A)。太CO1应承担和β肌动蛋白的蛋白质水平评估慢性乙肝患者,F3 F4 (n = 11)或者F0 F2 (n = 23),纳什和肝硬化患者(n = 7)和控制(n = 7) (B)。(C, D)太二氧化碳信使rna和蛋白质含量。太像二氧化碳mRNA水平比较慢性乙肝患者,F3 F4 (n = 21)或者F0 F2 (n = 66),患者CHC和F3 F4 (n = 12)或者F0 F2 (n = 21),纳什和肝硬化患者(n = 12),和控制(n = 8) (C)。太量二氧化碳和β肌动蛋白蛋白质含量进行评估慢性乙肝患者,F3 F4 (n = 21)或者F0 F2 (n = 11),纳什和肝硬化患者(n = 7)和控制(n = 7) (D),代表凝胶所示。与对照组不同,##p < 0.01, ###p < 0.01。*、**、***不同于F0‐F2或NASH患者;*p < 0.05, **p < 0.01, **p < 0.001, Mann-Whitney U检验。Ctrl,控制。
mtUPR和自噬标记物的评价。(A)比较CHB合并F3‐F4患者(n = 18)或F0‐F2患者(n = 66)、CHC合并F3‐F4患者(n = 11)或F0‐F2患者(n = 21)、12例NASH合并F4患者和8例对照组的LONP1 mRNA水平。(B)比较CHB合并F3‐F4患者(n = 7)或F0‐F2患者(n = 6)、7例NASH合并F4患者和7例对照组的LONP1蛋白水平。(C)比较CHB合并F3‐F4患者(n= 20)或F0‐F2患者(n= 66)、CHC合并F3‐F4患者(n= 12)或F0‐F2患者(n=21)、12例NASH合并F4患者和8例对照患者的HSPA9 mRNA水平。(D)比较CHB合并F3‐F4患者(n = 10)或F0‐F2患者(n = 17)、7例NASH合并F4患者和7例对照组的HSPA9蛋白水平。(E)比较CHB合并F3‐F4患者(n = 20)或F0‐F2患者(n = 66)、CHC合并F3‐F4患者(n = 11)或F0‐F2患者(n = 20)、12例NASH合并F4患者和8例对照患者的HSPD1 mRNA水平。#,##,##与对照组不同(p < 0.05, 0.01, 001);*,**,***F3 - F4与F0 - F2在相同或不同病因中的比较,* p < 0.05, **p < 0.01, **p < 0.001, Mann-Whitney U检验。Ctrl,控制。

(A)比较CHB和F3‐F4患者(n = 20)或F0‐F2患者(n = 66)、CHC和F3‐F4患者(n = 21)或F0‐F2患者(n = 12)、NASH和F4患者(n = 12)和对照组(n = 8)中PRKN和PINK1 mRNA和蛋白的表达。(B)比较CHB和F3‐F4患者(n = 7)或F0‐F2患者(n = 12)、NASH和F4患者(n = 7)中PRKN蛋白的表达。和控制(n = 7)。(C) PINK1 mRNA水平比较慢性乙肝患者,F3 F4 (n = 18)或者F0 F2 (n = 60),患者CHC和F3 F4 (n = 12)或者F0 F2 (n = 19),纳什和F4纤维化患者(n = 12),和控制(n = 8)。(D) PINK1蛋白质含量比较慢性乙肝患者,F3 F4 (n = 7)或者F0 F2 (n = 16),纳什和F4患者(n = 7)和控制(n = 7 ). #,##,### 不同于控制(p < 0.05, 0.01, 0.001);*,**,***F3‐F4与F0‐F2在相同或不同病因中的比较,* p < 0.05, **p < 0.01, ***p < 0.001, Mann-Whitney U检验。Ctrl,控制。

肝脏ATP、MT - ATP8、iNOS和MnSOD蛋白水平和肝脏TNFα和il - 6 mRNA水平。(A)从3名对照者和3名CHB患者(5池F0‐F2, 5池F3‐F4)中分别测定4池30 μg肝脏匀浆和10池30 μg肝脏匀浆中ATP水平。(B) MT - ATP8亚基的Western blotting分析。30例CHB患者的MT - ATP8/β - Actin蛋白比值(平均值±SEM)以12个控制值平均值的百分比表示。(C,D) 5个对照、5个F0‐F2和5个F3‐F4的iNOS和MnSOD蛋白以及相应的iNOS/β‐actin和MnSOD/β‐actin比值的Western blotting分析。采用RT - qPCR检测6例CHB F3‐F4患者和10例F0‐F2患者中TNFα (E)和IL6 (F) mRNA的相对表达量。与对照组不同,*p < 0.05;**p < 0.01。#与F0‐F2不同,p < 0.05, Mann-Whitney U检验。

方法和结果:该研究纳入了146例治疗- naïve单CHB感染患者。CHB合并晚期纤维化(AF)或肝硬化(F3‐F4)的患者与无/轻度‐中度纤维化(F0‐F2)的患者进行比较。CHB患者进一步与慢性丙型肝炎患者(CHC;n=33),非酒精性脂肪性肝炎(NASH;N=12)和健康对照组(N=24)。我们检测了线粒体DNA (mtDNA)的氧化损伤,包括mtDNA链喙,并在F3‐F4患者中发现了与F0‐F2患者相比的多个mtDNA缺失。在房颤或肝硬化合并CHB、CHC和NASH患者中观察到线粒体功能、线粒体未折叠蛋白反应、生物发生、线粒体自噬和肝脏炎症的改变。
在体外,复制HBV或短暂表达乙型肝炎病毒X蛋白的HepG2细胞中,线粒体超氧化物和过氧亚硝酸盐的形成以及mtDNA损伤、线粒体呼吸链复合物的硝化和复合物I的损伤显著增加。超氧化物清除剂Mito-Tempo或诱导型一氧化氮合酶(iNOS)特异性抑制剂1400 W可防止mtDNA损伤和复合物I损伤。
结论:我们的研究结果强调了线粒体OS、mtDNA损伤以及线粒体功能和动力学相关改变在房颤或CHB和NASH肝硬化中的重要性。线粒体可能是药物开发中阻止纤维化进展的靶点。
文献来源:
Loureiro D, Tout I, Narguet S, Mitochondrial stress in advanced fibrosis and cirrhosis associated with chronic hepatitis B, chronic hepatitis C, or nonalcoholic steatohepatitis.Hepatology 2023 Apr 01;77(4)
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)