首页 > 医疗资讯/ 正文
纳米材料的高界面能限制了它们的某些生物医学应用,这些应用需要隐身性来最大限度地减少与生物成分的非特异性相互作用。虽然基于空间排斥的熵稳定(如聚乙二醇)一直是设计隐身纳米材料的主要策略,但其固有的柔软性和对动态变形和外力的敏感性往往导致其隐身性能不高。此外,实现这种最佳隐身性能通常需要对聚乙二醇密度、链长和其他参数进行细致的设计,这是一项具有挑战性的任务。因此,发展概念不同、隐身效率更高的隐身技术势在必行。
在这项研究中,川崎产业振兴研究所Kazunori Kataoka团队开发了一种负载天冬酰胺酶的囊状纳米反应器,延长循环天冬酰胺的持续耗竭,从而改善了转移性乳腺癌和胰腺癌的治疗效果。相关工作以“Steric stabilization-independent stealth cloak enables nanoreactors-mediated starvation therapy against refractory cancer”为题发表在Nature Biomedical Engineering。

【文章要点】
一、体外巨噬细胞摄取和PIC纳米颗粒的蛋白结合
作者探讨了聚电解质复合微胶囊(PIC)的结构稳定性和对巨噬细胞的隐匿性。通过 BLA-NCA 聚合和酰胺化反应,作者合成了一系列具有不同交联密度的PEG-b-P(Asp-AP)微胶囊和聚合物囊泡。少量交联即可提高PIC纳米颗粒在高离子强度条件下的结构稳定性,而不改变其表面电位和形貌特征。交联密度越高,PIC纳米颗粒对巨噬细胞的吞噬越低。作者通过开发一种可去除PEG的新型聚阴离子(PEG-ketal-PAsp),制备出无PEG的高交联度(32.6%)PIC囊泡。即使去除PEG,这些高交联PIC囊泡仍能对巨噬细胞隐匿,且与血清蛋白几乎无结合。通过荧光相关光谱(FCS)和等温滴定量热法(ITC),作者证实了交联密度增加可显著降低PIC纳米颗粒与蛋白质的结合力。该研究表明,交联可在不依赖于PEG的情况下提高PIC纳米颗粒的生物隐匿性,这为设计具有优异体内稳定性和细胞靶向性的纳米载体提供了新思路。
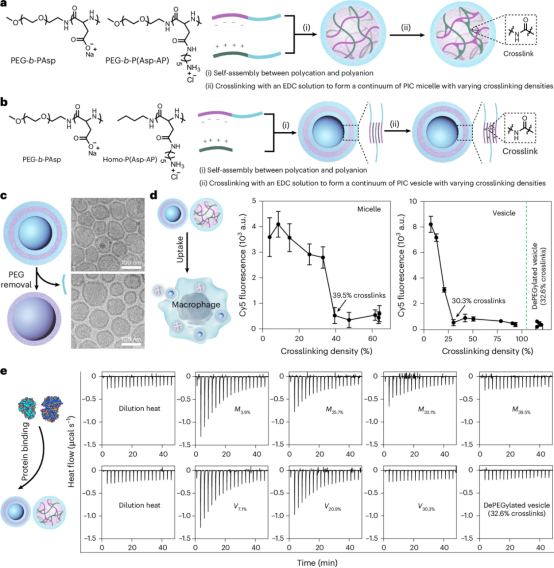
图1 体外巨噬细胞摄取和PIC纳米颗粒的蛋白结合
二、稳定的离子对是影响隐身效果的关键
随着交联度的增加,PIC纳米颗粒表现出更强的抗盐肿胀性和更紧凑的构象,这通过FRET实验和体内血流FRET分析得到验证。NMR分析表明,超过一定临界交联密度(39.5%微胶囊,30.3%囊泡)后,聚合物链显著刚性化,形成了一个不太灵活的网络结构。通过测定Na+计数离子的含量,作者发现在临界交联密度以上,离子对网络形成明显增强,导致离子占有率下降。这种紧凑、刚性的离子对网络结构可能是这些交联聚合电解质体系抗生物吸附的基本机制,而不仅仅依赖于表面PEG遮蔽。上述结果为理解这类交联聚电解质的独特的"隐匿"性质提供了新的洞见,表明其涉及到复杂的分子间相互作用网络,而不仅仅是简单的表面遮蔽效应。
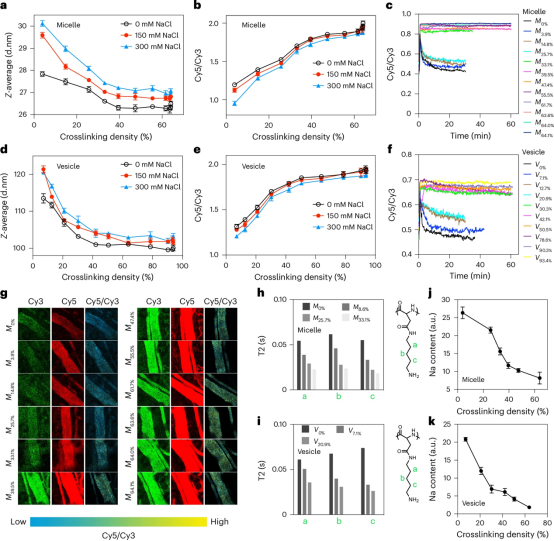
图2 稳定的离子对是影响隐身效果的关键
三、体内纳米生物相互作用和清除
通过体内成像(IVIS),作者发现交联度较低的PIC纳米颗粒(M33.1%和V20.9%)主要被肝脏内皮细胞和巨噬细胞快速捕获。相比之下,交联度较高的长循环PIC纳米颗粒(M39.5%和V30.3%)不会快速沉积在肝脏内皮,而是缓慢通过肝窦内皮进入肝脏实质。即使去除PEG后,高交联PIC囊泡(32.6%交联)也能维持长循环性,不会被肝内细胞快速吞噬。定量生物分布分析和长时间肝脏intravital成像显示,M39.5%从血液缓慢进入肝实质,经胆汁排泄通路进入肠道,这与V30.3%被巨噬细胞慢慢捕获的不同代谢途径相吻合。相比于非隐匿PIC纳米粒子(半衰期1-6分钟),交联PIC微胶囊和囊泡表现出循环时间延长。这种长循环性能源于交联诱导的紧凑构象和稳定的离子对网络,从而大幅降低了与细胞的非特异性相互作用。
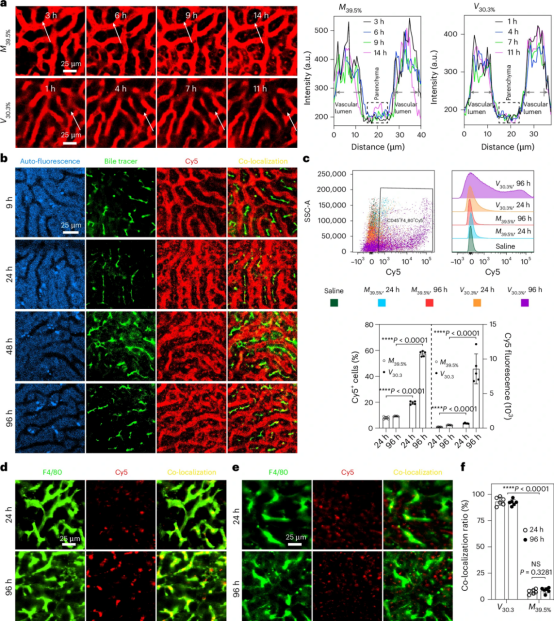
图3 体内纳米生物相互作用和清除
四、负载天冬酰胺酶的囊状纳米反应器(ASNase@V)治疗转移性乳腺癌的疗效
作者将长循环PIC囊泡用于负载抗肿瘤酶 (ASNase)构建一种治疗性纳米酶反应器(ASNase@V)。PIC囊泡特有的自组装机制使得ASNase能够被高效、稳定地封装而不影响其酶活性。同时PIC膜的选择性渗透性使得ASNase能够持续作用而不需要酶释放。与游离ASNase相比,ASNase@V表现出极大延长的循环半衰期(低频剂量治疗,每5天1次)。在两种转移性乳腺癌模型(4T1和231/LM2)中,ASNase@V能明显抑制肿瘤生长和转移,而游离ASNase没有显著疗效。机制研究发现,ASNase@V能在血液和肿瘤组织中持续耗竭天冬氨酸,抑制肿瘤细胞生长,这是其显著抗肿瘤活性的关键此外,ASNase@V在肿瘤组织中的富集水平高达20-30%,这得益于其长循环特性。总之,这一工作展示了以交联PIC囊泡为载体的ASNase纳米酶反应器在缓解某些固体肿瘤对营养耗竭的高度依赖方面的潜在优势,为实现新的肿瘤营养剥夺治疗策略提供了新思路。
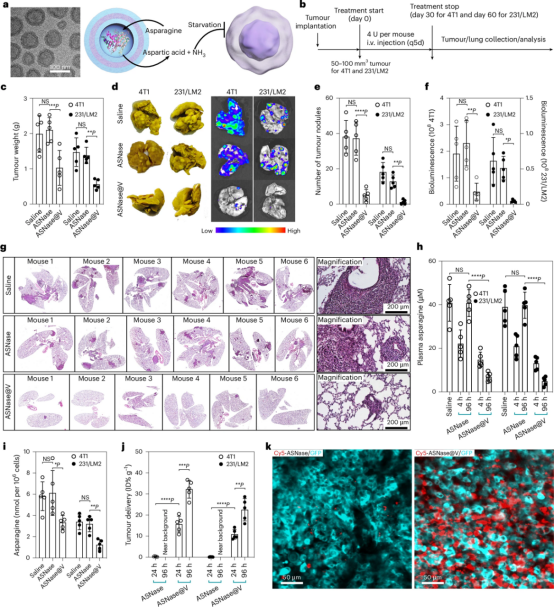
图4 负载天冬酰胺酶的囊状纳米反应器(ASNase@V)治疗转移性乳腺癌的疗效
五、ASNase@V减轻胰腺癌的结缔组织增生并提高联合免疫治疗的疗效
在胰腺癌模型中,ASNase@V治疗能够显著缓解肿瘤基质中胶原蛋白和癌相关成纤维细胞的沉积,即缓解肿瘤间质成纤维化。这种基质成纤维化的缓解,使得抗PD-1抗体aPD-1能够更好地渗透到肿瘤组织中。作者认为,持续的天冬氨酸耗竭抑制了蛋白质合成,这可能是导致肿瘤间质成纤维化缓解的机制。天冬氨酸不仅直接参与蛋白质合成,还作为氨基酸交换因子调节蛋白质和核酸代谢,以及胶原组装。在高度侵袭性的KPC胰腺癌模型中,ASNase@V联合aPD-1显示出显著的协同抗肿瘤活性,使近60%的小鼠在22天内完全消除了原发肿瘤。ASNase@V单独治疗即可延长小鼠中位生存期,而联合aPD-1进一步提高了生存获益。综上所述,这一研究证实了PIC囊泡包裹ASNase可以产生持久的营养耗竭效应,从而缓解肿瘤基质,为免疫检查点抑制剂的有效递送创造有利条件,实现了协同抗肿瘤作用。
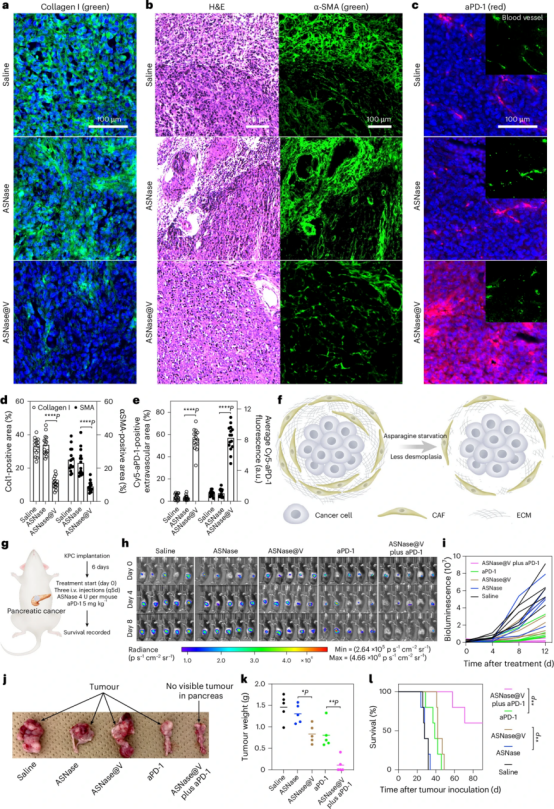
图5 ASNase@V减轻胰腺癌的结缔组织增生并提高联合免疫治疗的疗效
【结论与展望】
在这里,作者报告了一种通过利用离子对网络而不是最大化空间排斥力来实现隐身的独特方法。利用由聚阳离子和聚阴离子等摩尔电荷比组成的模型多离子复合物纳米粒子,作者证明了超过临界阈值的组成多离子之间的交联增加有效地减少了蛋白质的吸附和巨噬细胞的摄取,从而延长了循环,半衰期超过100小时。在此基础上,作者开发了一种负载天冬酰胺酶的囊状纳米反应器,该反应器被半透性离子对网络包裹,用于天冬酰胺治疗。这些纳米反应器的延长循环使天冬酰胺持续耗竭,从而改善了转移性乳腺癌和胰腺癌的治疗效果。作者的研究结果为改善纳米材料的药代动力学开辟了一条途径,通过精细地设计稳定的分子间结构和整体协同作用来改善治疗递送的纳米材料。
原文链接:
https://www.nature.com/articles/s41551-025-01534-1
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)