首页 > 医疗资讯/ 正文
星形细胞瘤是中枢神经系统的高度恶性肿瘤,尽管采用标准多模式治疗,患者生存期仍有限。虽然通常局限于中枢神经系统,但已有罕见的神经外和颅外转移病例被记录。其潜在病理生理学机制仍知之甚少,报告病例极少——尤其是在携带异柠檬酸脱氢酶突变的肿瘤中。本文报告一例 21 岁欧洲裔新西兰女性病例,其患有O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子甲基化、IDH1-R132H突变型星形细胞瘤(世界卫生组织 2021 年中枢神经系统肿瘤分级 4 级),该肿瘤包含原始神经外胚层肿瘤样成分,并表现出弥漫性骨骼和软脑膜转移。该病例代表了一位年轻欧洲裔新西兰女性异柠檬酸脱氢酶突变型星形细胞瘤患者出现神经外和颅外转移扩散的不寻常表现。与近期文献相比,其显著特征为早期全身播散以及骨骼和软脑膜病变共存。多学科讨论认为,由于存在明确的病理相关性、患者临床状况恶化且预后不良,对转移部位进行额外活检无必要。诸如细胞周期蛋白依赖性激酶抑制剂2A/2B(CDKN2A/2B)缺失等分子特征可能进一步完善分类。对现有文献的回顾强调了 2021 年世界卫生组织分类更新的重要性,并突出了上皮-间质转化和类淋巴系统播散在转移中的潜在作用。靶向治疗——尤其是异柠檬酸脱氢酶抑制剂——正在积极研究中。该病例强调了对预测性生物标志物和个体化治疗策略进行持续研究的必要性。
背 景
星形细胞瘤几乎完全局限于中枢神经系统(CNS),全身性转移极为罕见,估计发生率远低于 1%(据报道 <0.5% 的病例,已发表病例不足 200 例)。血脑屏障、脑内缺乏真正的淋巴网络以及患者通常生存期较短,被认为限制了这些肿瘤的血行播散。尽管如此,自20世纪初以来,已有罕见的神经外转移病例被记录。在截至 2011 年的一项综合综述中,Beauchesne等人确定了约286例报告的伴有神经外转移的胶质瘤病例。值得注意的是,其中 >80% 发生在神经外科干预后(例如开颅手术或脑室-腹腔分流术),支持以下观点:保护性中枢神经系统屏障的破坏或通过分流管直接种植肿瘤可促进肿瘤细胞进入体循环。常见转移部位包括肺/胸膜(约 60% 的病例)、淋巴结(约 51%,常为颈部)、骨骼(约 31%)和肝脏(约 22%)。如本例患者所见,骨转移发生时通常累及椎体。总体而言,异柠檬酸脱氢酶(IDH)突变型胶质瘤的转移扩散尤为罕见——大多数报告的神经外转移涉及IDH野生型肿瘤,这意味着极少病例起源于IDH突变亚型。在高级别星形细胞肿瘤谱系中,存在一种罕见的组织病理学变异型,以原始神经外胚层肿瘤(PNET)成分为特征。历史上,此类肿瘤被称为伴有PNET成分的胶质母细胞瘤(GBM)。该变异型患者往往更年轻,一些研究表明PNET样成分可能增加颅外转移倾向。我们的患者病例属于这一类别。根据最新的世界卫生组织(WHO)分类,成人弥漫性星形细胞肿瘤的术语已修订:具有IV级组织学特征的IDH突变型弥漫性星形细胞瘤现在被称为“星形细胞瘤,IDH突变型,WHO 4级”,而“胶质母细胞瘤”这一术语专门保留给IDH野生型病例。根据现行指南,本文报告中始终使用这一更新的命名法。

▲摘自《2021年第五版WHO中枢神经系统肿瘤分类》
本文报告一例独特病例:一名IDH1-R132H突变型4级星形细胞瘤患者,伴有PNET样成分,并发生了活检证实的神经外转移。本报告旨在强调弥漫性星形细胞瘤变异型中全身性转移的发生,并使讨论与当前的分类和管理模式保持一致。该病例对临床医生具有教育意义,强调胶质瘤患者(尤其是长期存活或具有不典型组织学的患者)出现新的全身性主诉时,尽管转移罕见,仍应提示进行转移评估。
病 例
患者女,21 岁,欧裔新西兰人,因头痛、头晕和呕吐就诊于急诊科。颅部计算机断层扫描(CT)和磁共振成像(MRI)显示左额叶有一巨大孤立性肿块,毗邻大脑镰并跨越中线,大小为 6.2×6×6 cm。患者接受了紧急双额开颅手术以切除部分肿瘤。术后即刻CT扫描显示左额内侧叶有残余肿瘤;因此,再次行左额开颅手术以进一步切除肿瘤。1 周后脑MRI显示左额区域无残余病灶。两次切除标本的组织病理学检查显示为局部浸润性高级别胶质瘤,呈肥胖细胞形态,伴有小圆形蓝细胞区域,该区域由小而深染、多形性的细胞核和少量细胞质的细胞组成,位于纤维状背景中(图1)。核分裂象易见(每10个高倍视野 >50 个核分裂象)。伴有广泛的血管增生和坏死灶。肿瘤细胞胶质纤维酸性蛋白(GFAP)、少突胶质细胞谱系转录因子2(Olig-2)、肿瘤抑制蛋白53(p53)阳性,突触素局灶阳性,神经元核抗原(NeuN)和α-地中海贫血/智力低下X连锁基因(ATRX)阴性。存在IDH1-R132H突变。荧光原位杂交显示19q缺失和10q23 PTEN基因座缺失。还检测到MGMT启动子甲基化和EGFR扩增。Ki-67增殖指数为 20%-30%。上述发现最终诊断为星形细胞瘤,IDH突变型,WHO 4级。

▲图1 开颅手术组织样本结果
患者接受了辅助放疗(60 Gy,分30次),并给予地塞米松支持治疗。患者拒绝接受同步及辅助替莫唑胺治疗(按照Stupp方案)。初始诊断后 6 个月,患者因头痛、新发背痛和癫痫发作再次就诊。头颅CT和MRI显示左额叶区域残余肿瘤明显复发,伴软脑膜受累。胸部、腹部和盆腔增强CT显示胸腰椎骨髓呈斑片状改变。单光子发射计算机断层扫描(SPECT)显示全身骨骼放射性示踪剂高摄取,符合广泛骨转移,累及颅骨、脊柱、胸廓、肩胛骨、锁骨、胸骨、骨盆和股骨(图2)。
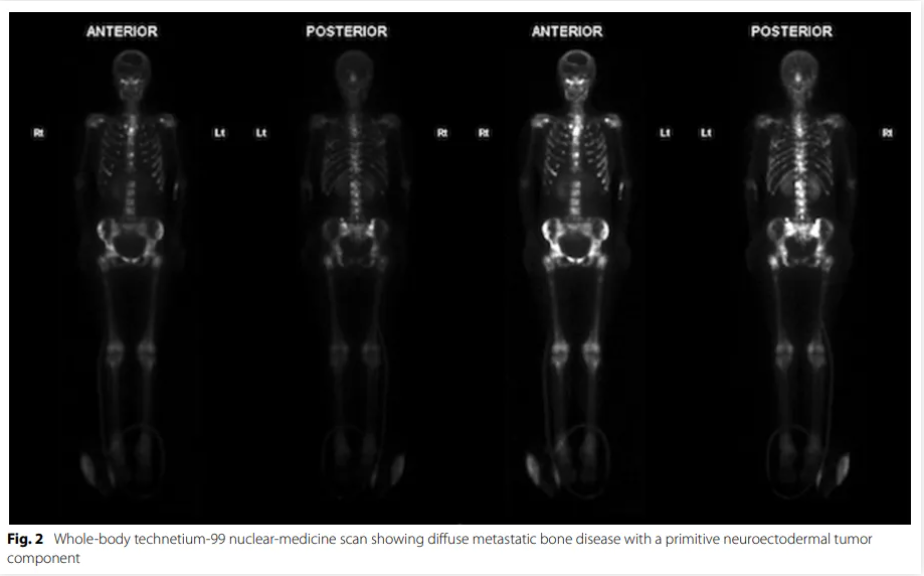
▲图2 全身扫描显示弥漫型骨转移
全血细胞计数显示轻度正细胞性贫血、血小板减少症,伴幼粒幼红细胞血象。腰椎穿刺显示高蛋白、低葡萄糖及淋巴细胞增多;未检测到病原体或恶性细胞,流式细胞术无明显异常。由于存在脊髓损伤风险且改变治疗方案的可能性低,未进行软脑膜活检。鉴于影像学显示广泛骨骼和骨髓受累,遂行骨髓穿刺(干抽)(图2)。结果显示为原始恶性肿瘤,呈小圆形蓝细胞形态,细胞密度约 100%;正常造血功能几乎缺失。肿瘤细胞肿瘤蛋白53(TP53)、分化簇(CD)117、IDH1-R132H、突触素及CD56阳性,C-MYC、CD3、CD10、CD20、CD34、CD38、CD45、CD79a、BCL-2、GFAP、AE1/AE3、Olig-2及S100钙结合蛋白B(S100)阴性。Ki-67阳性率为 20%。INI-1核染色保留。与原始脑肿瘤组织学直接对比,证实为伴有原始神经外胚层肿瘤(PNET)成分的转移性疾病(图3)。

▲图3 骨髓活检
基于这些发现,患者病情被判定为终末期,预后极差。无法进行进一步的手术、放疗或系统治疗,其东部肿瘤协作组(ECOG)体能状态评分为 3 分。患者转诊接受临终关怀,并于初始诊断后 8 个月死亡。表1总结了患者的肿瘤病程。
讨 论
弥漫性胶质瘤的神经外转移——尤其是伴有IDH突变的胶质瘤——极为罕见。胶质母细胞瘤(GBM)的全身播散发生率仅约 0.2–0.5%,截至 2020 年,文献记载的神经外骨转移病例仅约 100 例。大多数已报道的转移性GBM为IDH野生型;这些肿瘤常表现出间充质特征或胶质肉瘤样分化,被认为可增强侵袭性和血管播散能力。上皮-间质转化(EMT)已被确定为促进胶质瘤细胞侵袭性和转移潜能的关键机制。相比之下,本文报告增加了伴有远处转移的IDH突变型星形细胞瘤的病例数量——这类病例虽有限但在不断增多。最近一项跨度 30 年的单中心系列研究(n = 16)强调了颅外转移的罕见性,并且首次对配对的原发和转移性胶质瘤组织进行了下一代测序。基因检测显示存在共有和特有突变,转移灶中以抑癌基因变异为主(例如PTEN缺失、CDKN2A/B缺失)。
Sudarsan等人在 2023 年的一项病例报告中描述了一名 39 岁IDH1突变型星形细胞瘤(WHO 4级)患者发生骨转移,该患者在接受姑息性化疗和转移灶切除后仍存活。相比之下,本文患者出现暴发性全身进展,自诊断起仅 8 个月便死亡。与既往系列研究中大多数患者为男性且转移发生在多次手术后不同,本文患者是一名年轻女性,在 6 个月内出现广泛的骨和软脑膜转移,且无分流术史或术后并发症。促进转移的因素包括手术操作、肿瘤邻近脑膜以及静脉或淋巴侵犯;然而,这些均不能完全解释这种暴发性病程。原始神经外胚层肿瘤(PNET)样成分以及神经元标志物(突触素、CD117)的上调可能提示存在具有转移潜能的侵袭性克隆。Rong等人报道了一名20岁男性的类似胶质母细胞瘤-原始神经外胚层肿瘤(GBM-PNET)变异型,该肿瘤在7个月内播散至中轴骨,支持了这一假设。
近期文献阐明了胶质瘤克服解剖学限制的机制:EMT程序的激活、通过脑脊液和类淋巴-脑膜-淋巴通路播散,以及获得赋予侵袭性的基因改变(例如PTEN缺失、EGFR扩增、CDKN2A/B缺失)。尽管本病例未进行转移灶测序,但原发肿瘤特征(IDH1突变、TP53突变、ATRX缺失、MGMT启动子甲基化)不同于更典型的转移性GBM特征(IDH野生型,伴有TERT、EGFR、PTEN、CDKN2A/B变异)。这强调了进一步研究导致IDH突变型肿瘤侵袭性行为的因素的必要性。
转移性高级别胶质瘤的治疗仍以姑息治疗为主。分子检测可能识别出可靶向突变:特定病例中存在BRAF V600E突变(可使用BRAF/MEK抑制剂)或FGFR-TACC融合(可使用FGFR抑制剂)。本文患者无此类靶点,但IDH1突变提供了一个潜在途径。突变型IDH抑制剂(艾伏尼布、olutasidenib和vorasidenib)正在积极研究中。III期INDIGO试验显示,沃拉西尼布具有可透过血脑屏障的IDH1/2抑制作用,可延长残余/复发的IDH突变型低级别胶质瘤患者的无进展生存期。进展期高级别疾病的早期研究显示,部分患者出现疾病稳定。不幸的是,本文患者在实验性IDH靶向治疗得以尝试前病情已恶化。MGMT启动子甲基化通常可预测替莫唑胺获益,但这可能无法逆转侵袭性转移病程。鉴于颅内和远处病变之间明确的组织病理学一致性以及临床快速恶化,未进行进一步的转移灶活检。这符合患者的治疗目标以及所采取的姑息治疗重点。
结 论
本病例突出了具有原始神经外胚层肿瘤(PNET)样特征的IDH突变型星形细胞瘤(WHO 4级)出现神经外、颅外转移播散的罕见表现。尽管现代对IDH突变型肿瘤不再使用“胶质母细胞瘤”这一术语,但仍可能发生侵袭性行为和广泛播散。全面的分子检测和对更新的WHO标准的认识至关重要。临床医生在患者出现新症状时应警惕全身转移,即使是传统上被认为无转移潜能的肿瘤。靶向治疗——尤其是IDH抑制剂——显示出前景,但仍需进一步研究。正在进行的研究应优先关注预测性生物标志物(例如CDKN2A/B缺失)和播散途径,以制定个体化治疗方案,从而在这一具有挑战性的情况下改善患者的生存期和生活质量。
参考文献:
Gomez, F., Evans, S., Foroughi, F. et al. Extraneural and extracranial metastatic astrocytoma with primitive neuroectodermal component: a case report. J Med Case Reports 19, 471 (2025). https://doi.org/10.1186/s13256-025-05474-x
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)