首页 > 医疗资讯/ 正文
2025 年ESMO大会主席研讨会上公布了FORTITUDE-101 III期试验结果,该试验评估了首创抗FGFR2b单克隆抗体贝玛妥珠单抗(BEMA)联合mFOLFOX6化疗治疗FGFR2b过表达、HER2非阳性、不可切除或转移性胃癌和胃食管连接部癌(G/GEJC)患者的疗效。在该研究预设的中期分析(即主要分析)时,贝玛妥珠单抗联合化疗方案对比单独化疗在总生存期(OS)方面显示出具有显著统计学意义和临床意义的改善。然而,在最终分析中,此前观察到的生存获益幅度减弱。韩国延世大学医学院内科肿瘤学教授Sun Young Rha医学博士公布的数据显示,截止 2025 年 6 月 20 日,中位随访时间为 19.4 个月,在至少 10% 的肿瘤细胞中FGFR2b过表达的患者中,贝玛妥珠单抗组患者的中位OS为 14.5 个月(95%CI,13.0-17.9),安慰剂组患者的中位OS为 13.2 个月(95%CI,10.9-14.7)(HR,0.82;95%CI,0.62-1.08)。

研究背景
FGFR2b过表达在相当一部分胃癌和胃食管连接部癌(G/GEJC)中均有发现,并被认为是肿瘤侵袭性、转移潜能和生存结局较差的驱动因素。携带该生物标志物的患者通常病情进展迅速,且对常规化疗的疗效有限。目前,标准的一线治疗方案(通常基于含铂和氟嘧啶的方案)仅提供适度的益处,导致该人群对生物标志物导向的靶向治疗的需求严重未得到满足。为了弥补这一空白,3 期FORTITUDE-101研究(NCT05052801)旨在评估在mFOLFOX6化疗方案中添加贝马妥珠单抗(BEMA,一种同类首创的抗FGFR2b单克隆抗体)是否能带来与安慰剂联合mFOLFOX6方案相比具有临床意义的生存优势。该试验特别关注FGFR2b在 ≥10% 肿瘤细胞中表达(2+/3+强度)的患者,旨在为晚期胃食管交界处(G/GEJC)的FGFR2b靶向治疗建立新的标准。
研究设计
研究共招募了 547 名FGFR2b过表达、非HER2阳性、不可切除或转移性G/GEJC患者,并按 1:1 的比例随机分配接受以下任一治疗:①BEMA 15 mg/kg,每 2 周一次(Q2W),第 1 周期第 8 天额外服用 7.5 mg/kg,同时联合mFOLFOX6;或②匹配安慰剂联合mFOLFOX6。研究的主要终点是FGFR2b ≥10% 2+/3+肿瘤细胞染色患者的总生存期(OS),无进展生存期(PFS)和客观缓解率(ORR)是关键次要终点。
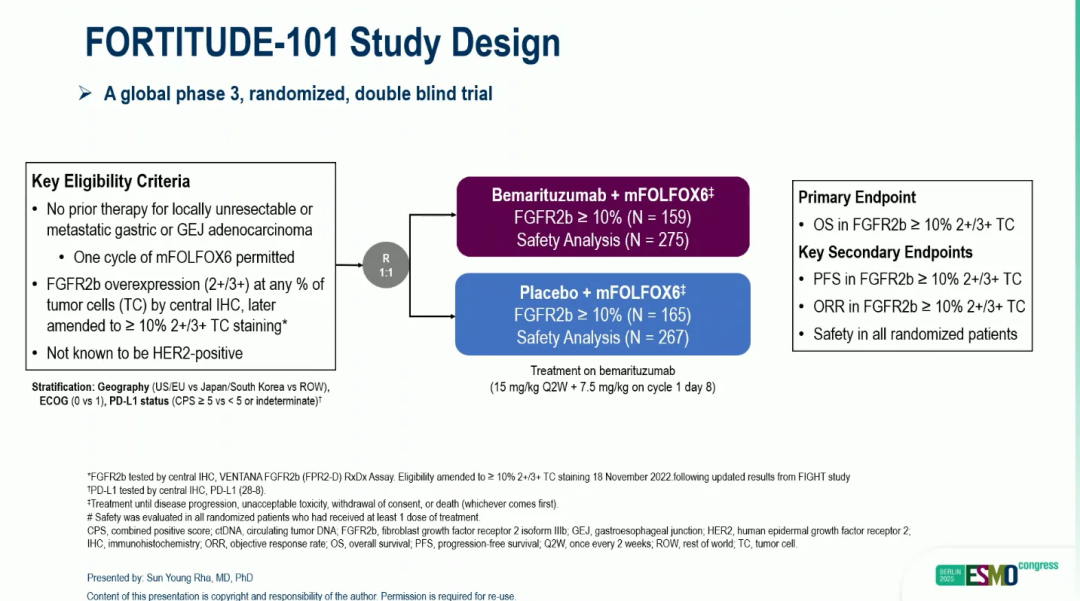
▲研究设计
2024 年 12 月 9 日进行了中期分析(主要分析,PA),后续在 2025 年 6 月 20 日进行了描述性分析(FA)。
研究结果
中期分析结果
截止 2024 年 12 月 9 日,中位随访 11.8 个月,在至少 10% 肿瘤细胞FGFR2b过表达的患者中,接受贝玛妥珠单抗联合mFOLFOX6治疗的患者(n = 159)的中位OS为 17.9 个月(95%CI,13.0-20.8),而接受安慰剂联合mFOLFOX6治疗的患者(n = 165;HR,0.61;95%CI,0.43-0.86;双侧P = 0.005)的中位OS为 12.5 个月(95%CI,10.5-14.7)。贝玛妥珠单抗的OS获益在关键的预设亚组中一致。
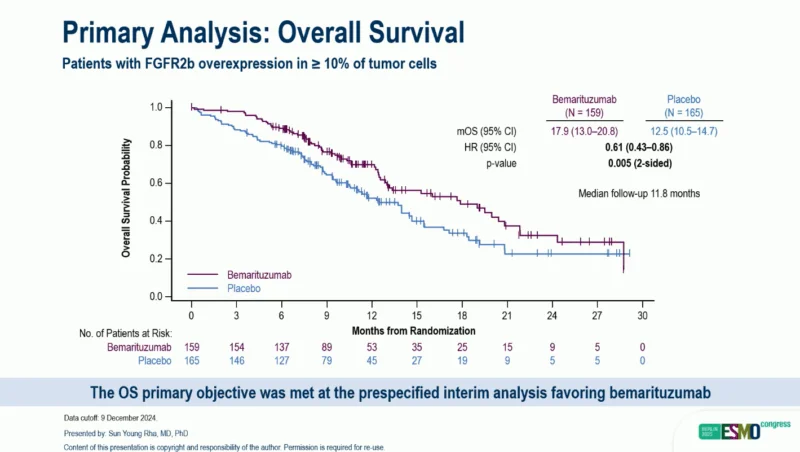
▲中期分析时的OS数据
中期分析时同步公开了PFS和ORR数据,贝玛妥珠单抗组mPFS数据为 8.6 个月,安慰剂组mPFS数据为 6.7 个月(HR 0.71,95%CI 0.53–0.95;P = 0.019)。两组的ORR分别为45.9%(95%CI,38.0%-54.0%)和 44.8%(95%CI,37.1%-52.8%;双侧P = 0.90)。两个组的mDOR分别为 7.0 个月(95%CI,5.3-7.3)和 5.8 个月(95%CI,5.0-7.3)。结果表明在mFOLFOX6方案中添加贝玛妥珠单抗可提高PFS,但未能显著改善客观缓解情况。
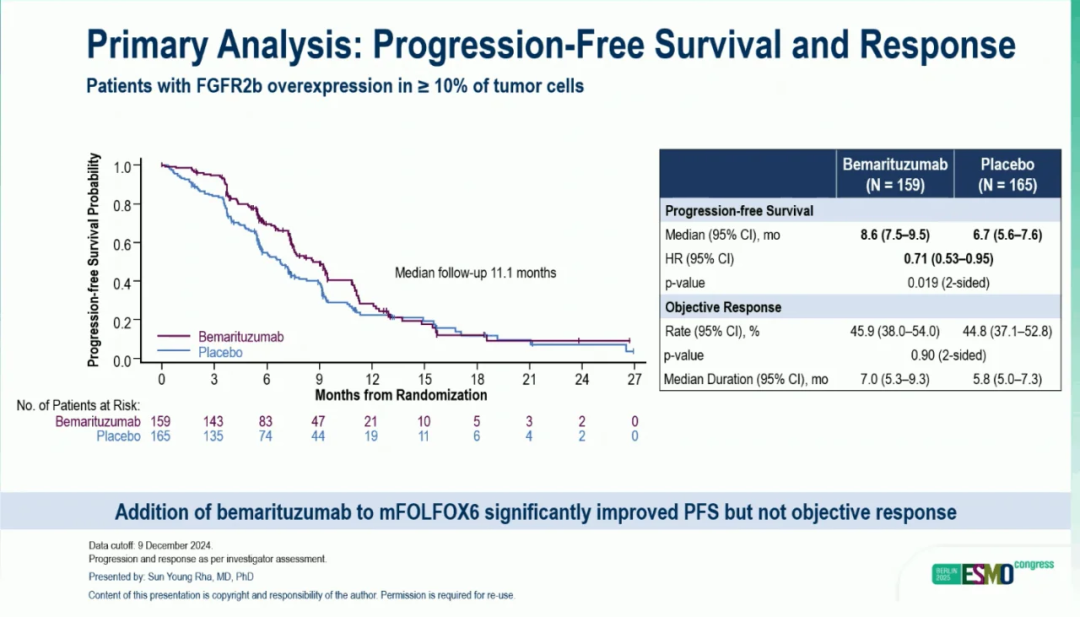
▲PFS和缓解情况
最新随访分析结果
截止 2025 年 6 月 20 日,中位随访 19.4 个月,在至少 10% 的肿瘤细胞中FGFR2b过表达的患者中,贝玛妥珠单抗组患者的中位OS为 14.5 个月(95%CI,13.0-17.9),安慰剂组患者的中位OS为 13.2 个月(95%CI,10.9-14.7)(HR,0.82;95%CI,0.62-1.08)。随访更新的OS结果表明,治疗效果随着时间的推移有所减弱,但在早期分析中仍有持续的临床获益。
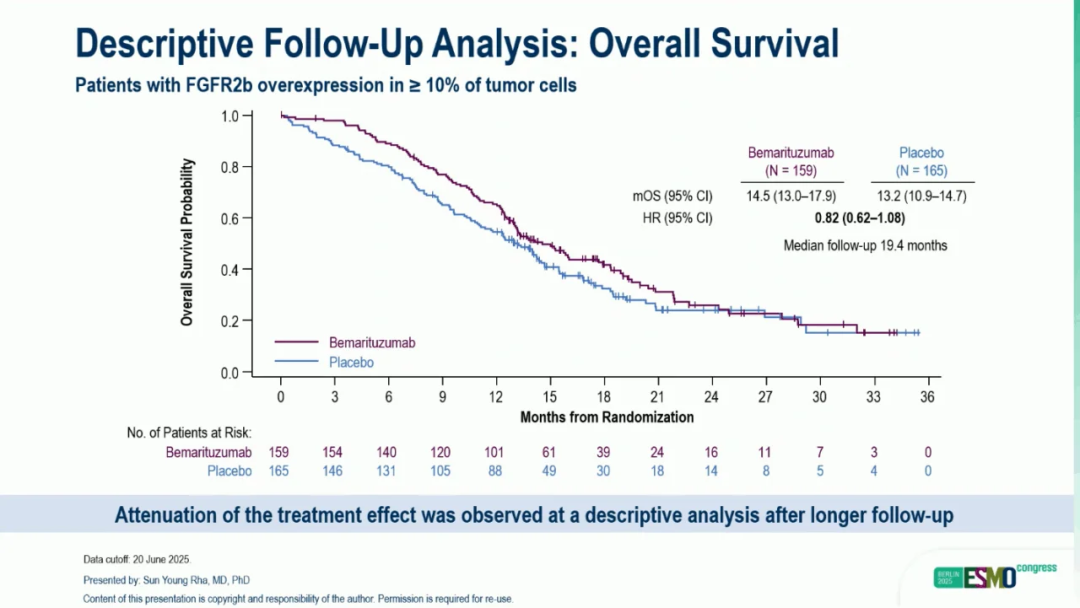
▲随访更新后的OS数据
最新随访更新的安全性数据
截止 2025 年 6 月 20 日,安全性分析组中贝玛妥珠单抗治疗的中位持续时间为 22 周(范围,<1-136 周),安慰剂组的中位持续时间为 25 周(范围,<1-154 周)。mFOLFOX6治疗的中位持续时间分别为 25 周(范围,<1-148 周)和 23 周(范围,<1-154 周)。贝玛妥珠单抗治疗中最常见的各级别TEAE(≥ 25%)包括视力下降、点状角膜炎、贫血、中性粒细胞减少、恶心、角膜上皮缺损和干眼症。最常见的 3 级或更高级别TEAE为视力下降(贝玛妥珠单抗组,33%;安慰剂组,0%);角膜事件,包括点状角膜炎(26%;<1%)、角膜上皮缺损(14%;0%)、角膜缘干细胞缺乏症(14%;<1%)、溃疡性角膜炎(8%;0%);以及非角膜事件,包括中性粒细胞减少症(31%;30%)、中性粒细胞计数减少(9%;9%)、贫血(9%;11%)、口炎(7%;1%)和疲劳(5%;3%)。
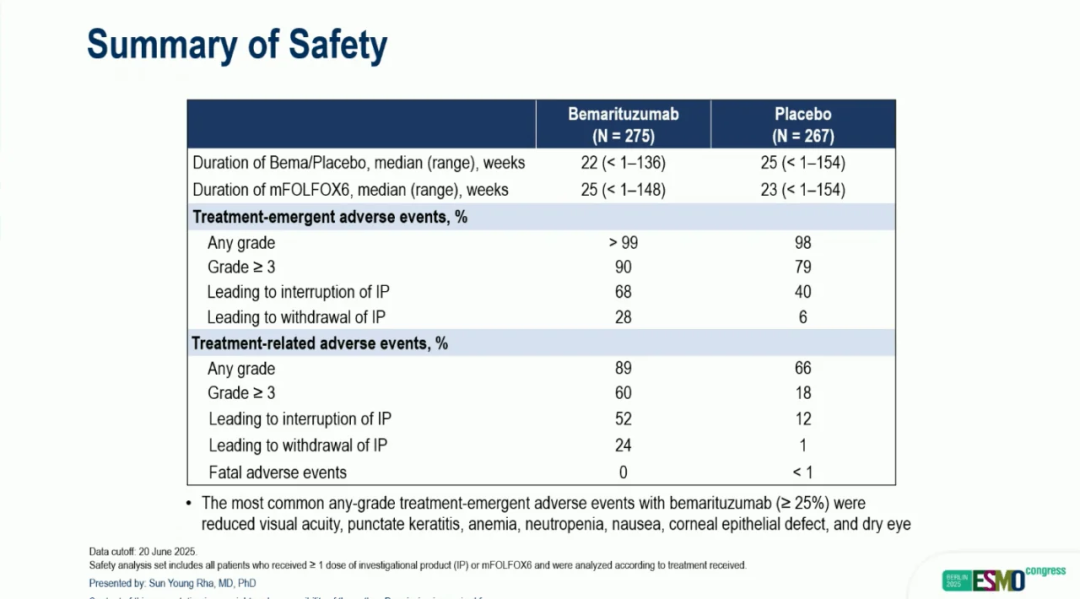
▲安全性数据
值得注意的是,在接受贝马利珠单抗治疗并接受至少 17 周眼部随访的患者中,90% 的3级或更高级别角膜不良事件可缓解至1级或更低级别。角膜不良事件发病较晚,且逐渐消退;然而,视力恢复更快。3 级或更高级别角膜不良事件的中位发病时间为 24 周,中位消退时间为 17 周,消退率为 70%。视力下降的中位发病时间为 24 周,但中位消退时间为 8 周,消退率为 83%。
研究结论
FORTITUDE-101试验在FGFR2b过表达的胃癌和胃食管连接部癌(肿瘤细胞 ≥10%)患者中达到了其主要终点——总生存期(OS)和关键次要终点——无进展生存期(PFS),从而确立了FGFR2b作为该人群中经过验证的治疗靶点的地位。虽然在初步分析中观察到的OS获益具有统计学意义,但在随后的描述性随访中,OS获益有所减弱,这可能反映了疾病进展后的治疗和更长时间的观察。尽管如此,OS和PFS的早期和持久获益支持了贝玛妥珠单抗(BEMA)联合mFOLFOX6的临床有效性。贝玛妥珠单抗的安全性主要由角膜不良事件引起,包括短暂性视力下降。重要的是,这些眼部不良反应大多可通过适当的治疗逆转,这凸显了该药物在靶向FGFR抑制的背景下具有可控的耐受性。FORTITUDE-101的结果以及FORTITUDE-102试验(NCT05111626)的持续评估将进一步明确贝马妥珠单抗在FGFR2b过表达的胃癌和GEJ癌中的获益风险特征,可能塑造该生物标志物亚组未来一线治疗标准。
我司可提供“FGFR2b蛋白表达检测”项目(抗体克隆号:SDT-423-33),用于指导Bemarituzumab(贝玛妥珠单抗)等靶向药物的临床应用,拓宽胃癌治疗机遇!贝玛妥珠单抗已经被FDA和中国药监局CDE认定为突破性疗法称号,用于联合化疗,一线治疗FGFR2b高表达、HER2阴性的局部晚期或转移性胃及胃食管交界处癌患者。

▲FGFR2b蛋白表达检测项目
参考文献:
[1]Bemarituzumab (BEMA) plus chemotherapy for advanced or metastatic FGFR2b-overexpressing gastric or gastroesophageal junction cancer (G/GEJC): FORTITUDE-101 phase 3 study results.
[2]Bemarituzumab/Chemo Combo Translates to OS Advantage in FGFR2b+ Gastric/GEJ Cancer.
https://www.onclive.com/view/bemarituzumab-chemo-combo-translates-to-os-advantage-in-fgfr2b-gastric-gej-cancer
[3]FORTITUDE-101 Trial at ESMO 2025 Presidential: BEMA Plus Chemotherapy in FGFR2b-Positive Gastric Cancer
https://oncodaily.com/oncolibrary/fortitude-101-bema-gastric-cancer
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)