首页 > 医疗资讯/ 正文
近年来,某些类型的肿瘤治疗方法,例如光疗、声动力疗法以及化学动力疗法,能够有效地诱导肿瘤细胞发生免疫原性细胞死亡(ICD)。该过程会暴露或释放一系列被称作损伤相关分子模式(DAMPs)的“危险信号”分子,并且能直接将原位死亡的肿瘤细胞转变为肿瘤特异性疫苗,进而激活抗肿瘤免疫反应。然而,这些治疗方法往往是通过诱导肿瘤细胞凋亡来引发ICD,其免疫原性相对较低。随着纳米技术的进步,研究人员发现,多种纳米材料能够诱导肿瘤细胞走向新型非凋亡性死亡途径,如铁死亡、铜死亡、焦亡以及二硫死亡等。这些新型肿瘤死亡途径能够引发更为显著的ICD,有效增强抗肿瘤免疫原性。尽管如此,单一死亡方式的作用仍存在一定的局限性。
乳酸(LA)代谢在免疫抑制性肿瘤微环境(TME)的形成中发挥关键作用。由于肿瘤细胞为满足其快速增殖与转移的能量需求,主要依赖糖酵解途径进行能量代谢,导致细胞内乳酸大量积累。所生成的乳酸通过细胞膜上的单羧酸转运蛋白(MCT)介导的跨膜运输释放至胞外,从而构建弱酸性的TME。胞外乳酸不仅参与细胞内代谢调控,还可显著抑制树突状细胞(DCs)的抗原呈递功能,并削弱其对效应T细胞的活化能力。此外,乳酸还能促进巨噬细胞向M2型极化,并增加调节性T细胞(Tregs)在肿瘤组织中的浸润,进而增强肿瘤的免疫逃逸能力。因此,阻断乳酸向TME的释放有望有效抑制肿瘤生长,并提升其对免疫治疗的响应性。尽管已有研究采用乳酸氧化酶或小分子乳酸抑制剂(如氟伐他汀和西罗辛诺平)进行干预,但这些制剂在系统循环中易被清除,难以在肿瘤部位实现有效蓄积并发挥持久作用。综上所述,亟需开发具有多重功能的治疗性纳米佐剂,既能促进小分子乳酸抑制剂在肿瘤组织的选择性富集与靶向递送,又具备消耗肿瘤细胞内乳酸的能力,以实现更高效的代谢调控与免疫微环境重塑。
近期,哈尔滨工程大学杨飘萍教授、程子泳教授及中国科学院长春应用化学研究所林君研究员等在《Nano Letters》(IF=9.1)杂志在线发表了题为“Nanospiky Copper Peroxide as Lactate-Modulating Nanoadjuvant to Induce Cuproptosis and Pyroptosis for Enhanced Tumor Immunotherapy”的工作。该研究通过一种简便的离子交换法,在水相体系中使Cu2+与碳酸钙纳米颗粒发生离子置换反应,随后与过氧化氢反应,成功构建了具有纳米尖刺结构的过氧化铜(NSCuO2)纳米佐剂。进一步通过负载乳酸代谢调控剂氟伐他汀钠,并在表面修饰肿瘤靶向配体透明质酸,获得功能化纳米复合物NSCuO2@F@HA。所制备的NSCuO2@F@HA纳米粒子展现出多重协同作用机制:一方面,其可通过抑制乳酸的胞外转运,有效调控肿瘤细胞乳酸代谢,逆转免疫抑制性肿瘤微环境;另一方面,该体系可显著提升肿瘤细胞内Cu2+浓度及活性氧(ROS)水平,从而高效诱导铜死亡(cuproptosis)与焦亡(pyroptosis)两种程序性细胞死亡通路的激活。上述效应协同促进肿瘤相关抗原的释放与呈递,增强免疫系统对肿瘤的识别能力。因此,NSCuO2纳米佐剂不仅具备良好的靶向性与多模态治疗潜力,且为开发兼具代谢调控与免疫激活功能的新型纳米材料提供了重要参考。

文章要点:
在这项研究中,作者采用水相离子交换法,在涡旋搅拌条件下,通过Cu2+与CaCO3纳米颗粒之间的离子置换反应,成功制备了纳米尖刺状氢氧化铜(NSCu(OH)2)纳米粒子。Cu2+与 Ca2+之间的离子交换反应在热力学上具备可行性。这是因为CaCO3的溶度积常数(Ksp)为 3.3×10-9,显著高于Cu(OH)2的Ksp(5.6×10-20)。随后,利用NSCu(OH)2纳米颗粒与H2O2水溶液之间的反应,合成了NSCuO2纳米粒子。由于其独特的纳米尖刺球体形貌,可有效担载小分子乳酸外排抑制剂—氟伐他汀钠(Flu),担载率为21.9 %。此外,在表面修饰透明质酸以提高纳米复合物的生物相容性及肿瘤细胞靶向性。酸响应分解后,NSCuO2@F@HA纳米粒子快速分解,释放Cu2+及担载的Flu,生成大量H2O2。Cu2+可有效消耗GSH,同时通过类芬顿反应催化自补偿的H2O2产生ROS(图1)。
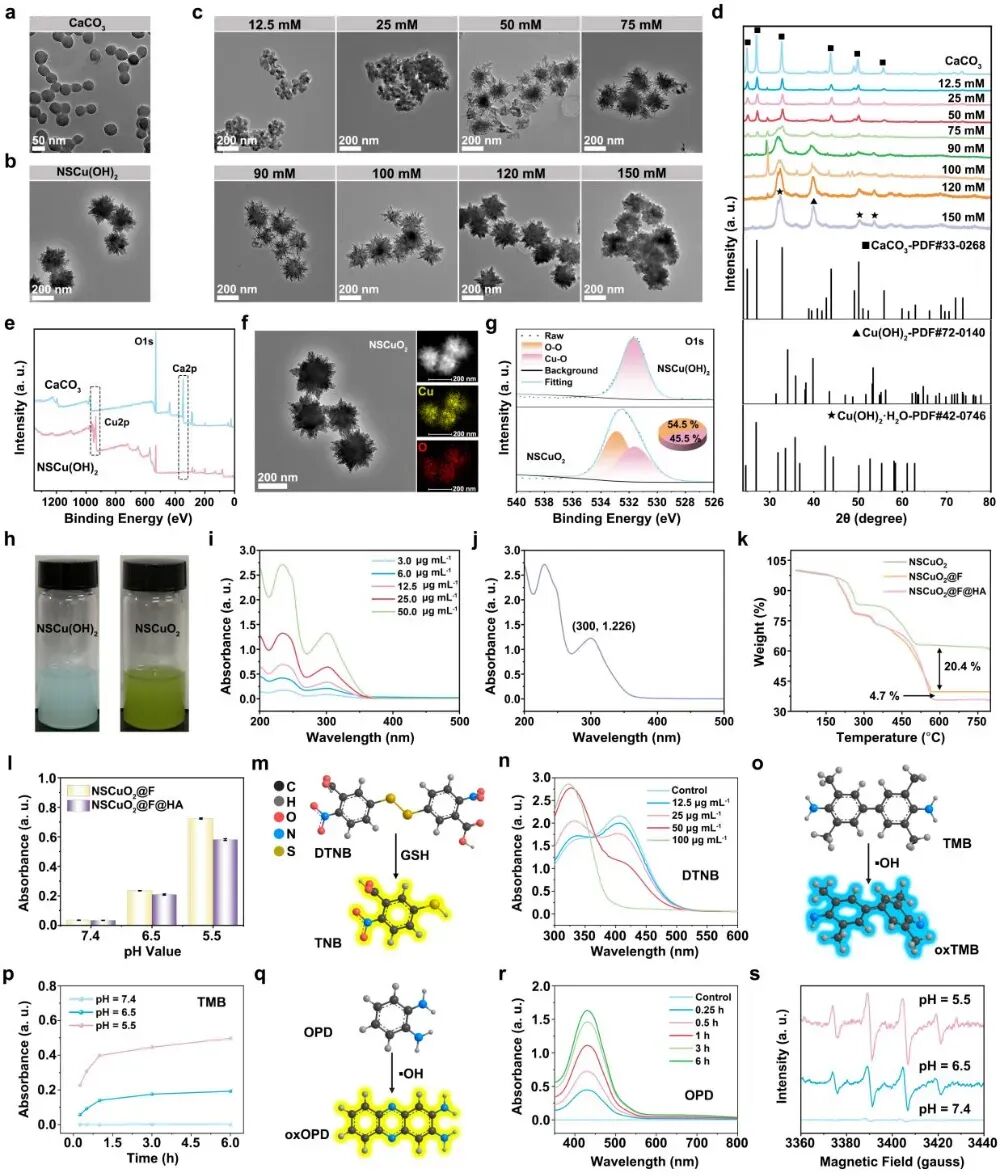
图1NSCuO2@F@HA纳米复合物的合成与H2O2自补偿、GSH消耗及·OH生成等性能测试
细胞实验表明,由于透明质酸的修饰,NSCuO2@F@HA纳米复合物更易被肿瘤细胞吞噬。同时通过释放担载的Flu破坏细胞膜上MCT4蛋白,有效抑制细胞内的乳酸外排至胞外环境中。释放的Cu2+诱导DLAT蛋白聚集及LIAS蛋白减少,引发肿瘤细胞铜死亡。此外,明显消耗了肿瘤细胞中高表达的GSH并提高肿瘤细胞内ROS的水平(图2)。
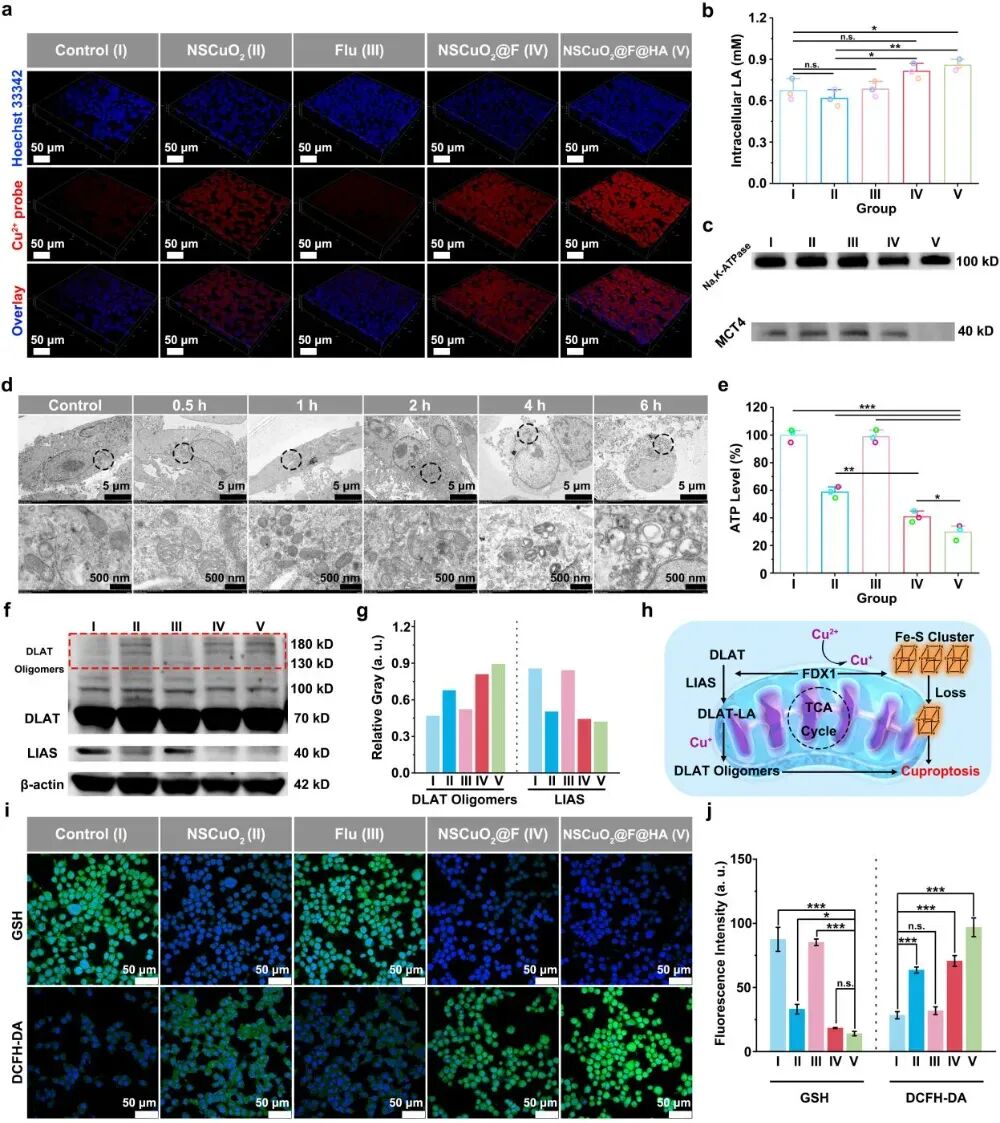
图2 NSCuO2@F@HA纳米复合物被肿瘤细胞吞噬、抑制乳酸外排,诱导细胞铜死亡、消耗GSH及生成ROS
如图3所示,经NSCuO2@F@HA纳米复合物处理后的肿瘤细胞明显出现鼓泡现象。这是由于细胞内大量生成的ROS激活caspase-1,直接裂解GSDMD蛋白。GSDMD蛋白裂解后的N端片段会在宿主细胞膜上形成一个孔来调节胞质内容物的释放。此外,caspase-1还可以裂解pro-IL-1β前体来使IL-1β变成成熟的功能蛋白。因此,NSCuO2@F@HA纳米复合物可激活caspase-1依赖途径诱导肿瘤细胞焦亡。结果,NSCuO2@F@HA纳米复合物通过诱导肿瘤细胞铜死亡及焦亡,可有效引发肿瘤细胞ICD,释放大量DAMPs,包括CRT的暴露、HMGB1的迁移及ATP的释放。这些DAMPs可促进DCs的成熟,激活抗肿瘤自适应免疫响应。此外,由于NSCuO2@F@HA纳米复合物抑制了肿瘤细胞内乳酸外排,明显促进M2型巨噬细胞极化为M1型巨噬细胞,逆转了免疫抑制肿瘤微环境。
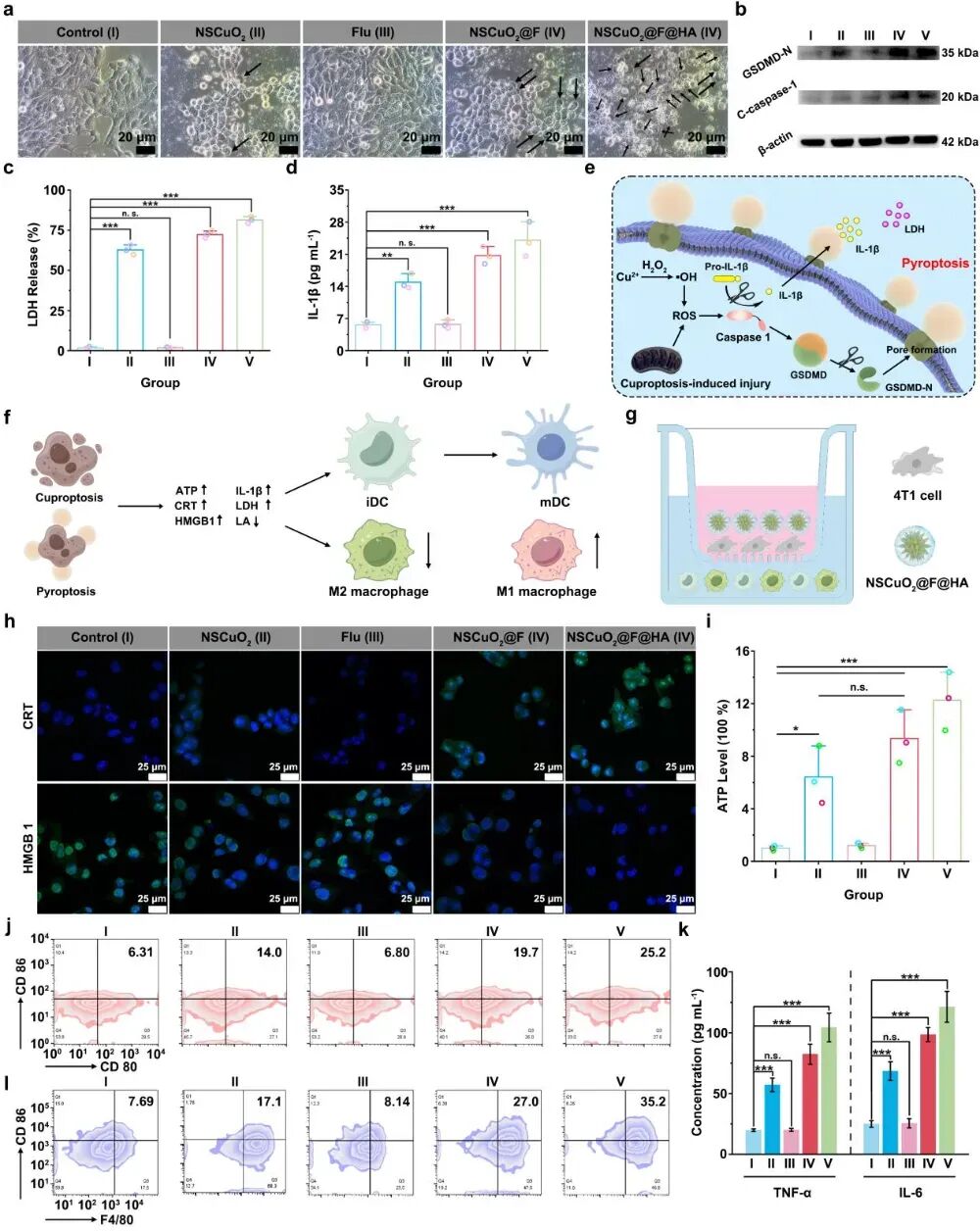
图3 NSCuO2@F@HA纳米复合物诱导肿瘤细胞焦亡、引发肿瘤细胞ICD并促进M2型巨噬细胞极化为M1型巨噬细胞
为了进一步验证NSCuO2@F@HA纳米复合物诱导肿瘤细胞铜死亡及焦亡并激活抗肿瘤免疫响应的效果,作者通过构建双侧小鼠荷瘤模型进行充分的体内实验。首先,发现NSCuO2@F@HA纳米复合物静脉注射后可在肿瘤部位有效积累,同时具备良好的生物相容性。然后,通过对瘤径及瘤重的观察发现NSCuO2@F@HA纳米复合物治疗后荷瘤小鼠的原发瘤及远端瘤的生长都受到了明显抑制(图4)。通过对抗肿瘤免疫响应相关指标进行检测,发现该纳米复合物不仅激活了DCs成熟介导的抗肿瘤免疫响应,还可以促进M2型巨噬细胞极化为M1型巨噬细胞并显著下调Tregs,有效延长了荷瘤小鼠的生存周期(图5)。
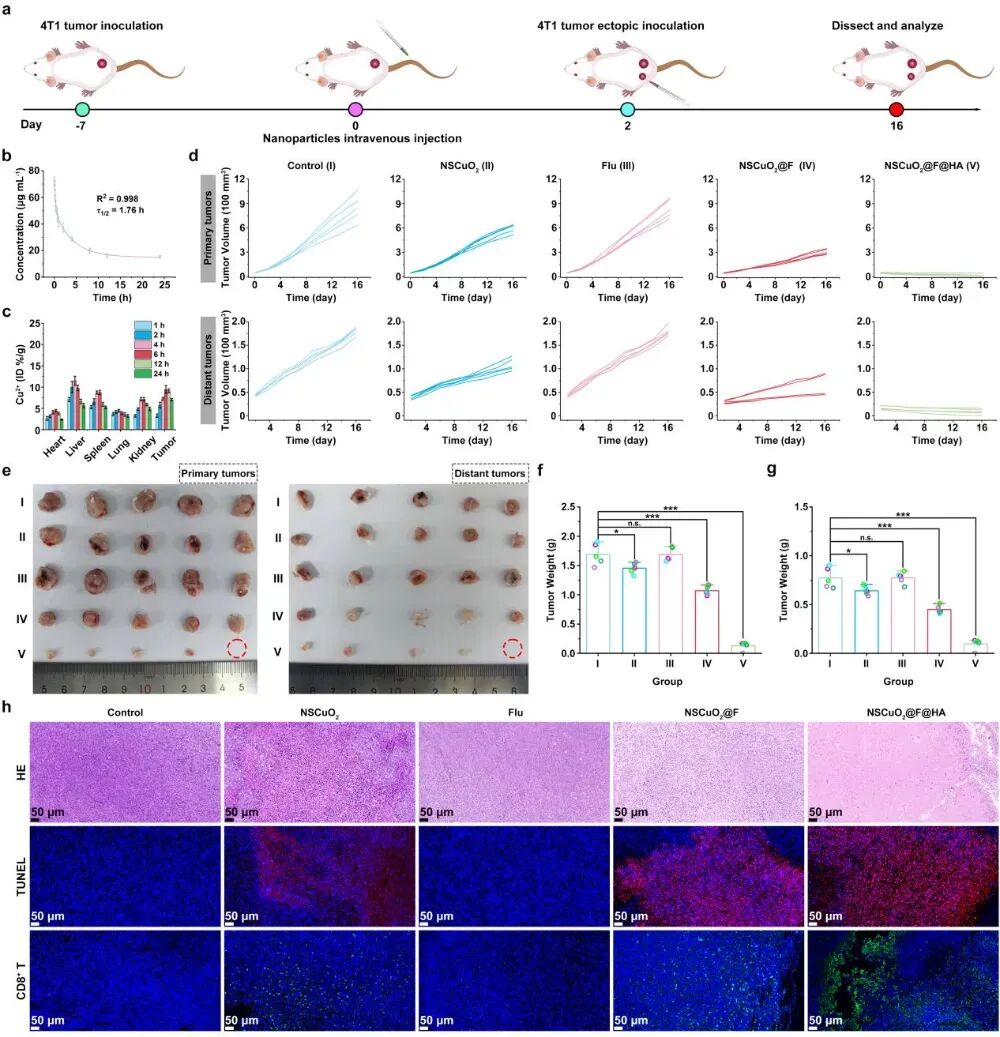
图4 NSCuO2@F@HA纳米复合物体内抑制肿瘤生长及转移效果评估
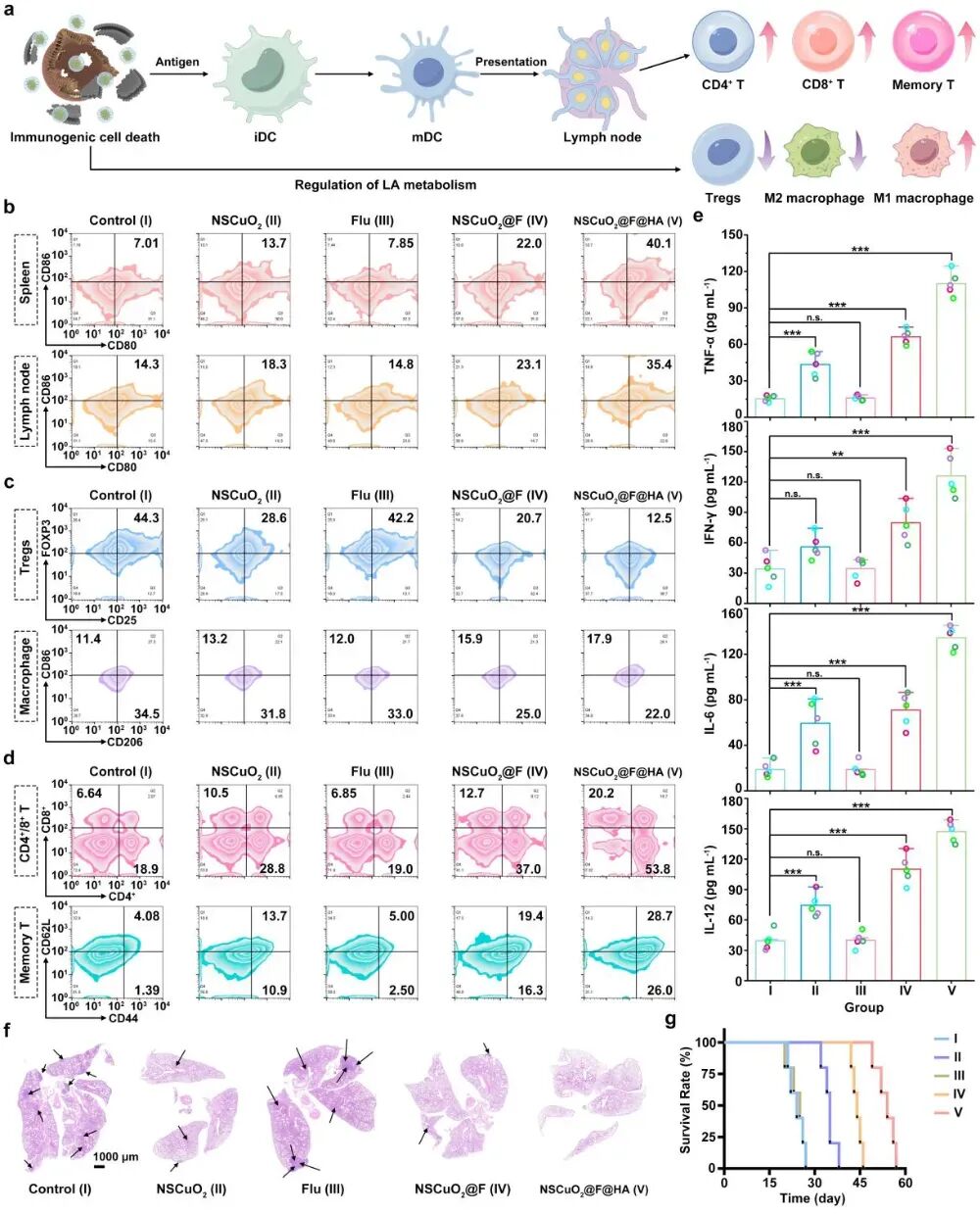
图5 NSCuO2@F@HA纳米复合物体内激活抗肿瘤免疫响应并逆转免疫抑制微环境效果评估
原文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.5c04293
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)