首页 > 医疗资讯/ 正文
小肠腺癌(SBA)是一种罕见的胃肠道恶性肿瘤,预后较差且治疗选择有限。由于其罕见性,尽管具有独特的分子特征和较差的预后,临床管理通常参照结直肠癌(CRC)。虽然免疫检查点抑制剂(CPI)治疗在错配修复缺陷型(dMMR)CRC中显示出疗效,但关于SBA的数据仍然稀缺,且MMR检测尚未常规开展。研究者对2019年3月至2024年1月期间在哥本哈根大学医院-赫勒夫(Copenhagen University Hospital—Herlev)接受CPI治疗的SBA患者进行了回顾性研究。采用RECIST v1.1标准评估影像学反应,并分析了SBA患者中MMR检测频率及dMMR状态。
在148例SBA患者中,7例接受了CPI治疗。客观缓解率(ORR)为86%,其中1例(14%)完全缓解(CR),5例(71%)部分缓解(PR)。中位无进展生存期(mPFS)为31个月[中位随访时间(mFU)32个月];中位总生存期(mOS)未达到(mFU 33个月)。总体而言,55%的患者接受了MMR检测,18%的SBA患者为dMMR型。
CPI治疗在dMMR SBA中产生了高且持久的缓解率,支持dMMR作为预测性生物标志物。然而,不一致的MMR检测策略可能会限制患者获得最佳治疗。常规分子谱分析和更广泛的生物标志物发现是扩大CPI适用人群和改善预后的关键。
-
SBA在分子水平上与CRC不同,但临床中常采用相似的管理方式;
-
仅55%的SBA患者接受了MMR检测;其中18%被发现为dMMR型;
-
CPI治疗后的mPFS为31个月;
-
常规MMR检测对于识别可能从CPI治疗中获益的SBA患者至关重要。
研究背景
小肠腺癌(SBA)是一种罕见的胃肠道癌症,约占所有小肠癌症的三分之一,其余为组织学上混合的类癌、淋巴瘤、肉瘤和神经内分泌肿瘤。诊断时的中位年龄为66岁,性别分布均衡。尽管罕见,但SBA的发病率正在上升,美国每年报告约10,000例新病例。在丹麦,1994年至2010年期间SBA的平均年发病率为每10万人1.10例,年增长率为1.9%。
SBA可根据其原发解剖部位分类,最常见于十二指肠(57.9%),其次是空肠(15.6%)和回肠(10.8%)。手术切除仍是SBA唯一可能治愈的治疗方法,但复发率较高。在晚期疾病情况下,预后仍然较差,5年OS仅为4%,凸显了改善患者管理的未满足需求。
由于发病率低且缺乏随机试验,SBA的临床管理历来参照CRC。目前的建议主要基于回顾性报告和小型II期试验。标准方案(如5-氟尿嘧啶联合奥沙利铂)在SBA中的mPFS为5.9-7.8个月,而在CRC中为9个月。然而,尽管治疗方法相似,SBA患者的预后更差,这可能反映了潜在的生物学差异。例如,CRC中常见的APC突变在SBA中频率较低(75.9% vs 26.8%);在BRAF突变的CRC病例中(约占所有CRC的8%),96%为BRAF V600E突变,而该突变在SBA患者中的频率较低(10.6%)。
这些差异不仅限于突变模式,还包括免疫原性,强调了需要针对SBA进行特异性临床和分子分析,以改善精准医疗。
免疫检查点抑制剂(CPI)治疗在局部和晚期错配修复缺陷型(dMMR)及微卫星高度不稳定(MSI-H)CRC中均显示出持久缓解。尽管SBA中的前瞻性数据仍然有限,但越来越多的证据表明,CPI可能对具有MSI-H、dMMR或高肿瘤突变负荷(TMB-H)等分子特征的肿瘤提供类似获益。SBA中存在活跃的免疫微环境,支持了这种潜在获益——其MSI-H频率(12% vs CRC的7.6%)、dMMR频率(20%-30% vs CRC的12%-15%)更高,且TMB-H(9.5% vs 20%)、PD-1表达(23%)和PD-L1表达(19%)也处于显著水平。虽然这些生物标志物与多种恶性肿瘤中的CPI反应相关,但其预测价值因肿瘤类型而异。鉴于SBA的罕见性,回顾性真实世界研究对于建立证据基础以支持SBA特异性生物标志物驱动的治疗策略至关重要。
为填补数据空白,研究者报告了丹麦某中心接受CPI治疗的SBA患者的结局。为明确CPI适用条件,研究者还分析了在该中心接受治疗的所有SBA患者中dMMR的真实世界频率。
研究结果
研究对象:
2013年1月至2024年1月期间,共有148例经组织学证实的晚期SBA患者在哥本哈根大学医院赫勒夫院区接受姑息治疗。自2019年3月引入CPI治疗以来,该队列中有7例患者接受了CPI治疗。在接受CPI治疗的患者中,原发肿瘤部位位于十二指肠的占71%,且大部分患者(71%)在开始CPI治疗前接受过化疗。最后一次随访时间为2024年8月1日。患者的基线特征详见表1。
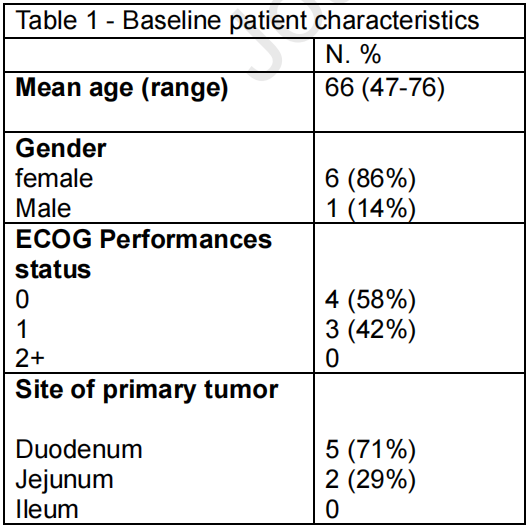
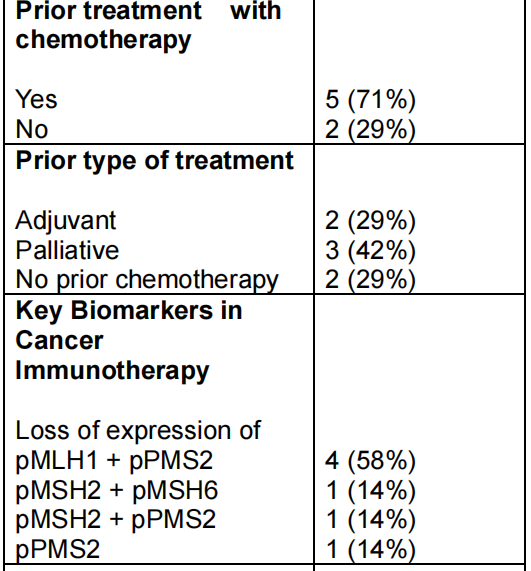
表1
主要研究终点:
CPI治疗的mPFS为31个月[CI:2.73个月-未达到;mFU 32个月],在分析时mOS尚未达到(中位随访时间33个月)(图1和图2)。ORR为86%(7例患者中有6例),其中5例患者(71%)达到PR,1例达到CR。大部分患者(57%)在首次影像学评估(治疗开始后8周)时即观察到治疗应答。

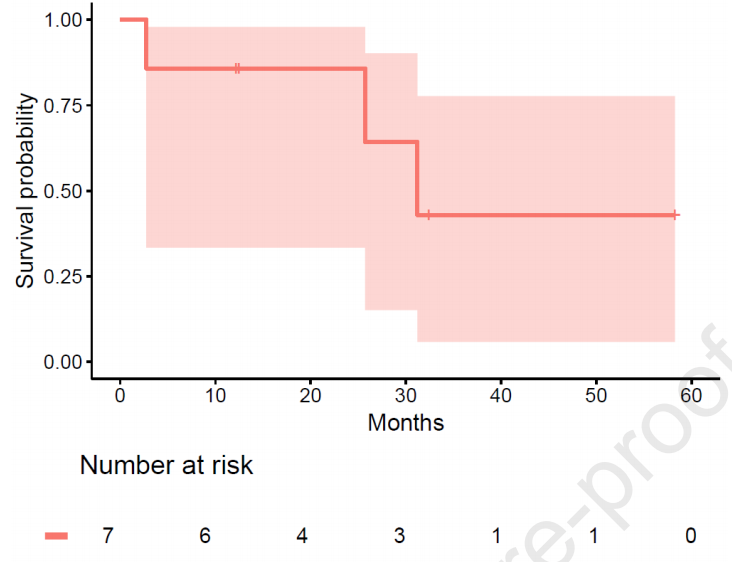
图1

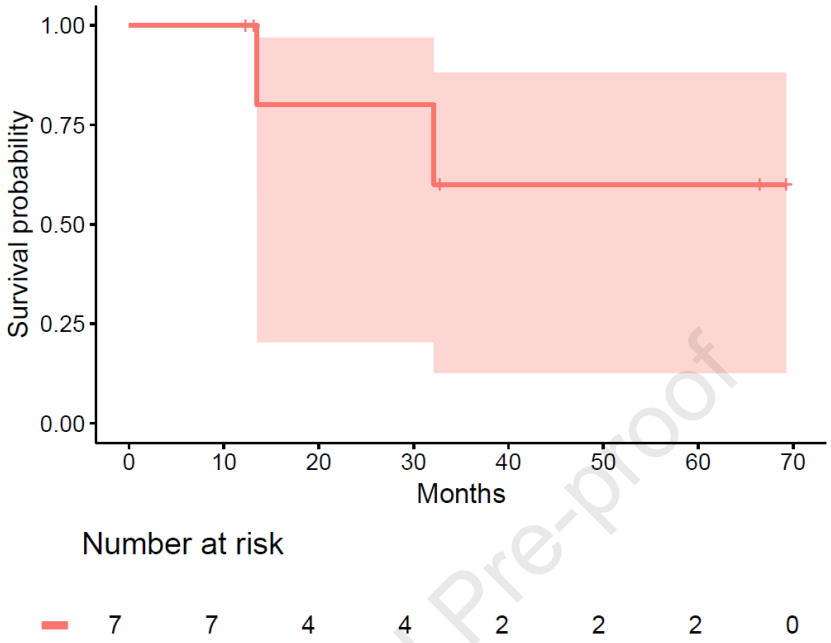
图2
患者1和患者3虽达到PR,但因与疾病进展无关的轻度毒性反应停止CPI治疗。两名患者后续均出现疾病进展,再次接受CPI治疗后均重新达到PR。截至末次随访,患者3仍在接受积极治疗。患者2的最佳治疗应答为疾病进展,随后转为接受其他全身治疗。患者4达到CR,截至最近一次随访仍无疾病复发。该患者因毒性反应在接受1个周期CPI治疗后停药,后续接受12个周期的减瘤化疗,随后进行手术。对切除标本的病理学评估证实达到CR。
患者5在首次影像学评估时达到PR。治疗10个月后,尽管医生建议继续治疗,但患者因疲劳选择暂停治疗。此后的影像学检查显示肿瘤持续缩小,患者仍在随访中,最新一次检查显示疾病稳定。患者6在首次影像学评估时达到PR,截至末次随访仍对治疗持续应答。
患者7是纳入疗效评估的7例患者中唯一确诊林奇综合征(Lynch syndrome)的患者,因十二指肠大肿瘤接受了胰十二指肠切除术,并接受8个周期的卡培他滨联合奥沙利铂(CAPOX)辅助化疗。随访影像学检查怀疑结肠肝曲出现新原发肿瘤,后续经活检证实。患者随后接受了半结肠切除术,后续影像学检查发现小骨盆存在可疑表浅病变,活检证实为十二指肠癌复发。尽管这些表现未达到实体瘤疗效评价标准(RECIST)的疾病进展标准,患者仍接受了10个周期的帕博利珠单抗治疗。治疗期间的影像学评估显示无疾病证据。因轻度毒性反应,患者暂停CPI治疗,在之后一年的CT检查中持续无复发迹象,最终因非癌症相关原因死亡。
7例患者中有3例(42%,即患者1、患者3和患者7)因不良事件停用CPI。其中1例患者(患者4)最终经手术后达到CR,另外2例患者在停药时仅存在毒性反应,无疾病进展。所有7例患者的治疗应答及时间线详见图3。

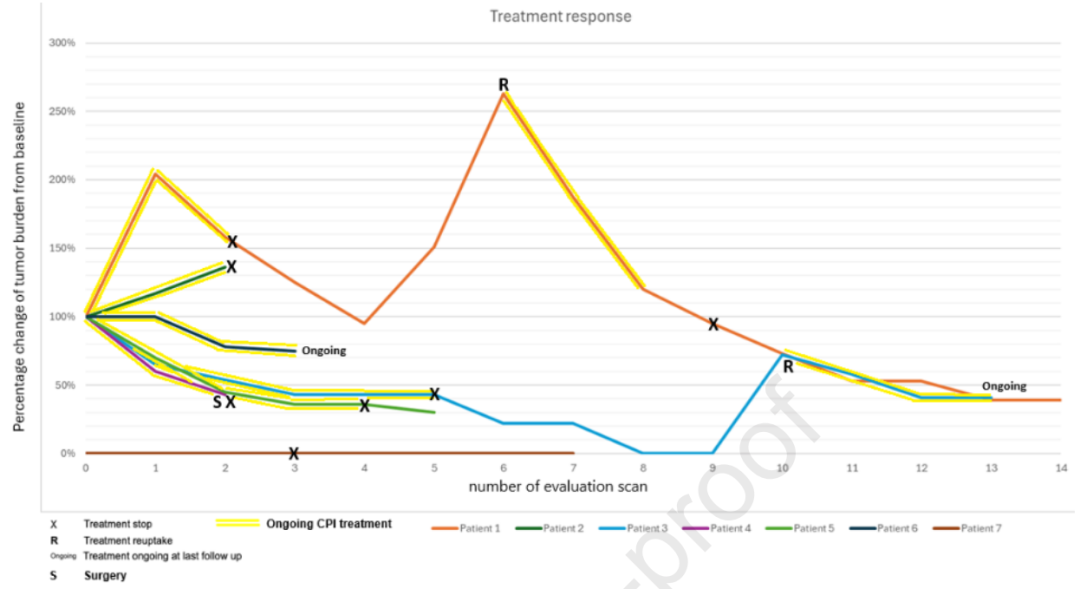
图3
治疗与不良事件:
CPI治疗的中位周期数为11个(范围:1-38个)。中位随访时间为32.43个月(范围:12.16-58.25个月)。
采用《不良事件通用术语标准》(CTCAE)评估不良事件。5例患者(71%)出现1级毒性反应,1例患者(14%)出现3级不良事件。3例患者(42%)因治疗相关毒性反应停用CPI,其中2例患者(28%)因持续存在2级毒性反应而需终止治疗。不良事件及治疗相关数据汇总详见表2。
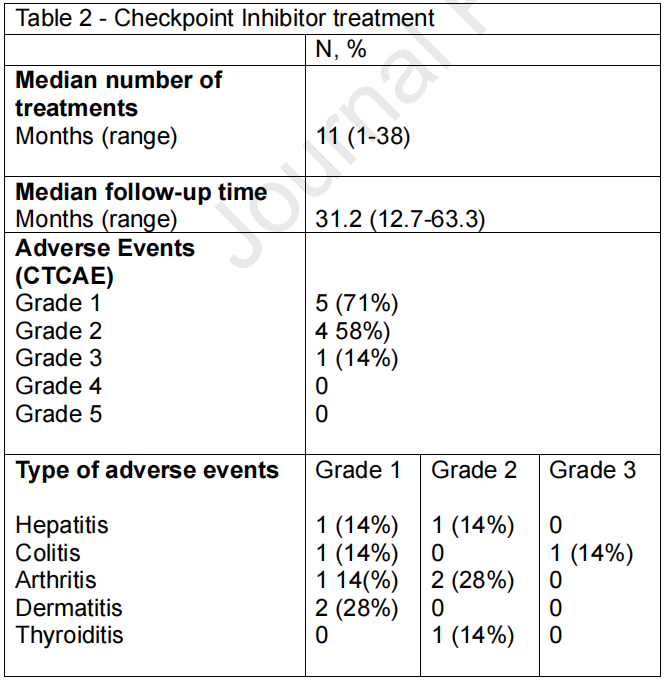

表2
次要研究终点:
7例接受CPI治疗的患者均在当地病理科接受了MMR检测。7例患者中有6例接受了MMR蛋白免疫组织化学染色检测,并辅以基于PCR的甲基化分析;剩余1例患者,病理报告中提及了甲基化分析结果,但未记录具体检测方法。上述检测方法常规用于区分散发性与胚系性MMR缺陷,因此有助于鉴别林奇综合征相关病例与散发性dMMR肿瘤。值得注意的是,接受CPI治疗的队列中有1例患者(患者7)确诊为林奇综合征。
2013年以来,哥本哈根大学医院赫勒夫院区共治疗148例晚期SBA患者,其中82例(55%)接受了MMR检测。在接受检测的患者中,15例(18%)被归类为dMMR型,67例(82%)为错配修复正常型(pMMR)。MMR状态分布情况汇总详见表3。
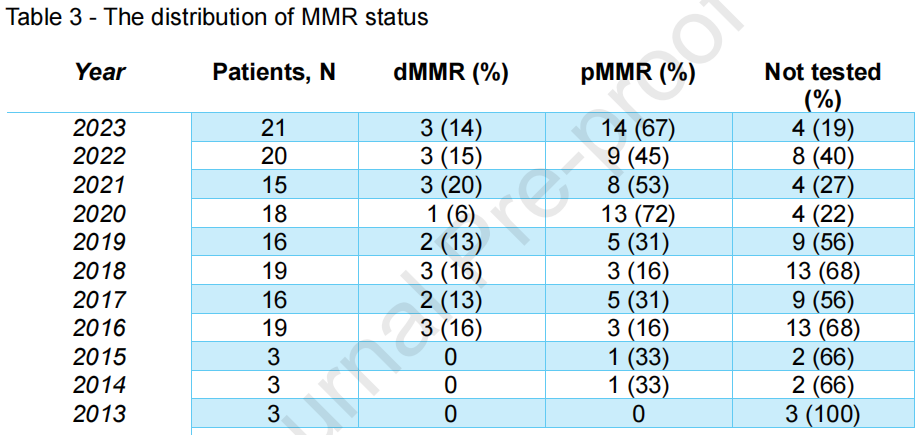
表3
讨 论
本项回顾性真实世界研究表明,CPI治疗在dMMR SBA中具有显著活性,观察到的ORR达86%,mPFS为31个月。尽管这些结果优于已报道的dMMR CRC治疗结局(ORR 43.8%,mPFS 16.5个月),且大幅超过SBA历史化疗疗效(mPFS 5.9-7.8个月),但对这类跨研究比较需谨慎解读。患者选择、治疗场景及肿瘤潜在生物学特征的差异,可能对直接比较结果产生干扰。
然而,在缺乏可靠的SBA特异性前瞻性数据的情况下,这些参考数据为未来研究提供了实用的临床基准。鉴于SBA发病率低且缺乏基于生物标志物分层的试验,临床治疗决策常依赖于从更常见胃肠道恶性肿瘤中推断的结论。本研究结果强调了MMR状态作为SBA中CPI治疗预测性生物标志物的重要性,并为进一步探索CPI在这一罕见癌症群体中的应用提供了依据。
已有多项研究证实,CPI在除CRC外的dMMR/MSI-H胃肠道癌症中同样具有疗效。在KEYNOTE-158试验中,共纳入351例MSI-H/dMMR非CRC恶性肿瘤患者,其中25例(7.4%)为SBA。SBA患者的ORR为48.0%(95%CI:27.8%-68.7%),高于整个队列的30.8%(95%CI:25.8%-36.2%)。在SBA患者中,4例(16%)达到CR,8例(32%)达到PR。整个队列的mPFS为3.5个月、mOS为20.1个月,而SBA患者的结局显著更优:mPFS为23.4个月(4.3个月-未达到(NR)),mOS未达到(16.2个月-NR)。
ZEBRA试验是一项Ⅱ期研究,评估帕博利珠单抗在40例SBA患者(不考虑MMR状态)中的疗效,结果显示ORR为8%,DCR为38%,mPFS为3.35个月。该研究中4例患者确诊为MSI-H,其中2例达到PR且PFS达28.5个月——这表明尽管样本量较小,但在这一基于生物标志物定义的亚组中,患者仍能从治疗中获得显著获益。
在一项探索性Ⅱ期研究中,Cardin等人评估了阿维鲁单抗(抗PD-L1抗体)在5例SBA患者中的疗效,报告DCR为80%,2例(40%)达到PR,其中1例为MSI-H型。近期,Moreau等人开展了一项双向性多中心研究,在133例dMMR/MSI-H非结直肠消化道癌症患者(含36例SBA)中比较CPI与化疗的疗效。结果显示,CPI治疗的ORR显著更高(60.7% vs 26.3%),且PFS显著改善(风险比0.227,P<0.01)。值得注意的是,在单变量分析中,SBA是唯一与疗效改善相关的肿瘤类型;此外,在治疗线数较早时使用CPI,疗效往往更优。
在此背景下,本研究报道了在不同临床场景中接受治疗的真实世界dMMR SBA队列的疗效:ORR达86%,mPFS为31个月。这些结果优于此前报道的数据,提示SBA可能是对CPI治疗应答特别显著的胃肠道肿瘤亚型。然而,样本量较小(n=7)及回顾性非随机设计本身限制了结果的普适性,也反映了dMMR SBA的罕见性。尽管本研究结果显示出良好的临床活性,但应将其视为探索性和产生假说的依据,而非确定性结论。
尽管本研究支持基于生物标志物的治疗策略,但其分子谱分析范围存在局限性。MSI状态、PD-L1表达及TMB未作为常规检测项目,因此无法获取相关数据——这一局限反映了真实世界临床实践中的客观情况,而非这些指标在临床中无关紧要。然而,本研究中此类数据的缺失凸显了当前未被满足的迫切需求,也进一步证明了对SBA进行更广泛分子特征分析的必要性。
在本研究队列中,42%(n=3)的患者因毒性反应或治疗相关负担停用CPI。其中1例患者出现3级结肠炎和2级肝炎,导致永久性停药;经皮质类固醇治疗后症状迅速缓解,且因疾病持续控制未重新启用CPI。另外2例患者停药的原因是累积毒性反应和生活质量考量,而非严重不良事件:1例患者报告持续疲劳,另1例出现轻度免疫相关性关节炎(通过低剂量泼尼松(5mg)控制)。这2例患者的停药决策均由医患共同制定。值得注意的是,其中1例患者在疾病进展后重新接受CPI治疗,截至末次随访仍在治疗中,未再次出现需使用类固醇的情况或限制治疗的毒性反应。所有免疫相关不良事件详见表2。
尽管MMR检测在CRC中已成为标准流程,但目前SBA尚无类似检测策略,且欧洲指南中也未推荐此项检测——尽管此前已有研究主张对SBA进行更广泛的分子评估,且最新更新的美国NCCN指南已将其纳入推荐。在本研究队列中,仅55%的患者接受了MMR检测,这意味着大量可能从CPI治疗中获益的患者或错失治疗机会。在接受检测的患者中,18%为dMMR型,这一比例与此前报道一致,且高于CRC中的dMMR发生率。研究者观察到,该中心内接受MMR检测的患者数量总体呈上升趋势,未检测患者比例从2016年的67%降至2023年的19%(表3)。基于这一趋势、此前报道的dMMR发生率范围(最高达35%),以及本研究和其他研究中观察到的dMMR SBA患者86%的CPI治疗应答率,研究者估计约15%的晚期SBA患者可能从免疫治疗中获益。需注意的是,并非所有dMMR病例均为散发性。
这些发现强调,需对SBA患者进行系统性MMR检测,以识别这一具有重要临床意义的患者亚组。
鉴于识别dMMR肿瘤的临床重要性,研究者强烈主张对SBA患者进行常规的初始MMR检测,且最好在确诊时、启动肿瘤治疗前完成。正如CRC中的标准实践,早期检测有助于及时识别符合免疫治疗条件的患者,并为制定最佳治疗方案提供支持。尽管目前仍存在实际障碍(如报销政策不统一),但随着分子诊断技术日益融入常规临床实践,这些挑战正逐步得到解决。基于本研究及其他研究的结果,将MMR检测纳入SBA的国家和国际指南具有充分的合理性。
尽管dMMR/MSI-H仍是目前公认的SBA中CPI治疗应答的主要生物标志物,但已有数据表明,免疫治疗获益可能不限于这一亚组。在ZEBRA试验和Cardin等人的研究中,部分未确诊dMMR或MSI-H的患者仍观察到CPI治疗应答,这提示可能存在其他预测因素。此外,有报道称相当比例的SBA病例(包括pMMR肿瘤)存在PD-L1表达,且在肿瘤细胞和免疫细胞中均检测到表达,这表明SBA中存在活跃的免疫微环境。这些发现与CRC中的观察结果相似——在CRC中,部分pMMR/微卫星稳定型肿瘤即使不携带已知预测标志物(如TMB-H、POLE突变),也表现出对CPI的治疗应答。综上,这些数据表明,有必要将SBA的分子谱分析范围从dMMR扩展到更多维度,以发现新的生物标志物;同时,通过更精细的患者亚组分类,使更广泛的患者群体从免疫治疗中获益。
本研究结果证实,dMMR是SBA中具有临床应用价值的生物标志物,CPI治疗可带来高应答率和持久获益。尽管如此,MMR检测的应用仍不规范,这可能导致罕见癌症群体错失潜在治疗机会。鉴于近期NCCN指南更新,以及CPI在dMMR以外人群中显示出的治疗活性迹象,应优先推进SBA的常规分子谱分析。更广泛的生物标志物探索(包括TMB、POLE/POLD1突变及免疫谱分析)可能进一步优化患者筛选、扩大CPI治疗适用范围,并为其余患者提供基于分子特征的替代治疗方案指导。这些数据为以下两方面提供了依据:一是开展覆盖所有已获批生物治疗靶点的系统性全面检测;二是开展前瞻性试验,以建立基于生物标志物指导的SBA免疫治疗管理策略。
参考文献:
Døssing, R.H. et al. The value of MMR characterization and efficacy of checkpoint inhibitor in patients with small-bowel adenocarcinomas: a retrospective real-world cohort study. ESMO Rare Cancers, Volume 0, Issue 0, 100030
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)