首页 > 医疗资讯/ 正文
摘要
良性食管狭窄是由多种原因引起消化道管腔缩小的一类疾病,目前首选内镜下治疗,如内镜下扩张、药物注射、狭窄切开、支架置入和干细胞、皮瓣移植等,但目前临床上尚无具体标准或指南对治疗中的扩张内径、次数等一系列具体参数进行量化,这导致临床实践中存在操作者偏倚,患者治疗效果参差不齐。因此本文就目前良性食管狭窄内镜下治疗的进展和存在的挑战进行综述,旨在探讨良性食管狭窄内镜下治疗精准化、标准化的可能性。
前言
良性食管狭窄是由多种原因引起的常见上消化道疾病,根据病因,良性食管狭窄可分为以下几类:先天性发育不良、医源性损伤、摄入相关性损伤、食管炎症、食管外压以及其它病因[1]。食管狭窄的患者通常会出现吞咽困难、胸痛、呕吐等症状进而出现消瘦、营养不良等全身表现,这些症状会严重影响患者的生活质量。目前针对良性食管狭窄的治疗手段主要包括外科手术、放疗和内镜下治疗,其中内镜下治疗因其创伤小,效果确切,已成为良性食管狭窄的一线治疗手段,并且随着内镜技术的飞速发展,目前已有包括内镜下扩张、局部药物注射、内镜下切开、支架置入、干细胞移植、皮瓣移植等技术被应用到临床[2],然而这些技术因为内镜附件的繁多复杂,医生的操作习惯不同等原因,导致目前许多操作的具体参数还未得到量化和统一,从而在临床上呈现出的治疗效果参差不齐,本文就良性食管狭窄内镜下治疗的进展和目前存在的挑战进行综述,旨在探讨内镜下部分手术治疗标准化、精准化的可能性。
一、良性食管狭窄的病理生理
食管是一条从咽部延伸到胃的管道,将食物和水从口腔输送到胃中,从组织学上,食道在横切面上可分为四层;粘膜层、粘膜下层、肌肉层、浆膜层。粘膜层又细分为黏膜上皮层,由非角化的鳞状上皮细胞、固有层和粘膜肌组成。食道肌层包扩内环向和外纵向肌肉两层,由上三分之一的骨骼肌细胞和下三分之一的平滑肌细胞组成,中间为混合物。目前认为食管狭窄往往是多种生物机制并行或交叉级联的结果,纤维化、炎症或EEB损伤并不是诱发食管狭窄的独立个体病因[3]。良性食管狭窄则认为是由于瘢痕组织形成和创面周围纤维化引起的,黏膜下层的生物力学改变和胶原成分的变化也是食管狭窄发病机制的一部分[4]。Doupé 等人[5]研究了小鼠食管伤口愈合的机制,认为参与组织稳态的相同上皮祖细胞在小面积创面的愈合过程中发挥重要作用。但对于较大创面例如大于3/4周的内镜黏膜切除术后,因为黏膜肌层和/或黏膜下腺体的缺失,创面无法通过上述方式顺利愈合,所以通常在术后出现较高的狭窄率。主流的观点认为良性食管狭窄的形成由以下几步构成:第一步是上皮损伤后导致屏障功能的丧失,使黏膜下空间暴露于多种刺激。第二步是局部的多种刺激引起免疫系统的激活,诱发炎症反应促使肉芽组织的形成,包括炎性细胞浸润和栅状血管生成。第三步则是在广泛的食管黏膜损伤后,常驻的成纤维细胞和周细胞在纤维生成细胞因子的作用下分化为瘢痕形成所需的肌成纤维细胞。同时,肌成纤维细胞又通过合成I型胶原蛋白来驱动瘢痕组织形成,这一系列过程最终导致瘢痕组织形成引发食管狭窄的发生。Liu[6]等人在猪模型的实验报告称,如果切除食管上的黏膜,则会形成严重的狭窄,而如果只切开但不切除黏膜,则不会形成食管狭窄。这表明食管黏膜丧失的程度是食管狭窄的关键因素,而不仅仅是食管黏膜的损伤,Rui Wu[4]等人的大鼠模型也支持这一观点。
总的来说,食管狭窄的发生可分为食管上皮屏障结构损伤(EEB)、慢性炎症和严重纤维化三个阶段,其中EEB功能障碍或损伤是导致食管狭窄的起始机制。再上皮化对于食管狭窄的治疗和预防至关重要。对于食管狭窄机制的进一步研究将有助于临床医生或科学家在未来开发出更有效技术。
二、食管良性狭窄的内镜下治疗
01 内镜下扩张
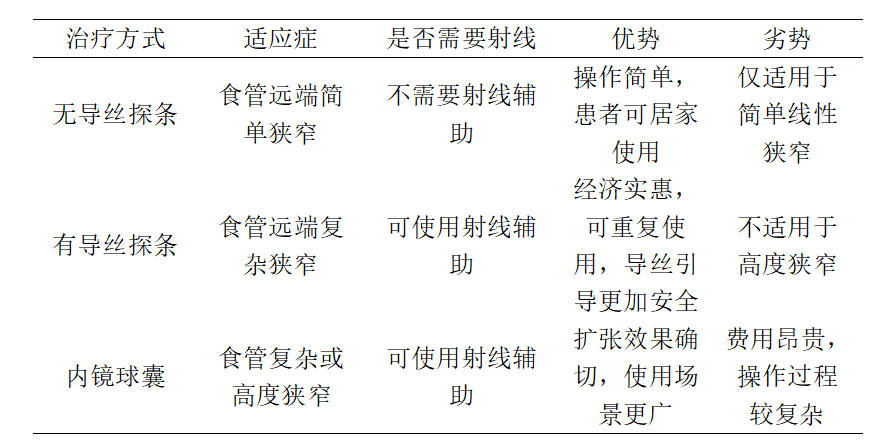
17世纪英国解剖学家和医生托马斯·威利斯爵士首次使用特制的鲸鱼骨扩张食道,治疗了一名严重吞咽障碍的患者[7]。自此之后食道狭窄的扩张治疗经过漫长的演变和改良逐渐成为内镜下食管良性狭窄的一线治疗手段[8],发展至今,该技术变得越来越可视化和精准化,同时伴随着材料学的迅速发展,越来越多的内镜下使用工具应运而生,其中常用的工具包括内镜球囊扩张器、推进式扩张探条以及通条扩张器等等[9]。这些常用内镜治疗工具各有优劣势,现将其总结至表1。
内镜下的扩张治疗是通过刚性物体的膨胀力作用于食管的狭窄处,促使狭窄段的肌层撕裂、松解、扩大已经不同程度缩窄的食管腔, 恢复其通畅性,从而达到缓解和改善患者临床症状的目的。目前临床上主流使用的工具是机械式(探条)扩张器和球囊扩张器两大类。机械式(探条)扩张器又根据是否需要使用导丝和/或透视引导分为两大类,包括不带导丝的Hurst探条、Maloney探条,带导丝的Savary-Gilliard扩张器等;不需要导丝引导的探条内部填充有汞或钨,在重力的作用下,可以通过食管狭窄的部位,这类探条一般呈锥形,并有多种尺寸可供选择,对于位于食管远端的简单狭窄,这类探条效果确切、安全有效,并且可用作患者居家治疗。另一种有导丝引导的扩张器则是在扩张前使用导丝先通过狭窄部分,再通过导丝的引导将扩张探条逐步通过食管狭窄段,从而对病变部位进行扩张,这种方法因为使用了导丝引导所以更加安全,两种探条分别适用于不同类型的食管狭窄,在临床的疗效上并无明显差异。
球囊扩张则是使用球囊扩张器,在胃镜直视引导下(或联合X线)将球囊插入狭窄口,使球囊的腰部位于狭窄部的中央,然后向球囊内缓慢注入生理盐水或造影剂,持续挤压狭窄部位,使该部位发生机械性撕裂以扩大狭窄部位的直径。在操作的过程中,狭窄部位在球囊中心标记为“腰形”或“沙漏形”,并保持该状态直至腰形消失,然后持续数秒至数分钟。如果腰形未完全消失且导管上无血液,则需使用更大尺寸的球囊。如此反复多次,直至到达目标直径。扩张治疗操作的过程中应遵循经典的“三法则”,即在一次扩张过程中最多使用3个机械扩张器,扩张后管腔直径增加不超过3mm[10]。然而“三法则”在临床的实际运用中,并没有如同其“法则”名字一般被严格执行,许多的临床研究证实,单次扩张>3mm,并不会增加其并发症的发生概率[11-13],目前也没有任何单一规则或技术规定食管扩张的最佳方式和程度,唯一的规则是基于临床的判断,根据疾病的性质以及患者本身情况而变化[14]。综上,食管扩张的治疗历史悠久,操作简便,但目前尚未有统一标准对扩张中的持续时间、扩张后的具体直径、球囊或探条使用的选择进行规定,临床上大多根据操作医生的经验或患者的耐受程度来进行判断,所以治疗后的效果存在一定的差异。
表1 食管良性狭窄内镜扩张治疗的常用手段
02 内镜下药物治疗
除了内镜下扩张治疗,目前还可以针对良性食管狭窄的形成过程进行药物干预治疗。
严重的炎症、瘢痕增生和挛缩、纤维化以及过多的胶原沉积都与食管良性狭窄的发生有关,针对这些病因,目前临床上可以使用类固醇激素、他汀类药物、肉毒杆菌毒素A、丝裂霉素 C等药物来治疗。
类固醇激素有强大而广泛的抗炎作用,可减轻炎症早期红、肿、热、痛等症状以及预防炎症后期组织黏连及瘢痕形成。类固醇激素抗炎的机制主要是通过基因效应 (也称基因组效应) 抑制 CHST15 及其调控的 TGF-β1 和 COL Ⅰ的表达从而抑制食管纤维化,起到防止食管狭窄形成的作用[15]。因为长期、大量使用类固醇激素会引发许多不良反应,包括骨质疏松、骨坏死、肌病及免疫抑制等[16],所以临床上可以使用局部注射或局部涂抹组织凝胶的方式来进行预防。相比于口服激素,食管局部注射可有效增加组织内药物浓度,减少全身给药的不良反应,缩短给药周期,提高患者依从性。Hashimoto[17] 等人关于局部多次注射曲安奈德预防食管狭窄的研究,分别在第 3、7 及 10 天注射18 ~ 62 mg 曲安奈德,研究发现,使用局部注射后,食管狭窄发生率可降低至 19%。Yiyang Zhang[18]等受皮肤损伤后使用乳凝胶涂抹治疗的启发,将磷酸铝凝胶与氢化可的松钠琥珀酸盐混合后溶解生理盐水配伍成凝胶口服药,并与局部注射曲安奈德进行随机分组对照,结果发现口服凝胶在预防广泛ESD后的食管狭窄方面显示出更加卓越的效果,其狭窄发生率为9.4%,而注射曲安奈德组为35.5%。
他汀类药物则是通过抑制 TGF-β1 诱导的结缔组织生长因子和 α-SMA 的产生发挥抗纤维化作用[19] ,Yanjuan Wang[20]等人关于比较他汀类药物与多种其他药物在预防ESD术后狭窄的回顾性队列研究认为,他汀类药物是一种潜在的预防ESD后食管狭窄的方法,其效果优于口服皮质类固醇和局部注射曲安奈德。
肉毒杆菌毒素A通过抑制 TGF-β1 的表达促进成纤维细胞内凋亡因子半胱氨酸蛋白酶 -3 的表达,抑制成纤维细胞的增殖,促进成纤维细胞凋亡,从而抑制瘢痕形成[21]。丝裂霉素 C 具有抗纤维化作用,通过抑制长链非编码 RNA-ATB 的表达、上调微小 RNA-200b 的表达,调节细胞凋亡和自噬,从而起到预防术后食管纤维化形成的作用[22]。综上药物预防食管狭窄的主要作用机制在于减轻局部的炎症反应,进而抑制组织的纤维化,达到减轻瘢痕程度的目的,但因长期使用药物存在较多副反应故常不作为单独治疗手段。
03 内镜下放射状切开(Endoscopic Radial Incision,ERI)
2012年,Muto等人[23]报告了内镜下纵向切开术。该方法通过黏膜切开刀对食管良性狭窄区域进行纵向切开,以达到破坏狭窄区域结构扩大管径的目的。Zaharadeen Jimoh等人[24]将放射状切开与内镜下扩张相比较,分析显示,与扩张术相比,接受 ERI 的患者总体狭窄复发的几率降低(OR 0.35,95% CI 0.13-0.92,p = 0.03;I 2 = 71%),且初次狭窄复发的几率降低(OR 0.32,95% CI 0.17-0.59,p = 0.0003;I 2 = 0%)。与单独使用扩张术相比,接受 ERI+扩张术的患者无复发持续时间显著增加(MD 42.76,95% CI 12.41-73.11,p = 0.006),这也证实了这种技术,无论是单独使用还是与类固醇注射、球囊扩张等治疗方法相结合,都有非常好的应用前景,特别是在那些出现严重的吞咽困难及呕吐的患者,通过应用内镜下切开狭窄区域可以更加快速地改善症状。
04 内镜下支架置入
食管支架治疗良性食管狭窄主要运用在难治性或复发性的患者中,根据Kochman等人[25]的对难治性和复发性食管狭窄的定义,它们是指在5周内经过每两周扩张一次的治疗后仍无法达到14mm的目标直径,或者在最后一次扩张后4周内无法维持目标直径。虽然目前认为食管支架对狭窄区域持续的扩张力可能会促使狭窄部位的重塑,但由于其相对较高的不良事件发生率和成本,目前食管支架置入仅作为良性狭窄的二线治疗方法[26]。LU Q等人[27]将食管支架置入与扩张治疗对比,分析发现使用扩张术治疗的患者成功率为 70.9%(55名中的39名),高于使用支架治疗的患者(35%,20名中的7名)。在随访期间,使用扩张术治疗的患者无吞咽困难期为 3.7 个月(95% CI,2.7-5),而使用支架治疗的患者无吞咽困难期为 2.3 个月(95% CI,1.5-3),并且支架置入引起的不良事件比扩张治疗更多,研究中31.6%(6/19)的患者有支架移位,47.4%(9/19)的患者出现支架相关的不良事件,8%(6/75)的患者发生了食管瘘。
目前市面上支架种类繁多,包括不同材质(塑料、金属)、是否覆膜、不同直径和可否降解、是否防位移等不同特性。部分覆膜自膨式金属支架(PCSEMSs)和完全覆膜自膨式金属支架(FCSEMSs)在临床实践中最为常用,但二者因不能在体内永久性的植入所以长时间使用后都可能发生支架取出困难的情况,因此生物可降解支架逐渐受到人们的关注。相对于传统支架,生物支架的优点是可以在植入后6~8周内保持其完整性和径向扩张力,并在11~12周内解体[28],不需要二次移除,另外目前还有生物可降解 PTX-PLGA 涂层镁支架等运用于良性食管狭窄,LIN等人[28]评估了具有 PLGA 涂层和不同浓度 PTX 的 Mg 食管支架与无 PTX PLGA 涂层的支架的体外和体内特性,发现PTX PLGA 支架在径向力方面高于未涂层支架,在酸性介质中降解速度更快,并且在体外实验中有效促进了成纤维细胞的凋亡,在使用 PTX-PLGA 支架的兔模型中,与对照组相比,食管腔增大,食管壁炎症减少。综上,由于支架置入存在各种严重的并发症,以及对于材质的选择目前尚无统一的标准,故此方法更多的应用于恶性食管狭窄,并未在良性食管狭窄治疗中成为一线方法。
05 内镜下干细胞注射和皮瓣移植
近年来,内镜下干细胞注射和皮瓣移植在预防ESD术后食管狭窄的研究越来越多,2012年日本的TAKESHI OHKI[29]团队通过体外培养口腔黏膜组织样本,获得了直径为23.4毫米的上皮细胞片,并通过内镜下移植的方式将工程细胞片成功种植到食管创面处,在随后的内镜随访中创面愈合良好,并没有出现食管狭窄的症状。2018年我国的令狐恩强[30]团队创新性的将患者右侧大腿皮肤移植到术后创面处,并通过支架固定,1月后取出支架。研究观察到移植皮肤的存活率为80%,狭窄发生率为37.5%。自身皮瓣移植为食管狭窄的治疗带来了新思路,通过该方法不仅对于食管大面积病变 ESD术后狭窄提供了新的治疗手段,也为难治性食管狭窄的治疗提供了新的方法,但是如何使用该方法提高难治性食管狭窄治疗的成功率,如何进一步优化和完善该技术均需要相关的基础和临床研究来支持。
除了皮瓣移植治疗目前还有干细胞移植治疗的方法,干细胞作为一类未完全分化、尚不成熟且具有自我复制能力的细胞,具有多潜能性。Lee等人[31]开发了一种可注射且自交联的透明质酸水凝胶(EISCH),并将脂肪来源的干细胞(ADSCs)与之混合,制成EISCH-ADSC混合物。随后在猪模型中进行了详细的对照实验,并在早期、中期和晚期进行食道狭窄的反应评估。实验结果显示,ADSC-EISCH组在预防食管狭窄方面表现出更好的效果。干细胞移植作为一种新的技术尽管只在动物试验中获得初步成功,但相信随着生物技术的快速发展,这种防治ESD术后食管狭窄的新技术将会得到迅速推广和应用。
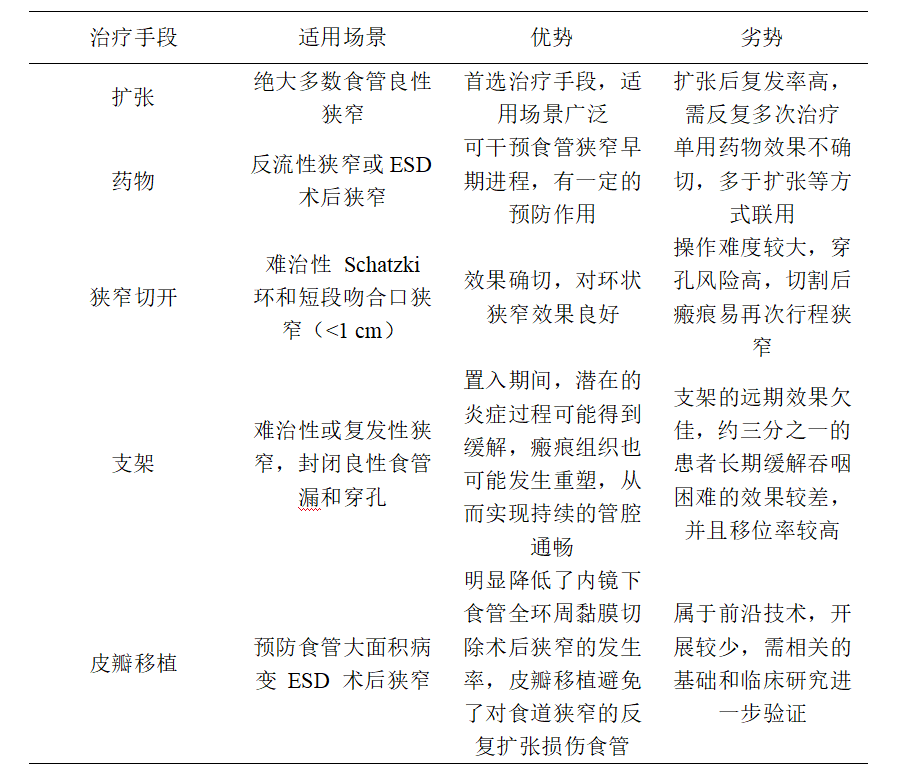
综上,目前内镜下食管良性狭窄的治疗总结在表二。
表2 食管良性狭窄内镜下治疗总结
食管良性狭窄内镜下治疗现状及挑战
目前食管良性狭窄对于胃肠病医生来说,仍然是一项挑战,上文中综述了目前内镜主流的治疗手段,包括扩张、药物、切开、支架、移植等,总的来说,球囊扩张或探条扩张仍是一线治疗方法。对于反流性食管炎引起的狭窄和内镜粘膜下剥离术(ESD)后的狭窄,可考虑扩张联合局部注射类固醇的方法治疗。而对于腐蚀性狭窄,病灶内注射丝裂霉素 C(MMC)可能是一种有效的方案。对于一些经验丰富的医生来说,切开治疗对于Schatzki 环和吻合口狭窄是一种安全有效的方法。食管内支架置入治疗的长期效果令人失望,总体的移位和复发率偏高,所以临床上应仔细考虑并进行个体化选择,同时也应该考虑内镜医生的经验以及患者狭窄的特点。
从操作的细节来看,上述方法大多都缺少客观统一的标准,针对不同患者的治疗方式选择千差万别,甚至同一患者不同的医生选择的治疗手段也不径相同,例如内镜注射治疗在注射剂量、注射部位数量或注射时间等方面的操作方式各不相同,球囊扩张在球囊直径的选择,球囊扩张的压力,球囊扩张的持续时间均没有统一标准,并且关于这些操作过程中的细节研究,例如最佳扩张持续时间、最适宜的压力等均缺少强有力的临床数据支撑。以瑞典为例,该国的扩张时间从30秒到5分钟不等,平均时间为2分钟,并且扩张时球囊的压力没有严格要求,仅凭借医生经验选择,我国使用球囊扩张食道狭窄时通常会根据病情保持压力在3~8个大气压,并且维持2~3分钟,以患者的耐受程度来判断。这导致治疗过程中因为扩张的力度或持续的时间不同可能会出现不同的临床结局,甚至可能导致穿孔、出血等严重并发症。2013年O. Wallner等人[32]将20名有症状的食道良性狭窄患者以随机分组的方式前瞻性地比较球囊扩张过程中10秒充气时间和2分钟充气时间达到扩张后直径为20mm需要的次数,并且对扩张后1周、1月、3月、1年进行随访,结果发现10秒组平均每名患者需要1.4次扩张,2分钟组平均每名患者需要1.5次扩张可以达到预期疗效,这项初步研究表明,10秒扩张时间与2分钟一样有效,同时因为胃镜检查和扩张术的过程中都会让人感到不适,甚至会出现呕吐、疼痛等症状,所以减少扩张持续时间对患者来说是重要且有益的。类似的问题还存在扩张峰值压力和扩张次数等方案的选择,可以说不同的治疗策略可能对患者术后结局是至关重要的。所以目前急需一种精准和可控的方法来辅助临床医生制定治疗方案。
总结与展望
在如今这个精准治疗的时代,通过内镜压力检测或者是压力地图等先进技术对食道狭窄部位进行治疗前判断,提前规划扩张中的压力峰值和持续时间将成为未来发展的趋势。最近功能性腔内成像探头(FLIP)运用于评估食管括约肌功能、食管壁的僵硬程度和食管运动功能取得了较好的效果[33]。FLIP是由一个带有远端气囊的导管组成,气囊内有16对阻抗平面电极和一个固态压力传感器,在内镜检查时FLIP被放置在食管中,通过逐步充气气囊来测量食管腔的横截面积和压力的变化,它可以检测食管腔的直径、体积、压力变化、食管壁的顺应性、食管下括约肌(EGJ)开放动力学、食管下括约肌可扩张性指数(EGJ-DI)、食管壁硬度等参数从而评估食管运动功能、括约肌功能和食管壁的物理特性,对食管相关疾病进行指导诊断和治疗。Monika A Kwiatek等人[34]将功能性管腔成像探头(EndoFLIP)运用于分析嗜酸性食管炎(EoE)患者食管的机械特性,研究纳入了 33 名 EoE 患者和 15 名对照者,通过腔内成像探头发现EndoFLIP 可以成功显示了管状食道的几何形状,并通过压力地图标记狭窄的位置。研究发现在球囊扩张的治疗过程中球囊在到达一定压力后会进入扩张平台期,这时尽管进一步增加球囊内压力,食道的最小横截面积(CSA)仍无变化,这证明球囊扩张的峰值压力是可以通过EndoFLIP来预测的。该研究还发现黏膜嗜酸性粒细胞计数、年龄、性别和当前质子泵抑制剂治疗无法实现这种预测,而EndoFLIP可以为我们提供客观的手段来衡量医疗或扩张疗法的结果。
综上,良性食管狭窄的治疗还存在诸多问题,主要是缺乏有效的结果测量方法来客观地反映组织重塑和纤维化的最终结果。目前临床上主要依赖于影像学和内镜等指标来定性评估食管的纤维化程度和顺应性。但是显而易见的是,这些工具都存在显著的主观性,并且无法测试食管壁的伸展性能,进而无法测量食管腔的压力-几何关系。而目前的EndoFLIP技术可以良好的弥补这项缺陷,相信在未来,会有更多的技术和工具运用于消化内镜,为消化系统疾病的诊治提供更多的帮助。
全文链接:
https://www.wjgnet.com/1948-9366/full/v17/i6/105963.htm?appgw_azwaf_jsc=rnXy89R4M8lh9zOthO_yZqnYtxEilPJa562WuEYSQwY
引证本文:Chen CX, Jin ZA, Yang M, Tang FT, Tang SH. Endoscopic treatment of benign esophageal strictures: Advances and challenges. World J Gastrointest Surg 2025; 17(6): 105963
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)