首页 > 医疗资讯/ 正文
猪心脏移植给人类,这一听起来曾经遥不可及的梦想,随着基因编辑技术的突破,正在逐步变为现实。2022年,全球首次成功完成了基因编辑猪心脏移植到人类的临床案例,标志着异种移植迈入了全新时代。然而,随着技术的临床应用,移植器官所引发的异种免疫反应成为亟需深入研究的焦点。本文将围绕最新发表的一项研究,剖析基因编辑猪心脏移植到脑死亡人类接受者后的早期异种免疫反应,探讨其临床意义与未来挑战。

异种移植背景与基因编辑的突破
异种移植最初被视为解决器官短缺的潜在方案,但长期以来,由于免疫排斥反应和病毒感染风险等问题,临床应用受限。随着CRISPR-Cas9等基因编辑技术的兴起,科学家对猪基因组进行精准改造,去除或修改了10个与免疫排斥相关的基因,极大提升了猪器官与人体的相容性。这不仅推动了猪心脏移植进入临床试验阶段,也为后续免疫反应机制的研究提供了基础。
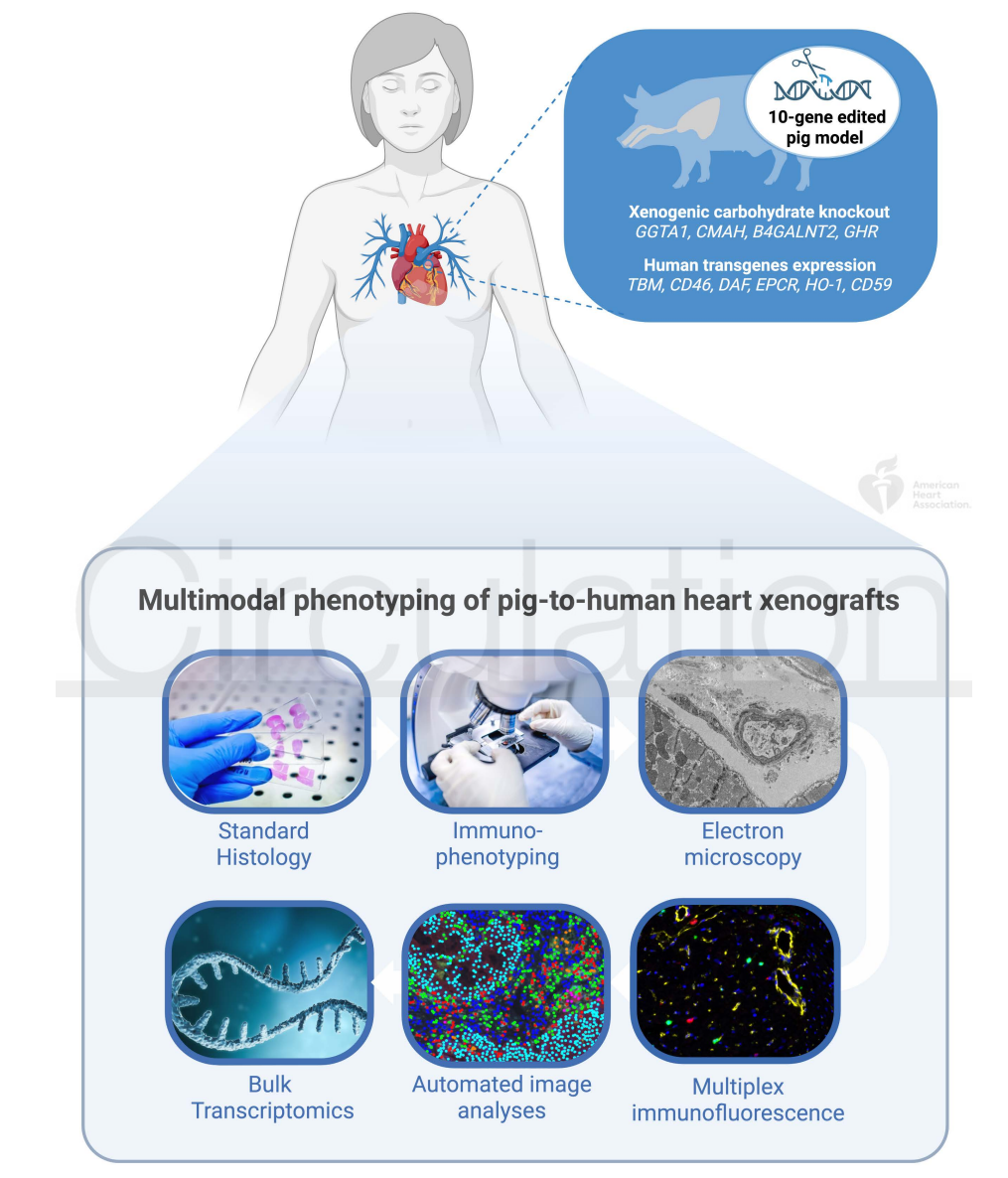
研究设计:多模态精准表型分析
此次研究选择了两例10基因编辑猪心脏移植至脑死亡人类接受者的样本,重点观察术后66小时内的组织变化。研究团队采用多模态表型分析手段,结合形态学评估、免疫表型分析、超微结构观察、自动化多重免疫荧光染色定量及基因表达谱分析,构建了一个层层递进、深入剖析免疫反应的研究框架。
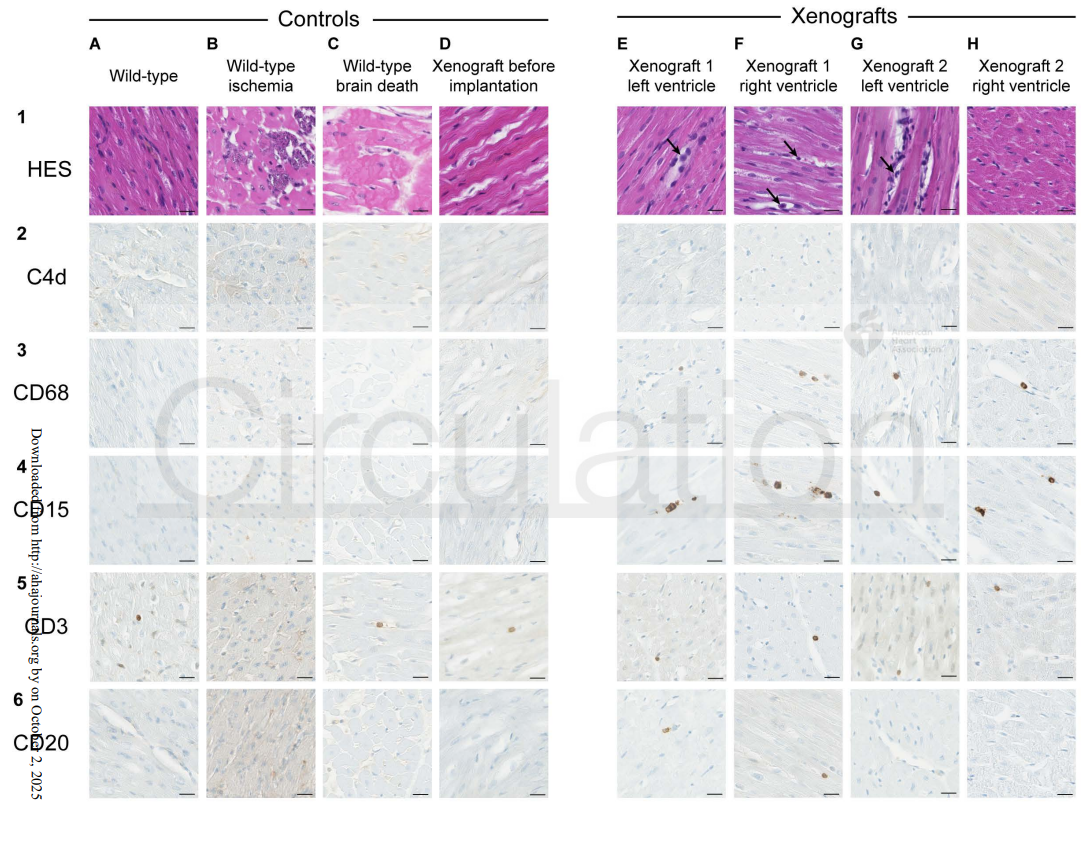
早期异种免疫反应特点:轻度微血管炎与内皮激活
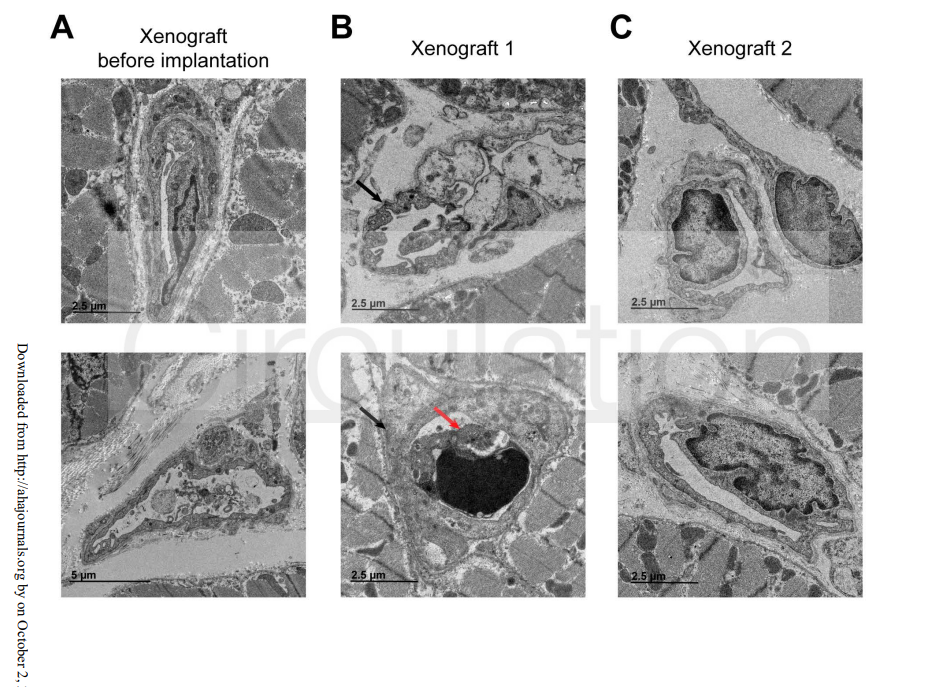
形态学和免疫染色结果显示,移植心脏出现轻度的微血管炎症,主要表现为内皮细胞激活、局部细胞肿胀,以及以CD15+(中性粒细胞)和CD68+(巨噬细胞)为主的先天免疫细胞浸润。值得注意的是,尽管存在免疫细胞聚集,但毛细血管中未见C4d沉积,提示经典的抗体介导排斥反应尚未明显形成。超微结构观察进一步确认了内皮细胞水肿及偶见的血管内白细胞,揭示免疫细胞与血管壁的早期互动。
分子层面:免疫激活通路的显著上调
基因表达谱分析揭示,移植心脏中与单核细胞/巨噬细胞活化、中性粒细胞活化、干扰素-γ反应、自然杀伤细胞负荷、内皮激活、细胞凋亡及组织修复相关的基因通路显著上调。这种综合性分子信号彰显了免疫系统的多方面激活,反映出移植后的复杂免疫微环境。相比之下,对照组包括野生型猪心脏以及有无缺血再灌注损伤和脑死亡条件下的猪心脏,均未表现出上述免疫激活特征,进一步验证了这些变化的特异性。
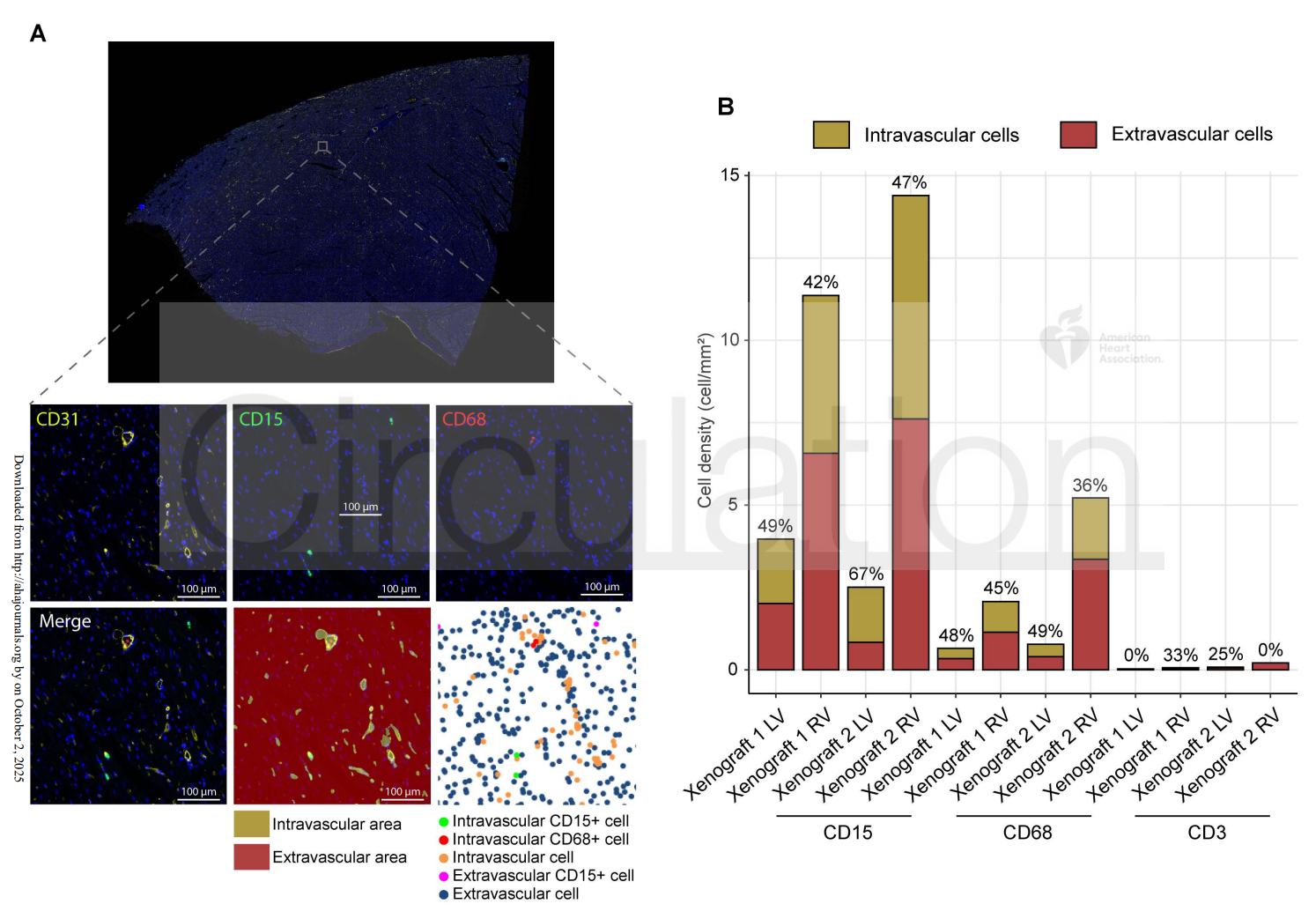
多模态与深度学习技术的创新应用
研究还创新性地引入了基于深度学习的自动化多重免疫荧光分析,精准定位和量化了免疫细胞在微血管中的分布及数量。这不仅提高了数据的准确性和重复性,也为未来临床实时监测移植物免疫状态提供了技术支持。
临床意义与未来展望
这项研究首次系统揭示了猪心移植人类早期的异种免疫反应,强调了先天免疫细胞在异种排斥过程中的重要作用。尽管目前表现为轻度炎症,仍提示未来免疫调控策略需针对单核细胞/巨噬细胞和中性粒细胞等先天免疫成分进行优化。此外,研究中发现的内皮激活和分子标志物可能成为未来精准诊断和预后评估的关键指标。 然而,异种移植依然面临诸多挑战,如免疫排斥长期控制、潜在病毒传播风险及伦理法律问题。未来研究需扩大样本规模,延长观察时间,探索免疫抑制方案的个体化调整,并开发更先进的免疫监测工具。
原始出处
Giarraputo A, Morgand E, Stern J, et al. Characterizing the Immune Response in Pig-to-human Heart Xenografts Using a Multimodal Diagnostic System. Circulation. Published online October 2, 2025. doi:10.1161/CIRCULATIONAHA.125.074971
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)