首页 > 医疗资讯/ 正文
抗菌耐药性已被世界卫生组织列为全球十大公共卫生威胁之一,近年来因耐药性感染导致的死亡人数持续攀升,预计到2050年每年或将导致超过1000万人死亡 。在这一严峻形势下,细菌生物被膜(biofilm)成为耐药性传播与感染复发的关键根源。其致密的胞外聚合物基质、代谢异质性以及群体感应调控,使得传统抗生素难以渗透并彻底清除病灶 。因此,寻找能够突破生物被膜防御、避免抗药性发展的新型治疗手段已成为抗感染领域的核心任务。光热疗法(PTT)和光动力疗法(PDT)凭借可精确控制的时空效应、对代谢状态独立的杀菌机制以及对“休眠型”细胞的杀灭能力,展现出替代或辅助抗生素的独特潜力。
近日,香港中文大学(深圳)理工学院唐本忠,成都大学药学院梅凌,中国科学院大学张鹏飞以及成都中医药大学Yi Qiong等人合作,在Angewandte Chemie International Edition 期刊上发表了一篇题目为“From Light to Cure: Precision Phototherapies for Antibiotic-Refractory Biofilm Infections”的综述文章,系统综述了基于光的抗生物被膜策略,重点介绍了光热/光动力单一与协同治疗的作用机制、材料平台及其与免疫调控、酶降解和抗生素联合应用的前沿进展,旨在探索突破传统治疗局限的新范式。

以细菌生物被膜为靶点
论文首先详细剖析了生物被膜在抗菌治疗失败中的关键作用。细菌生物被膜是由细胞、胞外聚合物和代谢副产物构成的复杂三维网络,它不仅通过物理屏障阻碍抗生素渗透,还营造出低氧、酸性及代谢不均一的特殊微环境,使“休眠型”细胞得以存活。此外,被膜内部的群体感应和胞外DNA促进了耐药基因的交换与稳定存在。这些机制共同导致生物被膜相关感染极难根治,因此,生物被膜被视为新型抗菌策略的首要突破口。
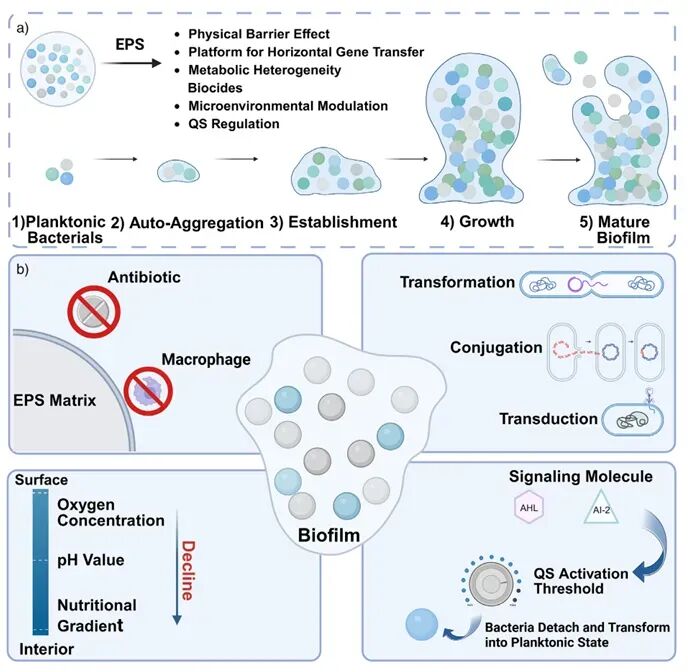
图1:a) 细菌生物被膜的结构与功能;b) 生物被膜介导的抗菌耐药机制 。
光疗在抗生物被膜感染中的应用
在确立靶点后,文章系统阐述了光疗在抗感染中的应用,包括光热疗法(PTT)和光动力疗法(PDT)。PTT依靠近红外光照激发光热剂产生局部高温,破坏细菌膜和胞外基质;而PDT则通过光敏剂产生活性氧簇,造成多层次的氧化损伤。作者指出,两者不仅能独立杀菌,还能克服传统抗生素对休眠细胞无效的局限。近年来,基于纳米平台的智能光疗体系不断发展,实现了药物递送、成像引导和免疫调控的多功能整合,使光疗在精准化抗生物被膜治疗中展现出广阔前景。
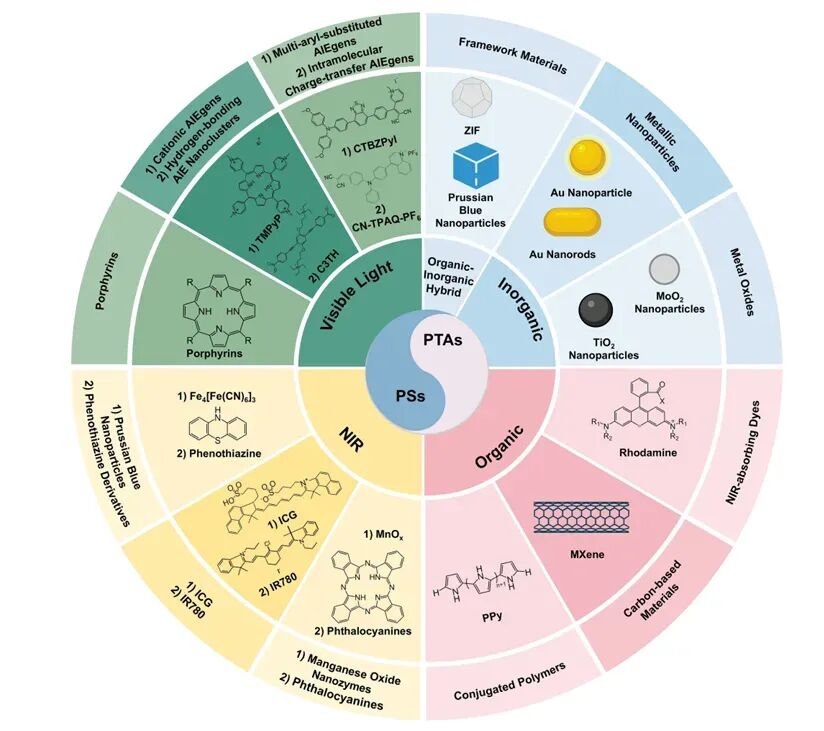
图2:光疗(包括PDT与PTT)的材料基础示意,展示光敏剂(PSs)与光热剂(PTAs)的作用方式 。
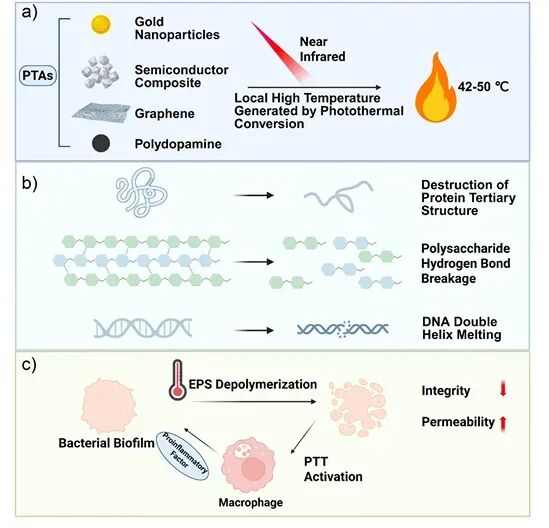
图3:a) 光热剂将光能转化为热能的过程;b) 蛋白质、糖链和细胞膜的热损伤;c) 热效应导致膜通透性增强和细胞死亡 。
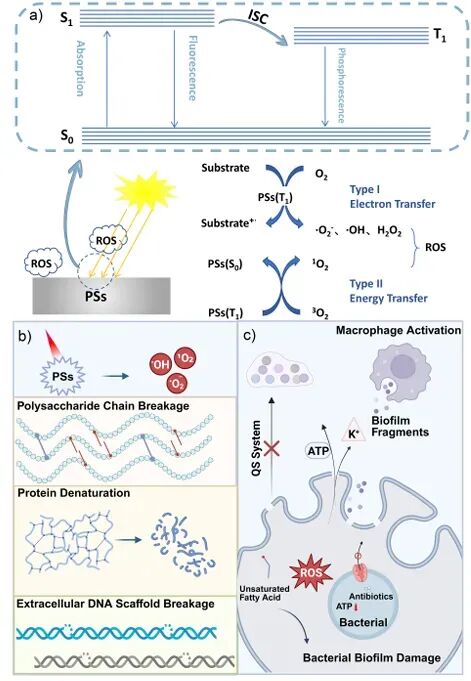
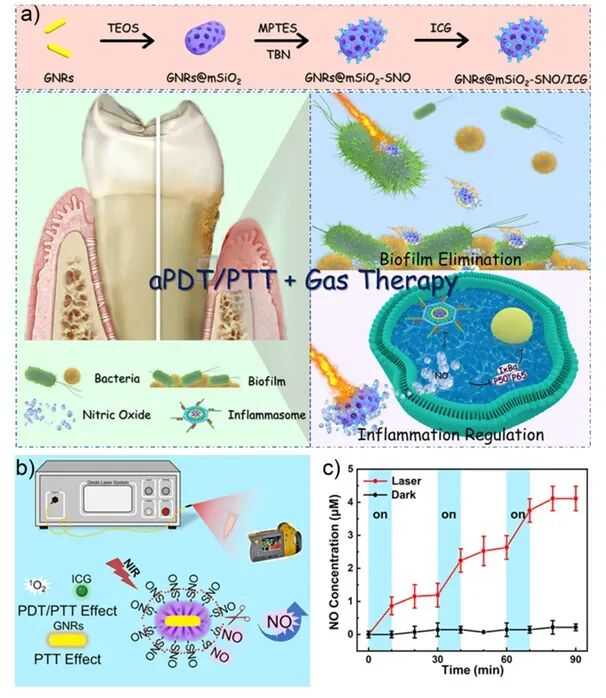
图5:a) GNR@mSiO2-SNO/ICG纳米颗粒的双功能牙周炎治疗设计;b) 光诱导1O2生成与NO释放机制;c) NO在有/无808 nm激光下的开关式释放 。
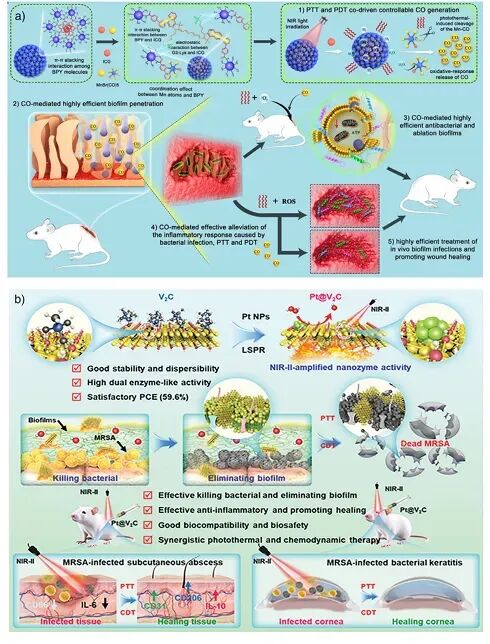
图6:PTT与一氧化碳释放的协同治疗示意(纳米平台在近红外照射下触发CO释放并增强PDT/PTT效应) 。
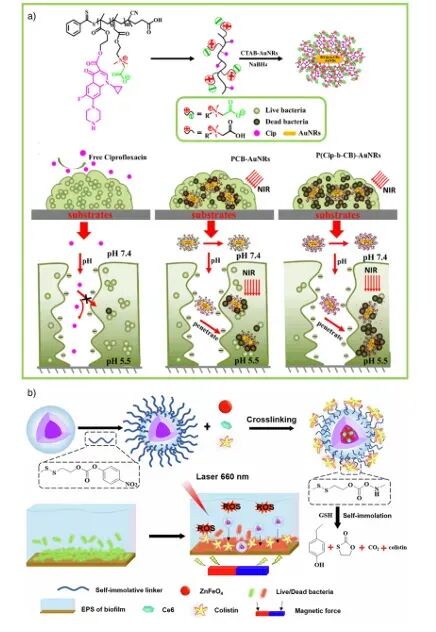
图7:基于P(Cip-b-CB)-AuNRs与Ce6-ZnFeO4@ABCsi胶束的化学-光热/光动力协同抗菌生物被膜治疗示意图 。
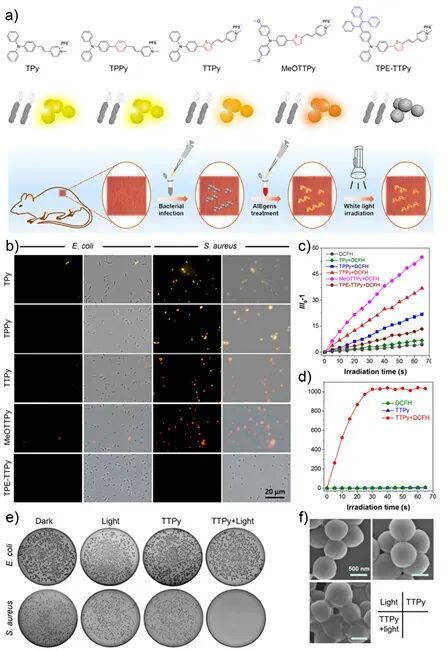
图8:AIE 光敏剂 TTPy 的结构、成像性能及其在感染伤口模型中的光动力抗菌作用。
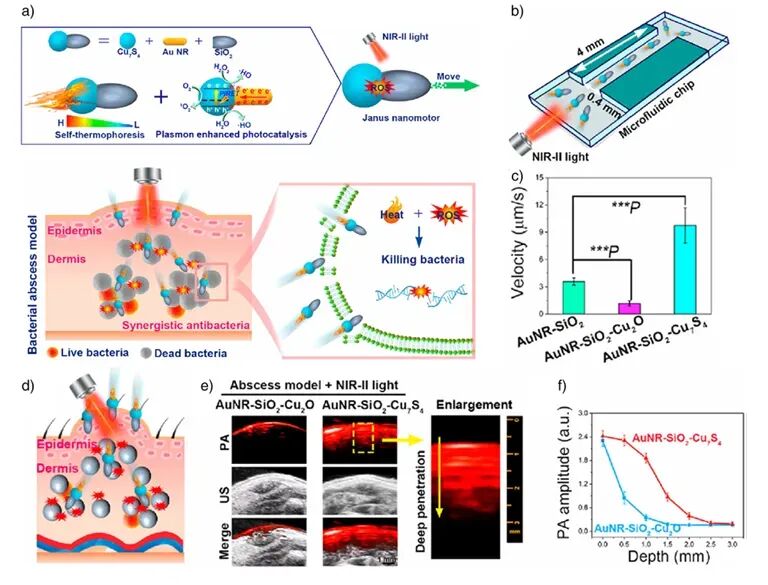
图9:a) 金纳米棒–SiO2–Cu7S4 Janus纳米马达结构与自驱动行为;b) 微流控芯片;c) 不同样品运动速度;d–f) 在小鼠脓肿模型中的穿透与PA成像结果 。
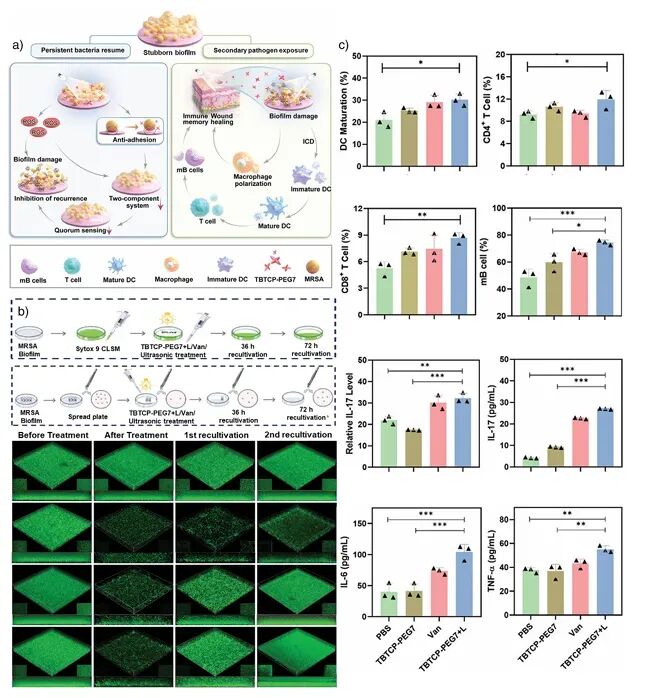
图10:光触发免疫反应增强的实验结果(抗原呈递与树突细胞成熟等) 。
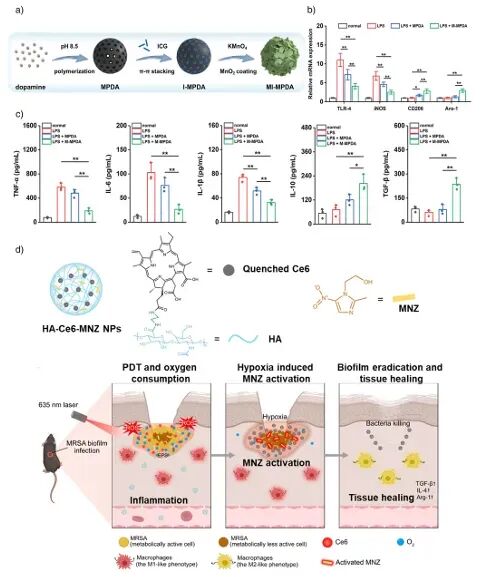
图11:a) MI-MPDA光免疫复合材料的合成;b) M1/M2型基因表达;c) 炎症因子检测;d) HA-Ce6-MNZ纳米平台作用机制
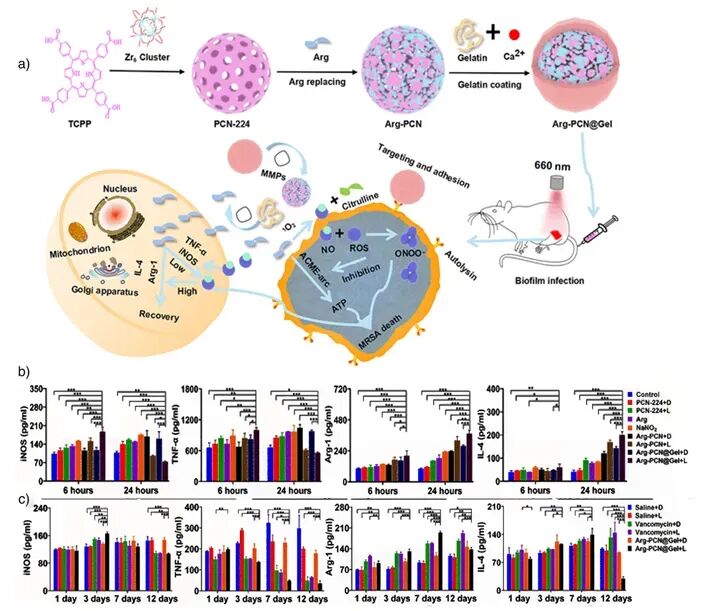
图12:a) 光敏-精氨酸复合物(Arg-PCN@Gel)制备及作用机理;b)–c) 感染细胞中免疫因子的表达分析 【4†source】。
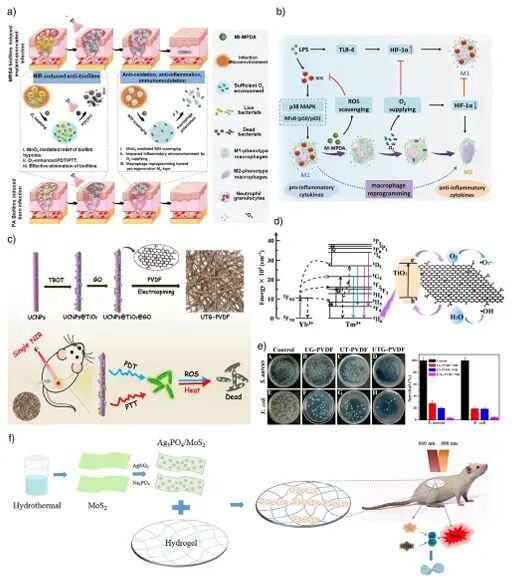
图13: 近红外光响应纳米材料在抗菌和抗炎治疗中的应用示意图
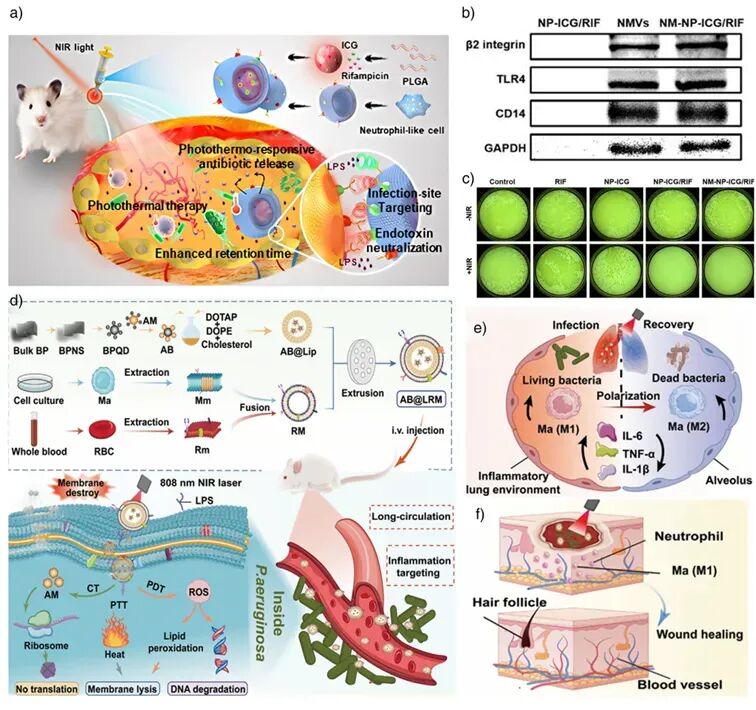
图14: 细菌感染协同治疗的纳米药物载体设计与应用示意图
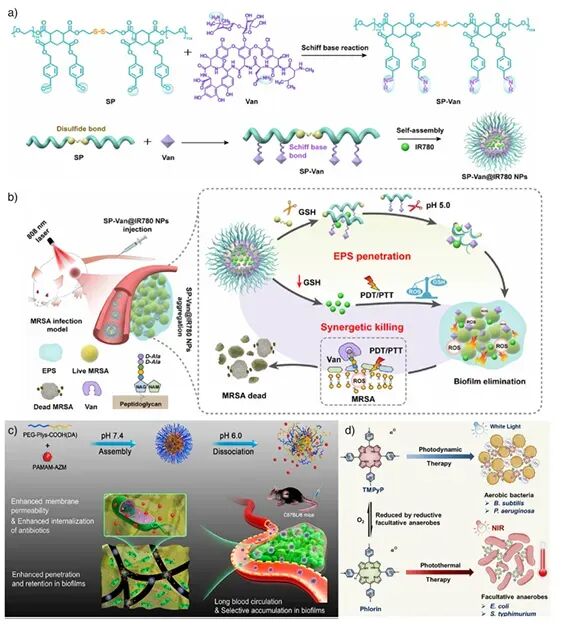
图15:a–b) SP-Van@IR780的合成与在MRSA感染模型中的光-抗生素联合杀菌;c) AZM-DA纳米颗粒的自组装与酸敏释放;d) TMPyP分子在有氧/缺氧条件下的光动力–光热双模治疗 。
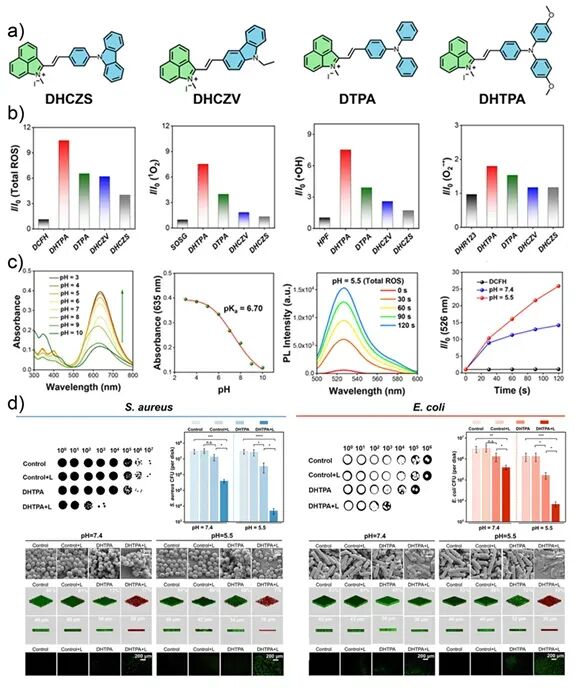
图16:a) AIE光敏剂DHTPA的结构;b) 酸性环境下的能级变化与ROS生成;c) 细菌膜损伤与生物被膜厚度降低;d) 小鼠创伤模型中的治疗效果 。
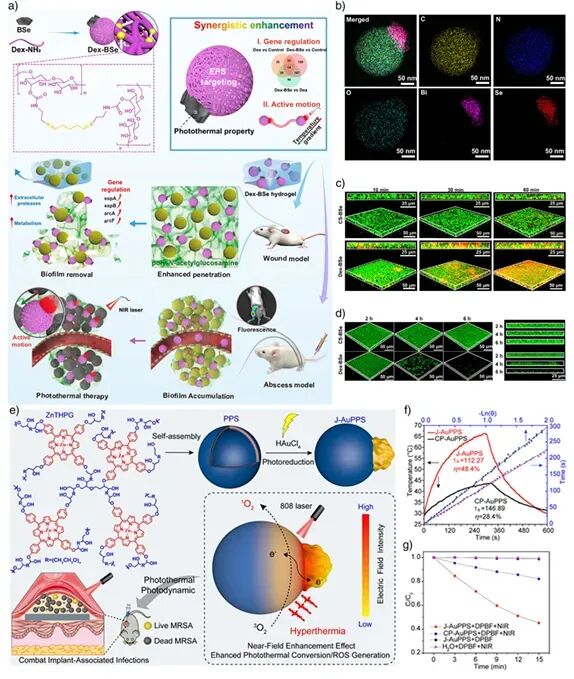
图17:a–g) Janus金-卟啉聚合物纳米结构的制备、形貌与光热–光动力协同抗菌作用,展示其突破耐药生物被膜的潜力 。
临床转化挑战
尽管光疗展现出强大潜力,但其临床转化仍面临诸多障碍。首先,光穿透深度有限,限制了深部感染的治疗效果;其次,部分无机纳米材料存在长期蓄积和潜在毒性问题;此外,光疗设备的标准化、治疗参数的规范化以及大规模制备的成本,都对临床推广构成挑战。作者强调,这些问题需要通过材料改性、使用可降解载体以及跨学科工程手段加以解决,从而推动光疗真正走向临床应用。
【结论】
在总结部分,文章强调了光疗在抗击抗生素难治性感染方面的独特优势。与传统抗生素依赖细菌代谢状态不同,光疗能够精准、快速、低耐药风险地破坏生物被膜和细菌本身。同时,结合纳米技术,光疗已实现与免疫调控和药物递送的深度融合,展现出多模态、个性化的治疗模式。作者指出,光疗不仅是抗感染领域的重要补充,更有潜力成为未来治疗体系的核心支柱。
【展望】
在展望部分,作者提出了未来的发展方向。首先,需要构建更安全、可降解且环境友好的光敏材料,以解决长期毒性与成本问题;其次,跨学科合作至关重要,结合免疫学、材料科学与人工智能,可实现实时反馈和自适应治疗;此外,光疗与免疫治疗的结合有望进一步增强机体防御力,降低复发风险。最终目标是建立智能化、精准化、可持续的治疗体系,为抗生素依赖的传统模式提供全新替代方案。
原文链接:
https://doi.org/10.1002/anie.202510900
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)