首页 > 医疗资讯/ 正文
摘 要
乳腺癌是女性最常见的恶性肿瘤之一,其治疗和管理策略对于改善患者预后和生活质量至关重要。早期乳腺癌指病灶局限于乳房和区域淋巴结(N1期)而未发生远处转移的状态。由于筛查技术的改进,早期乳腺癌检出率提高,“早诊断、早治疗”的模式使乳腺癌死亡率下降,尤其在年轻女性中。2024年欧洲肿瘤内科学会《早期乳腺癌诊断、治疗和随访临床实践指南》旨在为早期乳腺癌的诊治提供全面而标准的建议,帮助临床医生做出最佳决策。本文对该指南主要内容进行简要解读,以期为我国现阶段的早期乳腺癌临床诊疗工作提供参考和帮助。
正 文
乳腺癌是全球女性中最常见癌症之一,发病率高居不下[1-2]。根据是否存在远处器官转移,乳腺癌可分为早期乳腺癌和晚期乳腺癌。晚期乳腺癌指复发或转移性乳腺癌,早期乳腺癌则是相对于晚期更早的发展阶段[3-4]。全程规范化治疗、改善预后及延长生存期是早期乳腺癌管理的主要目标,治疗策略包括术前新辅助治疗、局部治疗及术后辅助治疗[5]。早期乳腺癌具有异质性,因此还需根据不同的分期分型制定相应的治疗策略。本文将以指南[6]原文为基础,对早期乳腺癌的诊治相关内容进行解读。
1 发病率与流行病学
筛查技术的改进使早期乳腺癌的检出率提高。2020年全球癌症统计数据显示女性乳腺癌已超过肺癌成为最常见的癌症,约有230万新增乳腺癌病例,约占所有癌症新病例的近11.7%[1]。2022年全球癌症统计数据[2, 7]显示乳腺癌在新发癌症数量中仅次于肺癌,约230.9万新发病例,占所有癌症新病例的11.6%,在女性中发病率仍居首位。国内2022年乳腺癌在女性恶性肿瘤发病率位居第二,新发病例35.7万例,占比约23.8%[8]。2018—2022年国内乳腺癌的发病人数及死亡人数下降趋势不明显,西方国家中亦是如此,尤其是在较年轻女性中,但乳腺癌仍然是全世界女性因癌症而死亡的主要原因[9]。
2 筛查与诊断
早期乳腺癌筛查对于降低乳腺癌死亡率至关重要,通过简便、经济的检查措施对无症状女性开展筛查,以期早发现、早诊断及早治疗。因种族、生活环境、生活方式等差异,乳腺癌在不同地区间发病风险不同。欧美国家乳腺癌发病高峰为55~64岁[10],因此部分国外指南建议对50~70岁的普通女性进行筛查。研究表明双乳X线筛查能显著降低乳腺癌死亡率。50~70岁女性,通过双乳X线筛查能将乳腺癌死亡率相对降低20%[11-12],若从40岁开始筛查最高可将乳腺癌死亡风险降低50%[13-14]。本指南和ECIBC推荐对50~69岁的普通风险女性每两年进行一次双乳X线筛查;45~49岁和70~74岁的女性也应常规进行双乳X线筛查,虽然获益可能较低;而对于乳腺密度更高的普通女性是否辅以超声或核磁检查尚未达成共识[15-17]。 然而在中国,由于女性乳腺癌的发病时间高峰在45~54岁,且逐渐有年轻化趋势,故国内普通风险女性开始乳腺癌筛查时间更早,通常建议在40岁以上,70岁以下。由于国内年轻女性的乳房腺体更致密,目前以双乳X线联合超声作为主要的筛查方式以获得更高的检出率[6],必要时可辅助磁共振检查。
对于有乳腺癌家族史或已知携带BRCA1/2基因致病性遗传突变的女性,本指南指出应遵循欧洲肿瘤内科学会《关于遗传性乳腺-卵巢癌综合征风险降低和筛查指南》,且必要时应辅以磁共振检查。国内中国抗癌协会、中华医学会肿瘤学分会乳腺癌诊治指南与规范(以下简称CBCS指南)在此基础上将起始筛查年龄提前(<40岁)并提高筛查频率(推荐每6~12个月进行1次乳腺体检,必要时联合乳腺增强磁共振检查)。当常规检查不能提供明确影像学诊断(如多灶性或多中心病灶),或面临携带BRCA1/2基因致病性遗传突变等特殊人群时,建议辅助乳腺磁共振检查,并及时进行相关遗传咨询和指导;对于Ⅱb期及以上(尤其是存在广泛淋巴结受累)或首诊即有较高复发风险的患者应进行远处转移(肝、骨、肺)评估。
早期乳腺癌的诊断需综合临床检查、影像学检查和病理学检查。临床检查通过视诊和触诊,初步判断乳房病变,如皮肤有无红肿、橘皮样变或酒窝征,乳头是否内陷,以及是否存在炎性乳癌或Paget病等可能。影像学检查作为补充手段,有助于进一步明确病变范围。病理学检查是诊断的“金标准”,是判断预后和制定治疗方案的关键环节。本指南与其他国内外相关指南均建议明确早期乳腺癌的病理组织学分型、免疫组化检测指标[雌激素受体、孕激素受体、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)和增殖标志物Ki-67]和分子分型[如luminal A型、luminal B型、HER2阳性和三阴性乳腺癌]。对于HER2免疫组化评分不明确的病例(即评估结果为++)加做荧光原位杂交(fluorescence in situ hybridization,FISH)检测。
3 分期与风险评估
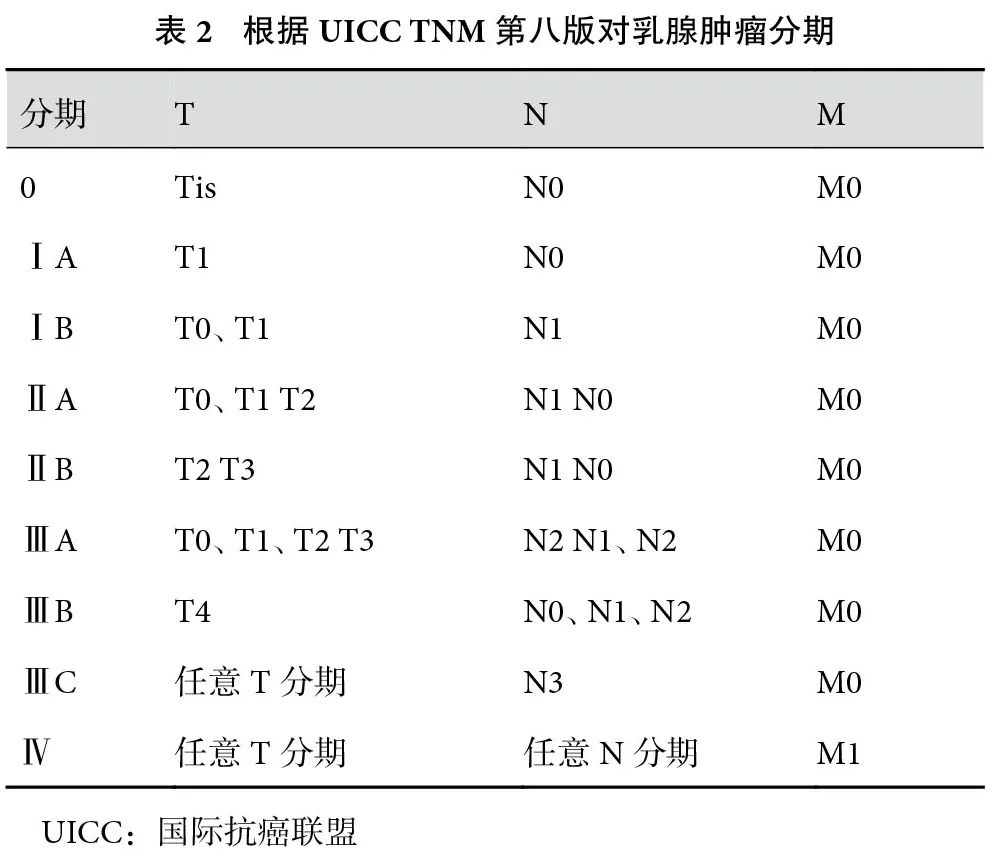
本指南参考国际抗癌联盟(Union for International Cancer Control,UICC)第八版TNM分期,而国内CBCS指南参考美国癌症联合会(American Joint Committee on Cancer,AJCC)第八版TNM分期,二者核心内容几乎无差别;见表1和表2。

4 早期乳腺癌的治疗
早期乳腺癌的治疗应基于患者和疾病的个体差异,在综合考虑肿瘤分期的基础上分析风险-效益,由医生和患者共同做出临床决策。
4.1 局部区域治疗
4.1.1 手术
手术是早期乳腺癌的关键治疗方式,包括乳房病灶切除手术和腋窝分期手术。保乳手术凭借其在切除肿瘤的同时保留乳房外形甚至功能的优势受到广泛认可。本指南推荐当肿瘤大小为T1/2分期且肿瘤与乳房体积比例恰当时可采取保乳手术。术中应完整切除肿瘤与周围一定范围的乳腺组织,确保切缘阴性(导管原位癌保乳手术选择2 mm作为阴性切缘的标准),且须在术腔内瘤床放置钛夹以利于术后放疗区域的定位[18]。对于不符合保乳适应证的患者,也可采取保留乳头乳晕/皮肤腺体切除联合一期/二期假体重建,或联合自体重建。国内外许多研究[19-21]已初步证实乳房重建手术的安全性并证实其术后美容学效果相对于乳房单纯全切得到明显改善,但本指南仍强调,当患者选择植入物乳房重建时需告知其间变性大细胞淋巴瘤的罹患风险[22]。腋窝淋巴结状态是评估早期乳腺癌预后的重要指标之一。对于腋窝分期手术的处理,本指南推荐临床诊断腋窝淋巴结阴性的患者常规行前哨淋巴结活检术(sentinel lymph node biopsy,SLNB),该方法比腋窝淋巴结清扫术(axillary lymph node disp,ALND)有更低的肩部疼痛、麻木肿胀等并发症发生率,其安全和有效性也被多个高质量临床研究证实[23]。临床诊断腋窝淋巴结阳性患者若术前活检也证实阳性则直接行ALND,若活检不明确则仍可行SLNB。若患者未行新辅助治疗,Z0011试验指出采取保乳手术的cN0患者前哨淋巴结活检结果为1~2枚宏转移、微转移或存在孤立肿瘤细胞时,往往术中不需采取ALND[24-25];IBCSG 23-01试验也指出cN0且采取保乳治疗的患者前哨淋巴结活检结果为微转移或存在孤立肿瘤细胞时不采取ALND[26-27],而后续采取全乳放疗与系统治疗;AMAROS试验(既包含保乳也包含全切的患者)也指出cN0患者SLNB结果为1~3枚宏转移、微转移或存在孤立肿瘤细胞时,往往术中不需采取ALND,而后续采取放疗处理[28]。本指南对于术前采取新辅助治疗后的患者若术前转为cN0,则仍可以行前哨淋巴结活检或者靶向腋窝清扫术(targeted axillary disp,TAD),若SLNB或者TAD证实淋巴结为阴性,则可以豁免腋窝ALND,新辅助化疗后SLNB或者TAD结果为宏转移或微转移/存在孤立肿瘤细胞时,ALND往往是标准治疗方案。而对于术前系统治疗后仍为cN+的患者,本指南仍然首先推荐ALND。2025年美国临床肿瘤学会(ASCO)指南更新了SLNB的使用建议[29]:绝经后、年龄≥50岁、术前腋窝超声检查腋窝淋巴结阴性(cN0)、肿瘤分级1~2级、肿瘤最大径≤2 cm、激素受体阳性且HER2阴性的乳腺癌患者,若接受保乳手术可豁免SLNB;接受乳房切除术的临床T分期为T3/T4或多中心肿瘤(临床淋巴结阴性)或导管原位癌的患者;以及肥胖、男性、怀孕或既往接受过乳腺或腋窝手术的患者,仍可推荐SLNB;对于导管原位癌保乳术后的患者,一般不建议常规开展SLNB。此外,对于临床腋窝淋巴结阴性(cN0),肿瘤最大径≤5 cm的浸润性乳腺癌患者,若行乳房切除术且发现1~2个前哨淋巴结阳性时,可豁免ALND并给予术后放疗。2025 ASCO指南在SLNB和ALND的推荐上提出更明确的条件,减少不必要的手术干预,降低手术相关并发症发生率(如手臂疼痛、淋巴水肿、肩部活动受限等),同时减少医疗资源消耗和患者治疗费用。
4.1.2 放疗
原则上接受保留乳房手术的患者均需要接受放射治疗。本指南指出保乳术后的全乳放疗能使10年内的首次复发风险与15年内的乳腺癌相关死亡风险分别降低15.7%和3.8%;瘤床增量放疗(Boost RT)进一步使10年内和20年内局部复发率相对降低41%和35%[30-31],对于部分低风险患者保乳术后部分乳腺短程照射(accelerated partial breast irradiation,APBI)能获得与标准的全乳放疗相当的疗效[32]。然而,2024年版CBCS则指出多项Ⅲ期临床研究结果显示APBI在局部控制率以及美容效果方面仍有一些冲突的结果,建议接受APBI的患者需要经过严格的选择。
全乳切除术后放疗可以使腋窝淋巴结阳性患者的5年局部-区域复发率降低至原来的1/4~1/3;乳房重建术后的辅助放疗参考同期别的全乳切除术后放疗。无论本指南或是其他国内外相关指南均报道自体组织重建对放疗的耐受性优于假体植入重建[6,33],自体皮瓣重建术后放疗后重建失败率<3%,而假体重建由于放疗后组织的血供下降,放疗后假体植入物取出率约为10%,同样2024年CBCS指南也指出自体乳房重建放疗相关并发症发生率较假体重建也更低。
4.2 系统治疗
治疗方案应基于免疫组化结果、分子分型、患者绝经状态等综合考虑内分泌、化疗或靶向治疗等方式,同时还需考虑个体复发风险和对治疗的敏感性。本指南推荐新辅助治疗应在明确诊断和分期后尽快开始(2~4周内最好),辅助治疗应在手术后尽快开始(4~6周内最好)。
4.2.1 HR阳性、HER2阴性早期乳腺癌治疗
HR阳性、HER2阴性早期乳腺癌是最常见的类型,约占全球所有乳腺癌病例的70%。本指南指出手术治疗是大部分此类乳腺癌患者的优先治疗方式,当肿瘤体积较大或淋巴结受累时可考虑新辅助治疗,但病理完全缓解率(pCR)较低。手术后对于中危且淋巴结阴性或者cN1的患者可通过多基因检测来指导术后辅助治疗决策。在内分泌治疗阶段,对于绝经前的女性,本指南推荐高风险患者采取卵巢功能抑制(ovarian function suppression,OFS)联合芳香化酶抑制剂(aromatase Inhibitors,AI)或他莫昔芬,这有助于降低复发风险并提高总生存率。对于绝经后的患者,初始使用AI或在使用他莫昔芬2~3年后序贯使用AI,与单独使用他莫昔芬相比复发风险更低。本指南还指出高危绝经前HR阳性患者可采取OFS联合内分泌药物与CDK4/6抑制剂治疗;绝经后的高危HR阳性患者可采取AI联合CDK4/6抑制剂治疗的治疗策略。对于携带BRCA1/2基因致病性遗传突变和高风险的HER2阴性乳腺癌患者,辅助使用奥拉帕利1年可提高总生存期[34]。
4.2.2 HER2阳性乳腺癌治疗
本指南推荐临床分期为Ⅱ~Ⅲ期的HER2阳性早期乳腺癌患者首选新辅助治疗,以期通过评估治疗疗效指导后续的手术治疗和术后辅助治疗。标准的新辅助化疗方案包括蒽环类-紫杉类药物联合HER2靶向药物[35],然而这些方案存在心脏毒性和继发性急性髓系白血病的潜在风险[36-37]。无蒽环类药物的方案(如卡铂联合紫杉类药物)与蒽环类方案具有相似的疗效,且安全性更高[38]。本指南还指出淋巴结阳性的患者中新辅助化疗联合曲妥珠帕妥珠双靶方案可提高pCR,有效改善预后[39]。国内2024年CBCS指南在此基础上指出N0患者结合风险因素评估也可酌情选择曲妥珠帕妥珠双靶方案。且CBCS指南和ESMO指南均推荐,标准新辅助治疗后的pCR患者应继续接受1年的抗HER2治疗,non-pCR患者则应接受T-DM1辅助强化治疗以改善预后[6,40]。对于未进行新辅助化疗而直接手术治疗的该类患者,本指南推荐分期为pT1 pN0的低复发风险患者可采用紫杉醇类药物联合曲妥珠单抗的治疗方案;淋巴结阴性的患者原则上选择单靶治疗为主,当伴有其他高危因素如肿瘤直径>5 cm时也可考虑双靶治疗;淋巴结阳性的患者推荐优先选择双靶治疗方案并联合紫杉醇类药物和铂类辅助化疗,并在结束靶向治疗后序贯使用奈拉替尼强化治疗。
4.2.3 三阴型乳腺癌治疗
国内指南指出对于分期为T2/N1或更晚的三阴性乳腺癌患者,新辅助化疗是标准治疗方案;而本指南推荐对分期为T1c/N0或更晚的三阴性乳腺癌患者采取新辅助化疗,原因可能是本指南基于广泛的国际多中心临床试验数据,这些试验涵盖了更广泛的患者群体,包括早期(如T1c)三阴型乳腺癌患者,或T1c期患者开始新辅助化疗有更高的pCR。本指南推荐该类患者的新辅助化疗通常以蒽环类药物为基础,再使用紫杉类药物或紫杉联合铂类;铂类药物的获益情况与是否携带BRCA1/2基因致病性遗传突变无关。国内2024版CBCS却指出对BRCA1/2基因致病性遗传突变的患者,可采取蒽环、紫杉与铂类药物三药联合,较蒽环紫杉双药联合是优势性方案。对于新辅助治疗后达到pCR的患者继续完成既定方案;未达到pCR的患者本指南则推荐使用卡培他滨以改善无病生存期和总生存期[41-42],当存在gBRCA基因致病性遗传突变时推荐该类乳腺癌患者使用PARPi如奥拉帕利治疗,目前尚无足够证据表明卡培他滨和奥拉帕利辅助强化治疗何者更优。对于未进行新辅助治疗的该类患者,辅助化疗与新辅助化疗方案无显著差异,通常推荐使用蒽环类序贯紫杉类的方案,对存在BRCA1/2基因致病性遗传突变的患者可在紫杉醇类药物的基础上联合铂类;对于中危及高危风险患者,初始治疗结束之后可选择卡培他滨强化治疗,若患者存在gBRCA突变则选择PARPi如奥拉帕利治疗。免疫治疗在三阴性乳腺癌的治疗中被广泛应用,新辅助治疗时增加PD-1抑制剂如帕博利珠单抗可以提高pCR;术后继续使用帕博利珠单抗可以进一步改善患者的无事件生存期。
5 特殊人群的治疗
本指南指出,由于研究数据有限,目前尚无法为老年乳腺癌患者提供较强的系统治疗证据支持,但评估可行者应使用药物全剂量,且在做出治疗决策前需进行老年病学评估。男性乳腺癌多发生于老年男性中,他莫昔芬是标准的内分泌治疗药物,且考虑到男性乳腺癌患者存在遗传性风险,推荐进行遗传咨询和相关检测[43]。
6 随访
随访旨在了解患者生存状况,评估是否发生复发转移并及时处理治疗相关的副作用和并发症。本指南推荐术后前3年内每3个月进行1次随访(部分预后良好的病理类型或低风险早期乳腺癌患者可适当延长至每6个月1次),第4~5年推荐每6个月1次随访,5年之后推荐每年1次随访;并根据复发风险和患者需求进行调整。在治疗开始前,应与患者讨论治疗导致的早发性绝经和不孕等可能性,对有生育需求的患者进行相应保护。此外还应关注乳腺癌患者在长期治疗中可能存在的包括焦虑、抑郁、睡眠障碍等诸多心理社会问题,提供全面的心理社会支持。
欧洲肿瘤内科学会《早期乳腺癌诊断、治疗和随访临床实践指南》为早期乳腺癌的诊断、治疗和随访提供了全面的指导,临床医生应根据患者的个体特征制定个性化治疗方案,以期获得受益最大化。随着医学证据及治疗策略不断发展,早期乳腺癌的诊治将更加规范和高效。
利益冲突:无。
作者贡献:李田园负责翻译、文献查阅以及论文撰写;朱中建负责文章修改及审阅;杜正贵负责总体设计及文章修改和审阅。
猜你喜欢
- 食管癌的分段和分期
- 成都已完成核酸检测采样110余万人累计追踪到密切接触者504人
- Cureus:银屑病及其与躯体感觉障碍、健康焦虑和抑郁的关系
- iMeta 湖北中医药大学许康/王春莉团队揭示肠道菌群介导乳酸化和丁酰化竞争性修饰调控瓣膜钙化新机制
- SVN:脑卒中前的体力活动与入院血肿量和脑内出血的临床结果相关性研究
- 奥密克戎XBB.1.5在美国高达40.5%,迅速取代BQ.1.1; BQ.1.1和XBB.1在我国占比仍然较少
- 如何做酸菜鱼才好吃?美味酸菜鱼就要这样做
- Eur Heart J-Card Pha:沙库巴曲缬沙坦与心力衰竭患者痴呆风险的关系
- 白线疝是什么,怎么治疗白线疝呢
- 银鱼蒸蛋(6+宝宝辅食)的做法-家常味蒸菜谱
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)