首页 > 医疗资讯/ 正文
摘 要
目的 探讨抑郁障碍和双相障碍患者脑白质网络节点强度的差异,分析患者不同脑区的结构连接受损情况及其在鉴别中的作用。
方法 纳入91例基线诊断为抑郁发作的患者,经过≥9年的自然观察随访后,最终确定23例维持抑郁障碍诊断(单相组)和18例维持双相障碍诊断(双相组)的患者纳入分析。同时纳入30名健康对照者(对照组)。受试者在入组时均接受弥散张量成像扫描,采用确定性纤维追踪技术构建脑白质结构加权网络。比较三组间脑白质网络的节点连接强度差异,进一步采用受试者操作特征(receiver operator characteristic, ROC)曲线评估差异脑区对抑郁障碍和双相障碍鉴别诊断的价值。
结果 双相组在左前扣带回的节点强度较单相组降低(3.89±0.76 vs. 4.74±0.60),在右尾状核(4.94±1.26 vs. 3.46±0.99)、右苍白球(1.98±0.67 vs. 1.25±0.29)的节点强度较单相组升高(P<0.01,FWE校正)。左前扣带回、右尾状核、右苍白球3个脑区的连接强度联合鉴别抑郁障碍和双相障碍绘制ROC曲线,曲线下面积(area under the curve, AUC)为0.95(95%CI:0.91~0.99;P<0.01),敏感度0.89,特异度0.87。
结论 脑结构网络的节点强度差异可以作为一个潜在的影像学生物标志物识别抑郁障碍和双相障碍,联合差异脑区的节点强度可以得到更好的识别率。
关键词 抑郁障碍;双相障碍;弥散张量成像;大脑结构网络;节点强度;ROC曲线;随访研究
心境障碍终身患病率高达7.37%,是精神残疾的首要病因[1]。双相障碍(bipolar disorder, BD)与抑郁障碍(major depressive disorder, MDD)在抑郁发作期症状高度重叠,临床鉴别困难:约75% BD患者以抑郁首诊,8%~15%会后续转相,确诊延迟达5~10年[2-3]。近年来,诸多研究利用脑影像学技术探讨两组疾病的脑影像学机制及差异,但结果一致性欠佳,主要因现有研究多基于横断面设计,无法排除处于BD发病前期的“假单相”患者对结果的干扰,导致生物标志物稳定性不足[4-6]。本研究通过前瞻性长程随访(≥9年)确保样本同质性,基于基线弥散张量成像(diffusion tensor imaging, DTI)数据构建脑白质网络,结合图论[7]分析节点强度,旨在通过纵向设计消除假单相和双相混杂,提高影像标志物可靠性。同时本研究聚焦白质网络节点强度,假设高同质性BD与MDD患者在白质网络节点强度上存在显著差异,探讨差异脑区是否可稳定地用于分类,弥补既往研究对脑结构连接效率关注的不足,为BD和MDD的早期鉴别提供客观影像学依据。
1 对象与方法
1.1 研究对象
患者组来源于2012年12月至2014年12月南京脑科医院抑郁症诊疗中心的住院患者。入组标准:①经简明国际神经精神障碍访谈检查(Mini International Neuropsychiatric Interview, MINI)6.0筛查、诊断,符合《精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, DSM-Ⅳ)双相障碍抑郁发作或重性抑郁障碍的诊断标准;②年龄18~50岁;③汉族;④右利手;⑤首发未用药,或入组前两周内未用药;⑥17项汉密尔顿抑郁量表(17-item Hamilton depression scale, HAMD-17)>24分。排除标准:①既往或现患其他精神障碍;②患有神经系统变性疾病、脑血管病或脑外伤等脑器质性病变;③有酒精、药物依赖或滥用等;④有严重心、肝、肾功能不全或控制不良的重大躯体疾病史;⑤存在磁共振禁忌证。采用纵向随访设计,患者在完成基线入组后均接受≥9年的随访观察。由主治医师及以上职称的临床医师,通过门诊面诊和电话随访相结合的方式,分别在入组时、入组后2个月和9年时进行3次访谈评估,对患者最终诊断进行复核评估。
同期招募健康受试者作为对照组。入组标准:①经MINI筛查,无精神疾病史,焦虑及抑郁自评量表评分正常范围;②年龄18~50岁;③汉族;④右利手;⑤无精神疾病家族史。排除标准同患者组。
本研究经我院医学伦理委员会批准[批准号:(2013)伦审(KY021)号]。所有被试和(或)家属签署知情同意书。
1.2 研究方法
1.2.1 临床评估
所有临床诊断及量表的评估由2名精神科主治及以上职称医师完成,评估人员均经过量表一致性检验培训。使用HAMD-17评估患者入组时的疾病严重程度。
1.2.2 影像学数据采集
所有受试者在基线入组时进行头颅磁共振扫描,采用Siemens Verio 3.0 T超导型磁共振仪。受试者平卧,固定头部以减少头部活动,分别进行结构磁共振序列和DTI扫描。①T1结构磁共振扫描参数:脉冲重复时间/回波时间(repetition time,TR/echo time,TE)1900 ms/2.48 ms,翻转角度9°,层厚1 mm,视野为256 mm×256 mm,矩阵大小为256×256。无结构异常者继续进行DTI扫描。②DTI扫描参数:TR/TE为6600 ms/93 ms,翻转角度90°,层厚3 mm,视野为240 mm×240 mm,矩阵大小为128×128,扩散敏感系数(b值)为1000 s/mm2,共扫描45层,每一层每个方向获取30幅图像,加上b0层45幅图像,共采集1395幅图像。
1.2.3 脑结构网络构建和节点强度属性值计算
①数据在FSL软件包(functional magnetic resonance imaging of the brain software library-FMRIB’s diffusion toolbox)进行预处理,对所有图像进行头动伪影及涡流校正。②基于大脑分区模板(anatomical automatic labeling, AAL)将整个大脑划分为90个区域,即脑网络的节点。③利用弥散工具包(Diffusion Toolkit,http://www.trackvis.org)中的FACT算法进行脑白质纤维重建,纤维跟踪过程中的最小角度设为50 °,纤维最短长度设为3 mm,不同脑区间的纤维连接定义为脑网络的边。④在Matlab平台进一步构建所有样本基于FA加权的无向脑白质连接网络。⑤节点强度属性值计算:采用脑连接工具箱(brain connectivity toolbox, BCT)计算节点强度,在基于分数各向异性值(fractional anisotropy, FA)加权的脑白质网络中,节点强度可用于观测与脑区i直接相连接纤维的受损情况。数据处理流程见图1。
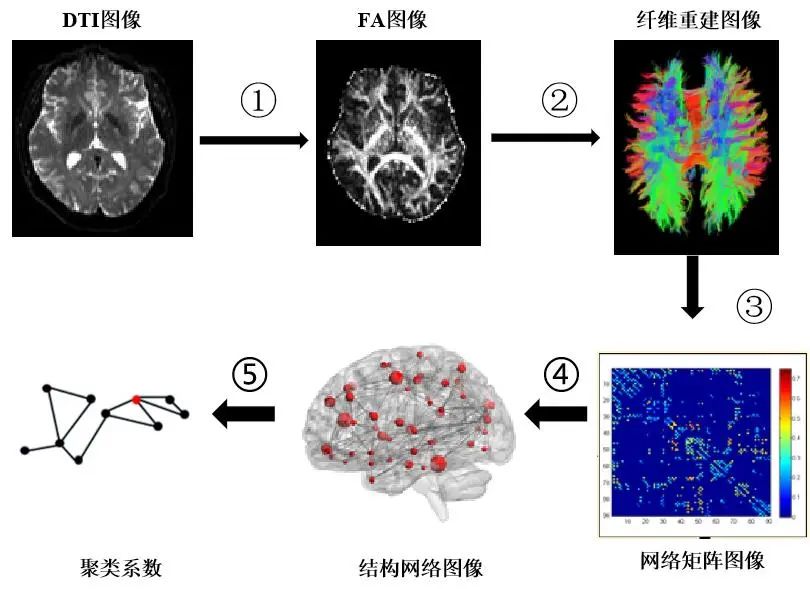
图1 受试者脑白质结构网络构建及网络属性提取流程图Fig.1 Flowchart of white matter structural network construction and property extraction in participants
1.3 统计学方法
使用SPSS 26.0进行统计分析。首先三组间性别、年龄、受教育年限、病程、HAMD-17总分比较使用方差分析(analysis of variance,ANOVA),事后两组间比较采用LSD方法。然后,使用ANOVA对三组间脑网络节点强度属性值比较,用总体错误率(family wise error, FWE)法进行多重比较校正。最后利用差异脑区节点强度描绘单双相组间受试者操作特征(receiver operator characteristic, ROC)曲线,分析脑白质网络作为单双相疾病鉴别的可行性。检验水准α=0.05。
2 结果
2.1 人口学资料
基线入组91例(MDD 68例,BD抑郁发作23例)患者,随访期间37例脱落,5例MDD患者在2个月随访时核实诊断为BD,8例在9年随访时核实诊断为BD,故剔除上述50例。将9年末次随访后复核诊断维持不变的患者分为单相组与双相组。23例(男9例,女14例)MDD患者作为单相组,年龄(32.8±7.5)岁,受教育年限(13.96±3.24)年,病程(2.30±3.89)年,HAMD-17总分(25.70±4.26)分。18例(男9例,女9例)BD患者作为双相组,年龄(28.8±8.8)岁,受教育年限(14.61±2.06)年,病程(4.13±3.92)年,HAMD-17总分(24.33±5.02)分。30名(男17名,女13名)健康对照,年龄(29.80±9.55)岁,受教育年限(14.87±2.24)年。基线入组时,三组间年龄、性别、受教育年限均差异无统计学意义(P>0.05),单双相组间病程、HAMD-17总分差异无统计学意义(P>0.05)。
2.2 脑网络节点强度属性值分析
ANOVA比较三组在不同脑区的节点强度差异,在左侧额中回眶部、左侧前扣带回、右侧尾状核及右侧苍白球存在统计学差异(P<0.05)。两两比较发现,和对照组相比,单相组在左额中回眶部的节点强度降低(t=-3.53,P<0.01),左前扣带回节点强度升高(t=2.43,P=0.02),双相组在右苍白球的节点强度升高(t=3.82,P<0.01);单相组和双相组比较,双相组在左前扣带回白质连接强度较单相组降低(t=-2.43,P=0.02),右尾状核(t=3.12,P<0.01)、右苍白球(t=3.98,P<0.01)节点强度较单相组升高。见表1及图2。
表1 三组间大脑白质FA加权网络节点强度属性值差异Tab.1 Differences in node strength properties of FA-weighted white matter networks among the three groups
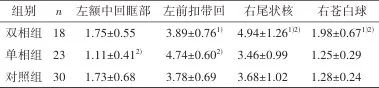
1)与单相组比较,经方差分析,FWE校正,P<0.01;2)与对照组比较,经方差分析,FWE校正,P<0.01。
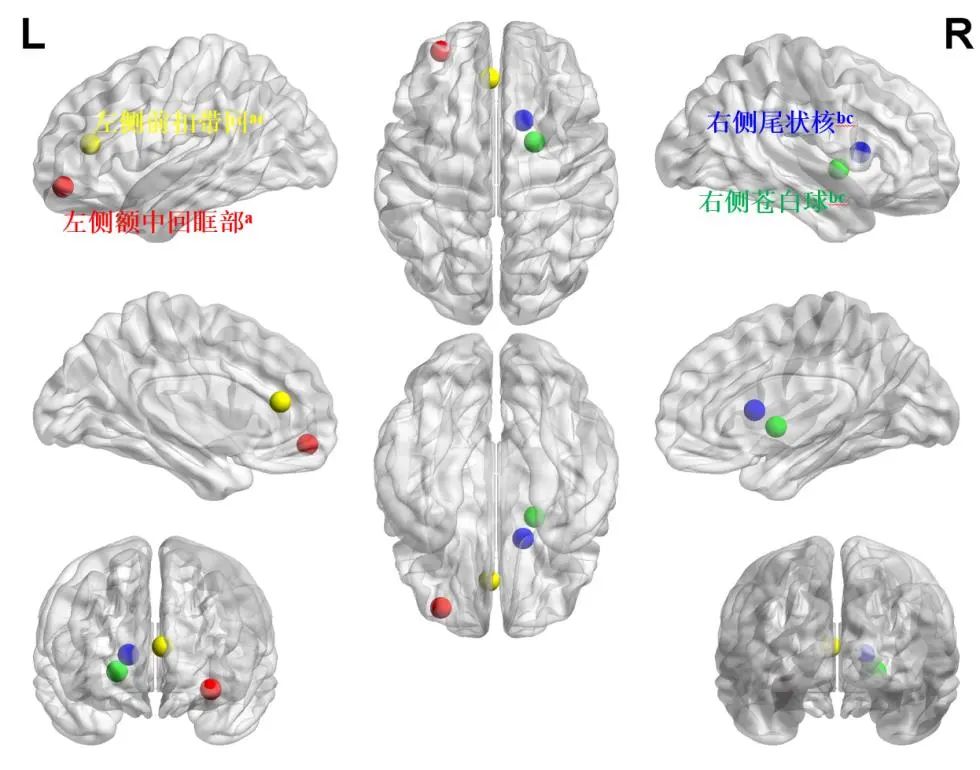
图2 单相组和双相组间节点强度差异脑区 注:L代表左侧大脑半球,R代表右侧大脑半球。红色代表左侧额中回眶部,黄色代表左侧前扣带回,蓝色代表右侧尾状核,绿色代表右侧苍白球。Fig.2 Brain regions with differences in node strength between MDD and BD
2.3 单相组和双相组节点强度属性值ROC
根据差异脑区的脑白质连接强度描绘区分双相组与单相组的ROC曲线:左侧前扣带回曲线下面积(area under the curve, AUC)为0.82(95%CI:0.76~0.88),取最佳截断值(拐点)时敏感度为1.00,特异度为0.57;右侧尾状核AUC为0.83(95%CI:0.77~0.89),敏感度为0.89,特异度为0.65;右侧苍白球AUC为0.81(95%CI:0.74~0.88),敏感度为0.67,特异度为0.91。联合3个脑区的连接强度鉴别MDD和BD,对应的AUC为0.95(95%CI:0.91~0.99, P<0.01),敏感度为0.89,特异度为0.87。见图3。
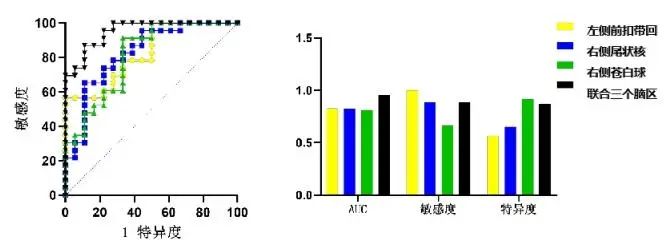
图3 单相组和双相组大脑白质节点强度属性值ROC曲线Fig.3 ROC curves of white matter node strength values between MDD and BD
3 讨论
本课题组前期研究一直关注转双相的患者对于结果的影响,对早期入组的抑郁症患者进行前瞻性纵向随访,结果提示BD在未经历躁狂发作前,即存在可被识别的左侧额下回局部效率的显著下降,且转双相组在基线时即表现出更广泛的白质完整性破坏[8-10]。同时在缓解期验证了MDD和BD患者均显示眶额区连接强度降低,且BD患者的连接降低更为显著[11]。本研究的目的在于进一步补充之前的研究结果,探讨9年随访后诊断维持不变的单相组和双相组在急性期的脑结构网络差异,验证脑白质网络属性的差异是否可以用来鉴别MDD和BD。结果与之前研究相互印证,相对于健康对照,MDD和BD患者差异脑区不同,同时患者组间差异脑区也不同,但都集中在前额叶边缘系统环路,包括左额中回、左前扣带回、右尾状核和右苍白球。
脑白质纤维束作为大脑信息传递的关键结构,其微结构异常在精神障碍发病机制中起重要作用。基于DTI的多项横断面研究证实,MDD、BD患者的大脑半球连接和额叶皮质下神经元回路中白质微结构存在显著异常[12-14],MDD和BD患者存在共同的脑损伤区域,同时也存在明显的损害差异[15-16]。本研究通过FA加权网络分析发现,患者组扣带回节点强度显著升高(单相组>双相组>对照组),提示白质纤维损害作为鉴别疾病的生物标志物的可能。这一发现具有多模态证据支持:结构层面,DTI研究表明,扣带回的网络结构改变在抑郁发作急性期、疾病缓解期患者中均稳定存在[11,16];功能层面,静息态磁共振研究中,连接分析发现BD患者边缘-前额叶连接增强,伴特征路径长度增加等拓扑属性改变,扣带回低频振幅(amplitude of low-frequency fluctuation,ALFF)值升高,提示扣带回区域自发神经活动增强[17-18],深部脑刺激治疗研究提示扣带回可塑性变化可能是治疗响应的神经机制[19];遗传层面,全基因组关联研究结果证实前扣带-杏仁核环路存在特征性基因表达差异[20]。综上,与结构及功能影像、临床治疗等诸多研究结果相一致,本研究在DTI层面验证MDD与BD患者在扣带回区域存在特征性差异脑网络损伤,可以考虑将扣带回作为鉴别两组疾病的神经影像学标志脑区。
本研究显示双相组在右侧尾状核和苍白球之间的节点强度较单相组及对照组均升高(双相组>对照组>单相组),提示纹状体-苍白球环路存在过度连接,双相组可能表现出更严重的网络拓扑结构紊乱。尾状核和苍白球是基底节核心核团,在抑制非目标动作、协调习惯性运动以及规则学习、工作记忆和注意力调节中起关键作用。尾状核功能障碍与BD患者抑郁发作期的动力缺乏、注意力不能集中、快感缺失等症状密切相关[21],功能磁共振研究也提示尾状核和右扣带回之间的功能连接随着奖励幅度的增加而变化[22]。基于体素的meta分析和综述结果提示,BD患者的FA值降低,导致另一网络信息传递指标即最短路径上的效率更高,以补偿这种微结构损害[23-24]。本研究中,双相组基底节环路呈现出显著的连接强度增强,高于对照组及单相组,这一差异提示BD可能涉及更广泛的神经网络功能失调,反映其更为复杂的病理生理机制。MDD患者脑网络小世界属性降低,其异常主要集中于双侧额回及右侧尾状核区域[25],本研究节点强度的区域与该研究相对一致。比较这些神经网络变化,包括双相组的过度连接与单相组的连接下降,有助于鉴别MDD和BD,以早期识别和干预。
神经影像学领域研究长期致力于通过影像特征建模实现单双相障碍的鉴别诊断,探索支持诊断的可靠生物标志物。有研究以多模态结构神经成像特征区分BD抑郁发作和MDD患者,基于DTI的模型达到75%~78%的准确率[26]。既往本课题组利用图论的另一常用指标——局部属性,区分单相抑郁与未经历躁狂发作的BD,得到80%的判别率,提示局部属性指标在鉴别中敏感度不高[8]。本研究利用节点连接强度,结合前期分析筛选出鉴别效能显著的3个脑区(左扣带回、右尾状核、右苍白球),基于模型输出的概率值绘制ROC曲线,计算AUC等指标,模型判别能力提高,初步验证了利用白质纤维作为量化指标可以建立MDD和BD的鉴别模型。这与既往使用不同指标进行分类的研究[27-29]结果基本一致,均验证了基于FA的脑网络属性指标区分MDD和BD的潜力。白质纤维量化指标具有无创、可重复测量的优势,适合作为辅助诊断工具[30]。
本研究存在以下不足之处:样本量相对较小,缺乏大样本的独立数据集构建鉴别模型;虽为纵向研究,但研究的影像学数据仅采集于疾病急性期,未考虑疾病状态对研究结果的影响,脑网络属性改变是稳定的素质性因素,还是疾病影响下的状态性改变,需要结合疾病缓解期的数据,前后验证,以找到稳定的脑网络指标对MDD和BD进行鉴别。
参考文献:
1. HUANG Y, WANG Y, WANG H, et al. Prevalence of mental disorders in China: A cross-pal epidemiological study[J]. Lancet Psychiatry, 2019, 6(3): 211-224.
2. BARYSHNIKOV I, SUND R, MARTTUNEN M, et al. Diagnostic conversion from unipolar depression to bipolar disorder, schizophrenia, or schizoaffective disorder: A nationwide prospective 15-year register study on 43 495 inpatients[J]. Bipolar Disord, 2020, 22(6): 582-592.
3. 崔伟, 于超, 王琳彦, 等.首发抑郁患者转相情况及其影响因素分析:基于7年随访[J]. 中国神经精神疾病杂志, 2025, 51(1): 38-44.
4. DOUCHON A, FAKRA E, HAEASEBAERT F, et al. Early intervention in bipolar affective disorders: Why, when and how[J]. Encephale, 2022, 48(1): 60-69.
5. SIEGEL-RAMSAY J E, BERTOCCI M A, et al. Distinguishing between depression in bipolar disorder and unipolar depression using magnetic resonance imaging: A systematic review[J]. Bipolar Disord, 2022, 24(5): 474-498.
6. HUANG S, WEN X, LIU Z, et al. Distinguishing functional and structural MRI abnormalities between bipolar and unipolar depression[J]. Front Psychiatry, 2023, 14: 1343195.
7. GOÑI J, AVENA-KOENIGSBERGER A, VELEZ DE MENDIZABAL N, et al. Exploring the morphospace of communication efficiency in complex networks[J]. PLoS One, 2013, 8(3): e58070.
8. LIU H, ZHAO K, SHI J, et al. Topological properties of brain structural networks represent early predictive characteristics for the occurrence of bipolar disorder in patients with major depressive disorder: A 7-year prospective longitudinal study[J]. Front Psychiatry, 2018, 9: 704.
9. SUN H, YAN R, HUA L, et al. Based on white matter microstructure to early identify bipolar disorder from patients with depressive episode[J]. J Affect Disord, 2024, 350: 428-434.
10. SUN H, YAN R, CHEN Z, et al. Common and disease-specific patterns of functional connectivity and topology alterations across unipolar and bipolar disorder during depressive episodes: A transdiagnostic study[J]. Transl Psychiatry, 2025, 15(1): 58.
11. LIU H, XIA Y, HUA L, et al. Brain network communication in remission: A comparative study of bipolar and unipolar depression[J]. J Psychiatr Res, 2025, 186: 1-8.
12. ZHOU L, WANG L, WANG M, et al. Alterations in white matter microarchitecture in adolescents and young adults with major depressive disorder: A voxel-based meta-analysis of diffusion tensor imaging[J]. Psychiatry Res Neuroimaging, 2022, 323: 111482.
13. MOHAMMADI S, SEYEDMIRZAEI H, SALEHI M A, et al. Brain-based sex differences in depression: A systematic review of neuroimaging studies[J]. Brain Imaging Behav, 2023, 17(5): 541-569.
14. MARIO A, IVANA L, ANITA M, et al. Inflammatory biomarkers, cognitive functioning, and brain imaging abnormalities in bipolar disorder: A systematic review[J]. Clin Neuropsychiatry, 2024, 21(1): 32-62.
15. ZHOU J, JIANG X, ZHOU Y, et al. Distinguishing major depressive disorder from bipolar disorder in remission: A brain structural network analysis[J]. J Affect Disord, 2022, 319: 8-14.
16. XU Y, CHENG X, LI Y, et al. Shared and distinct white matter alterations in major depression and bipolar disorder: A systematic review and meta-analysis[J]. J Integr Neurosci, 2024, 23(9): 170.
17. GONG J, WANG J, QIU S, et al. Common and distinct patterns of intrinsic brain activity alterations in major depression and bipolar disorder: Voxel-based meta-analysis[J]. Transl Psychiatry, 2020, 10(1): 353.
18. RAI S, GRIFFITHS K R, BREUKELAAR I A, et al. Default-mode and fronto-parietal network connectivity during rest distinguishes asymptomatic patients with bipolar disorder and major depressive disorder[J]. Transl Psychiatry, 2021, 11(1): 547.
19. ALAGAPAN S, CHOI K S, HEISIG S, et al. Cingulate dynamics track depression recovery with deep brain stimulation[J]. Nature, 2023, 622(7981): 130-138.
20. ZANDI P P, JAFFE A E, GOES F S, et al. Amygdala and anterior cingulate transcriptomes from individuals with bipolar disorder reveal downregulated neuroimmune and synaptic pathways[J]. Nat Neurosci, 2022, 25(3): 381-389.
21. BAI Z, LI P, GAO X, et al. Exploring PDE5A upregulation in bipolar disorder: Insights from single-nucleus RNA sequencing of human basal ganglia[J]. Transl Psychiatry, 2024, 14(1): 494.
22. WANG Y, WANG Y, HUANG J, et al. Shared and distinct reward neural mechanisms among patients with schizophrenia, major depressive disorder, and bipolar disorder: An effort-based functional imaging study[J]. Eur Arch Psychiatry Clin Neurosci, 2022, 272(5): 859-871.
23. HU R, STAVISH C, LEIBENLUFT E, et al. White matter microstructure in individuals with and at risk for bipolar disorder: Evidence for an endophenotype from a voxel-based meta-analysis[J]. Biol Psychiatry Cogn Neurosci Neuroimaging, 2020, 5(12): 1104-1113.
24. RAJASHEKAR N, BLUMBERG H P, VILLA L M. Neuroimaging studies of brain structure in older adults with bipolar disorder: A review[J]. J Psychiatr Brain Sci, 2022, 7(4): e220006.
25. HE M, CHENG Y, CHU Z, et al. White matter network disruption is associated with melancholic features in major depressive disorder[J]. Front Psychiatry, 2022, 13: 816191.
26. CALESELLA F, COLOMBO F, BRAVI B, et al. A machine learning pipeline for efficient differentiation between bipolar and major depressive disorder based on multimodal structural neuroimaging[J]. Neurosci Appl, 2024, 3: 103931.
27. CHA J, SPIELBERG J M, HU B, et al. Differences in network properties of the structural connectome in bipolar and unipolar depression[J]. Psychiatry Res Neuroimaging, 2022, 321: 111442.
28. SIARKOS K, KARAVASILIS E, VELONAKIS G, et al. Brain multi-contrast, multi-atlas segmentation of diffusion tensor imaging and ensemble learning automatically diagnose late-life depression[J]. Sci Rep, 2023, 13(1): 22743.
29. NABULSI L, MCPHILEMY G, O’DONOGHUE S, et al. Aberrant subnetwork and hub dysconnectivity in adult bipolar disorder: A multicenter graph theory analysis[J]. Cereb Cortex, 2022, 32(10): 2254-2264.
30. CHEN T, CHEN Z, GONG Q. White matter-based structural brain network of major depression[J]. Adv Exp Med Biol, 2021, 1305: 35-55.
【引用格式】刘海燕,史家波,花玲玲,等.抑郁障碍和双相障碍患者脑白质网络节点强度差异研究[J]. 中国神经精神疾病杂志,2025,51(6):321-326.
【Cite this article】LIU H Y,SHI Ji B,HUA L L.Study on the differences in node strength of white matter networks in patients with depressive disorder and bipolar disorder[J]. Chin J Nervous Mental Dis,2025,51(6):321-326.
DOI:10.3969/j.issn.1002-0152.2025.06.001
猜你喜欢
- Pediatr Crit Care Med:治疗儿童败血症性休克——早期开始肾上腺素输注与传统的液体复苏方法相比是否更有效?
- 运城市荣军医院生化分析仪等设备采购公告
- 【BMT】单倍体移植新型预处理方案:ATLG替代ATG用于非体外去T细胞
- European Radiology:高b值高分辨率DWI在胰腺IPMN检测中的应用
- 输卵管堵塞程度该如何评估
- 面部激素依赖性皮炎的预防
- Public Health:能量饮料消费与儿童青少年健康风险增加有关!
- 狼疮患者吃饭后腹痛、腹胀,竟是肠系膜血管炎在作怪?
- Nature Biotechnology:“五通道”解锁“二十二蛋白”:细胞成像技术迎来指数级飞跃
- 德克萨斯大学王涛Nature Cancer:预测免疫检查点抑制剂治疗结果
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)