首页 > 医疗资讯/ 正文
心力衰竭是一个重要的公共卫生问题,也是现代社会发病率和死亡率的主要原因之一。病理性心脏肥大是心力衰竭的主要危险因素,其特征是心肌细胞增大、蛋白质合成增加、胎儿基因再激活、心脏重塑和纤维化。尽管进行了广泛的研究,但能够有效预防或逆转病理性心脏肥大及心力衰竭的可行性治疗手段仍然有限,亟需开发和探究新的治疗靶点。
2025年7月9日,中山大学药学院刘培庆教授、路静副教授团队在Circulation Research发表了题为“GPLD1 Attenuates Heart Failure via Dual Membrane Localization to Inhibit uPAR”的研究论文。该研究首次系统揭示了GPLD1蛋白在心力衰竭中的分子保护机制,发现GPLD1能够通过与uPAR特异性结合,水解其糖基磷脂酰肌醇锚定结构导致uPAR活性降低从而缓解心力衰竭。研究表明,PI(4,5)P2介导的GPLD1双膜定位机制使其同时分布于细胞膜和线粒体外膜,通过这种独特的亚细胞定位精确调控uPAR的表达水平。这一调控过程有效阻断了uPAR对心肌细胞钙稳态的破坏作用,显著改善线粒体功能障碍,最终减轻心脏收缩功能异常。该研究揭示GPLD1可能成为心力衰竭治疗的潜在新靶点,为开发新型抗心衰药物提供了重要的理论基础。

本研究首先通过生物信息学分析发现,在GSE116250数据集中,GPLD1转录水平在心力衰竭患者中显著上调。为进一步验证这一发现,研究团队通过bulk RNA测序、qPCR及Western Blot检测证实衰竭心肌组织中GPLD1的mRNA与蛋白表达显著增加。为全面评估这一现象的普适性,研究人员在三种经典心力衰竭小鼠模型中进行了系统验证:在压力负荷诱导的胸主动脉缩窄手术模型(TAC)、异丙肾上腺素诱导心衰模型(ISO)以及血管紧张素II (Ang II)输注模型中,均观察到GPLD1的表达一致上调。相关性分析发现,GPLD1水平与心脏功能呈现高度负相关。
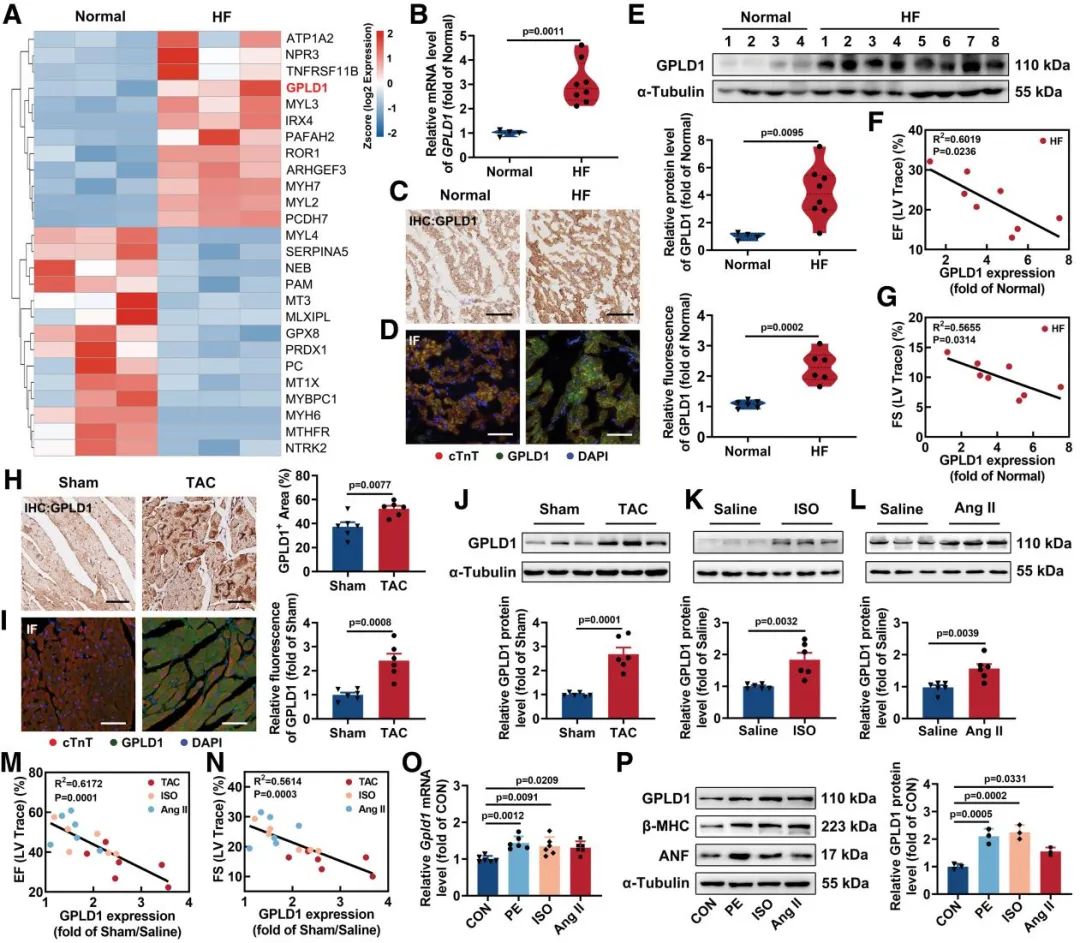
图1. GPLD1在心力衰竭患者和小鼠心脏中的表达增加
为了深入探究GPLD1在心力衰竭中的病理生理作用,研究团队构建了GPLD1心肌特异性敲除(GPLD1-cKO)小鼠。通过超声心动对GPLD1-cKO小鼠的心脏功能进行了连续性监测,结果显示GPLD1-cKO小鼠在12月龄时出现显著的心功能下降。在此基础上进行TAC压力诱导,GPLD1缺失会进一步加重TAC诱导的心脏功能障碍、心肌肥大和纤维化。此外,AAV9介导的外源性GPLD1过表达则可以有效缓解GPLD1-cKO小鼠的心脏功能异常。这一结果表明,GPLD1水平对维持心脏正常生理功能至关重要。
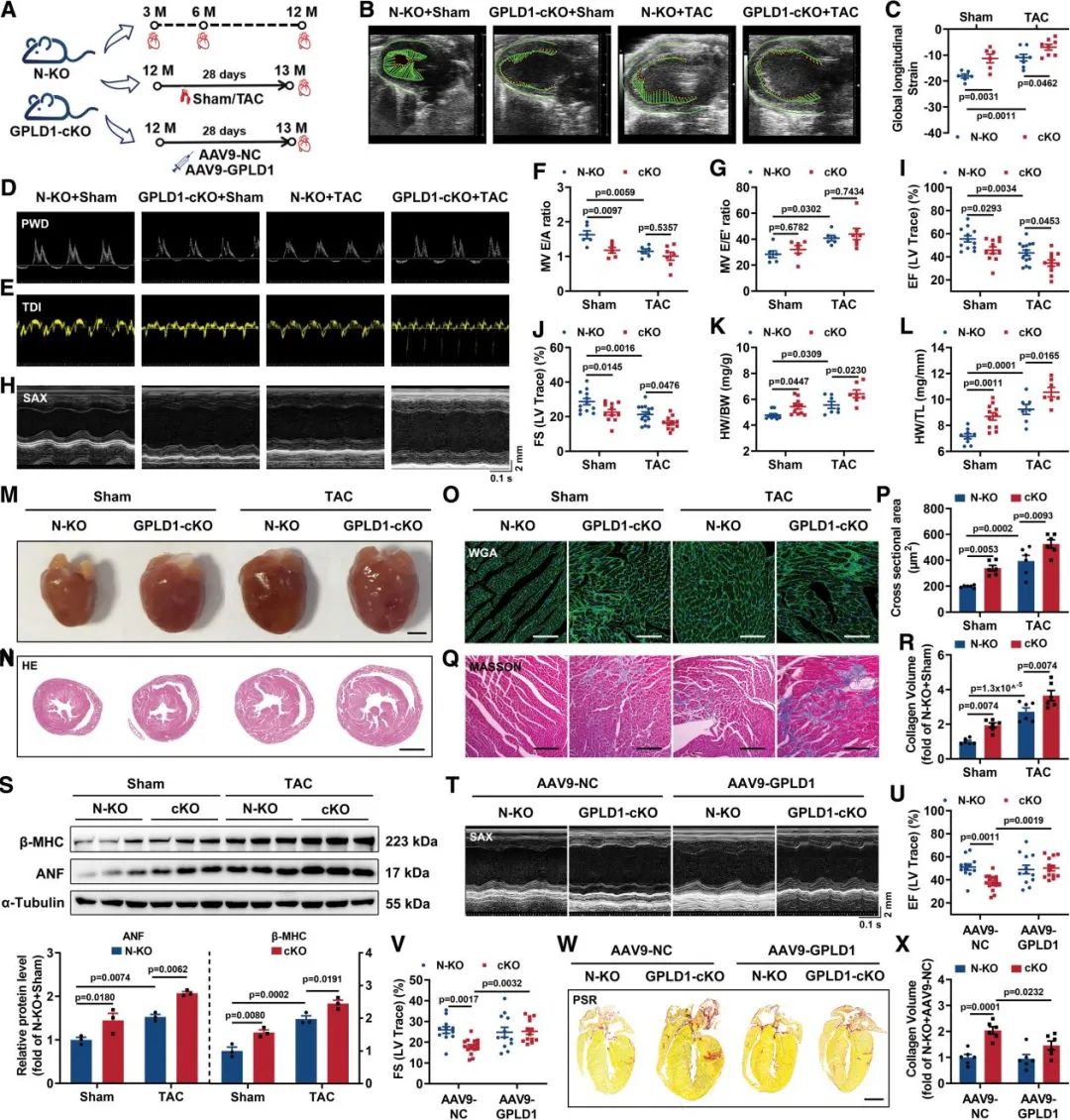
图2. 心肌细胞特异性敲除GPLD1加重TAC诱导的病理性心肌肥大
为了深入解析GPLD1在心肌肥大及心力衰竭中的保护机制,研究人员进一步构建了心肌特异性过表达GPLD1的转基因小鼠(GPLD1-cTg),并将其施用于TAC处理。术后4周,采用纵向应变、脉冲波多普勒和组织多普勒成像的超声心动图技术进行系统评估,结果显示:TAC手术导致对照小鼠出现显著的心脏收缩与舒张功能障碍,而GPLD1-cTg小鼠则显示出明显的心功能保护效应。进一步形态学和组织学分析表明,GPLD1过表达显著抑制了TAC诱导的病理性心脏扩大、心肌肥厚标志物表达上调以及心肌纤维化。这一系列实验数据从功能学和形态学双重角度证实,心肌特异性高表达GPLD1能够有效预防压力超负荷导致的心脏肥厚进展,为病理情况下GPLD1的心脏保护作用提供了确凿的功能性证据。
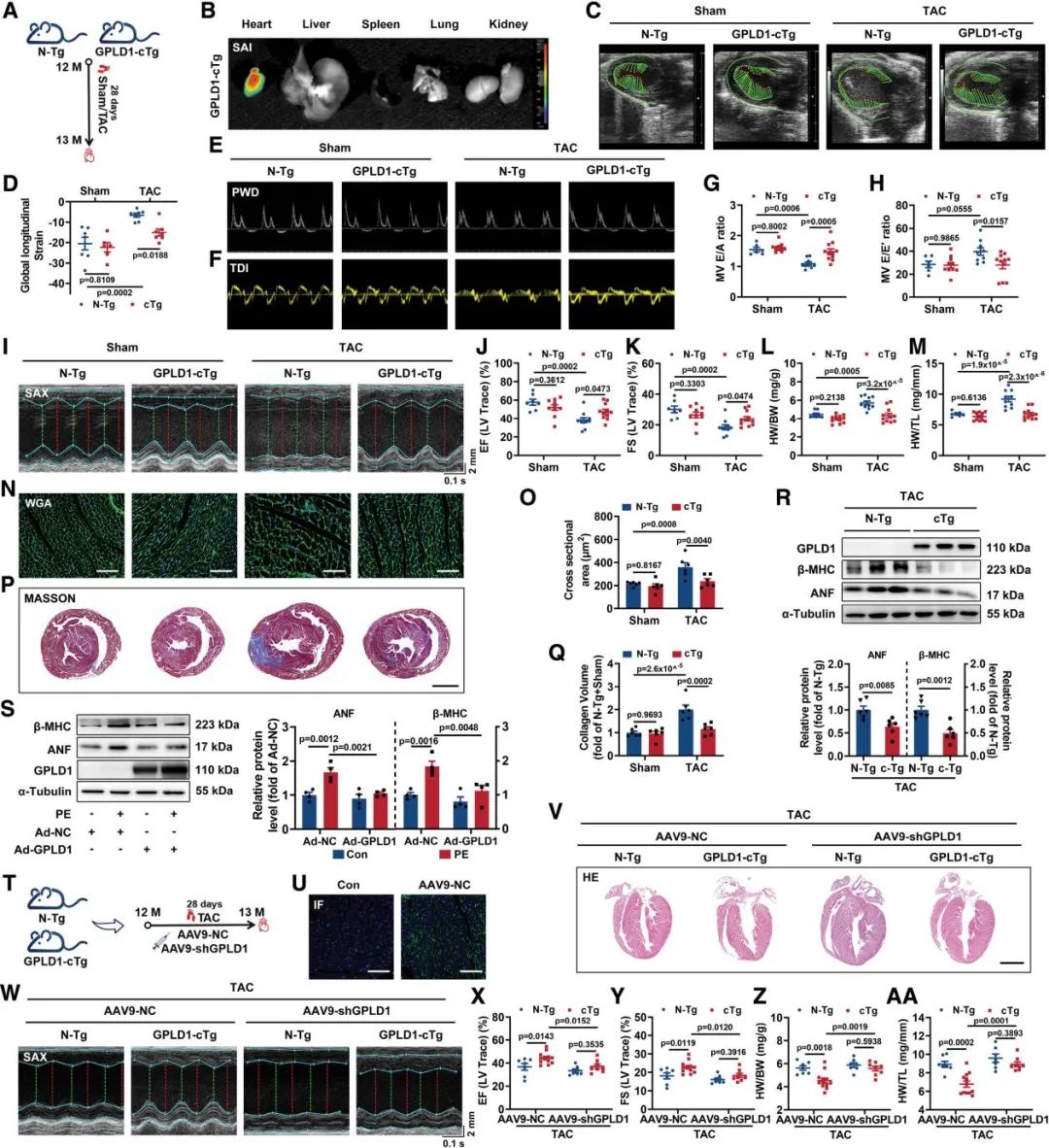
图3. 心肌细胞特异性过表达GPLD1改善HF小鼠的心功能损伤
为阐明GPLD1酶活性在心脏功能调控中的关键作用,研究团队构建了His133位点突变的转基因小鼠模型(GPLD1H133N)。实验观察到12月龄GPLD1H133N小鼠表现出显著的心功能异常,通过AAV9-GPLD1基因治疗可明显改善其心脏功能障碍。组织学分析显示,GPLD1H133N小鼠在12月龄时出现明显的心肌肥厚表型,表现为心肌细胞横截面积增大,心肌纤维化程度加重,而AAV9-GPLD1补充治疗能有效逆转这些病理改变。这些结果表明,GPLD1的心脏保护效应与其酶活性密切相关。
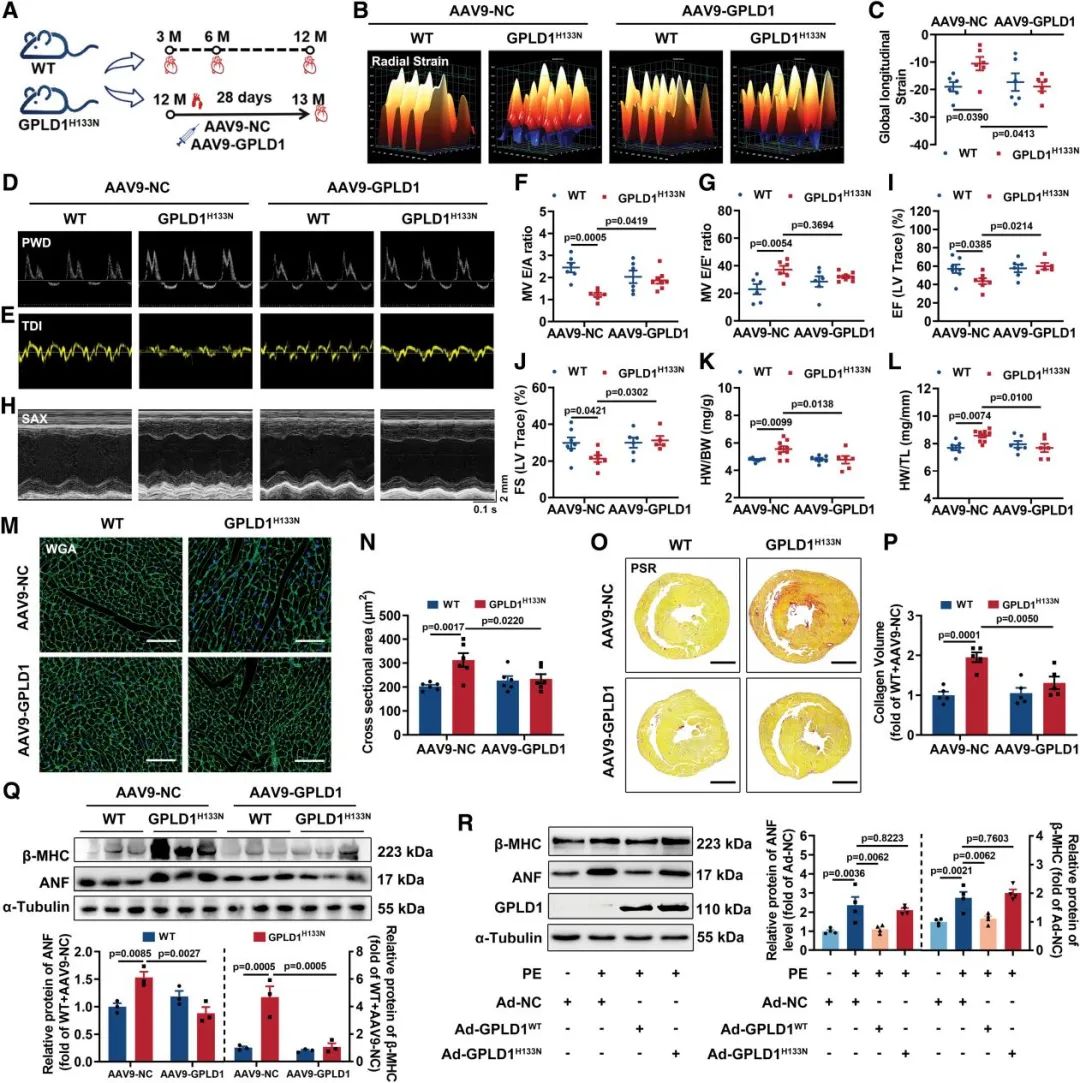
图4. GPLD1酶活性关键位点突变(H133N)诱发心功能损伤
为阐明GPLD1发挥心脏保护作用的分子机制,作者通过免疫沉淀-质谱联用技术对心肌细胞中与GPLD1相互作用的GPI锚定蛋白质进行了系统筛选,鉴定发现uPAR是其关键的相互作用蛋白。实验结果证实,GPLD1与uPAR在生理和病理条件下都存在相互作用,且GPLD1过表达可显著降低心肌组织uPAR蛋白水平,而GPLD1敲除则会诱导uPAR表达升高。功能研究显示,在野生型小鼠中通过AAV9介导的心肌特异性uPAR过表达,能独立诱发小鼠心功能损伤并促进心肌纤维化,而shRNA敲低uPAR水平则可明显改善TAC诱导的心脏功能障碍和心肌肥大。
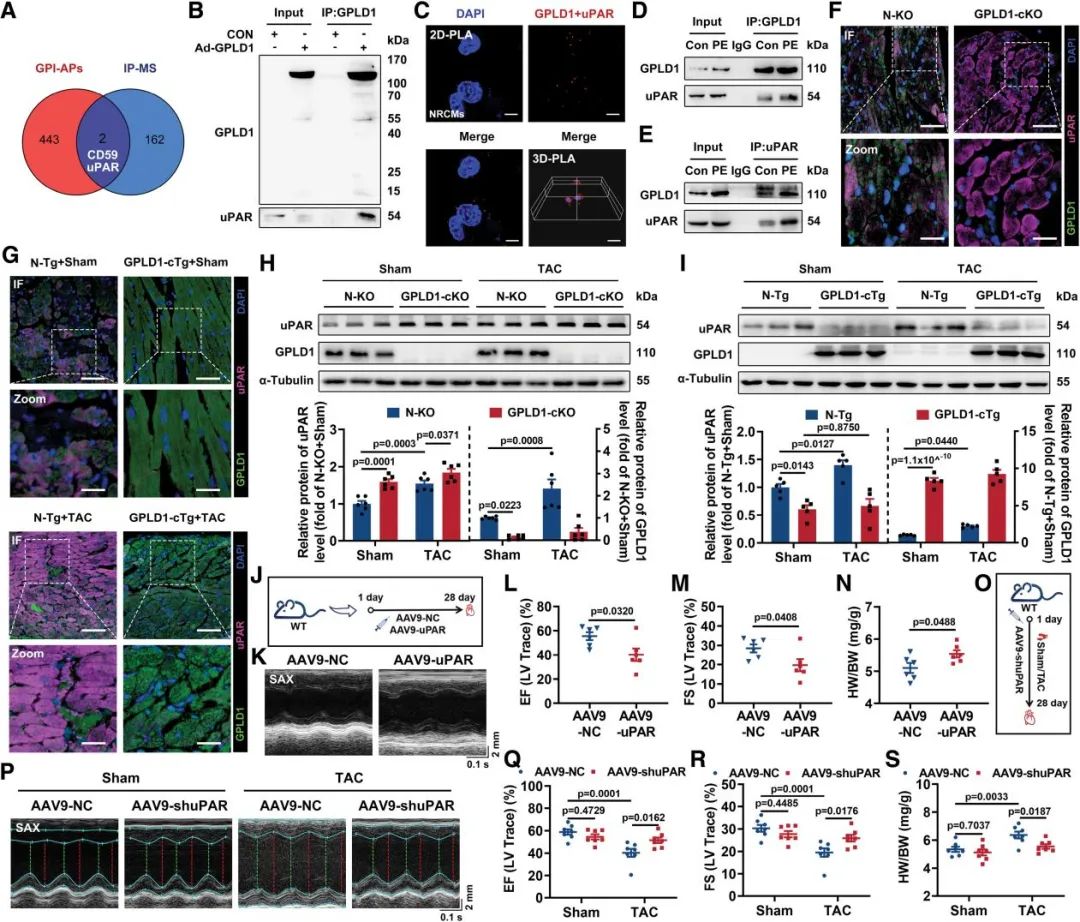
图5. GPLD1与uPAR相互作用并调节其水平
为了验证uPAR是否介导了GPLD1的心脏保护作用,作者在GPLD1-cTg小鼠接受TAC前,通过心肌内注射方式分别导入AAV9-uPAR或AAV9-NC。功能评估显示,GPLD1-cTg小鼠在TAC术后表现出显著改善的心脏功能,而这种保护效应在AAV9-uPAR转导的GPLD1-cTg小鼠中完全消失。组织病理学分析进一步证实,uPAR的外源过表达可显著削弱GPLD1过表达对TAC诱导的心肌肥厚和纤维化的改善作用。这些结果表明,uPAR是介导GPLD1心脏保护功能的关键靶点分子。
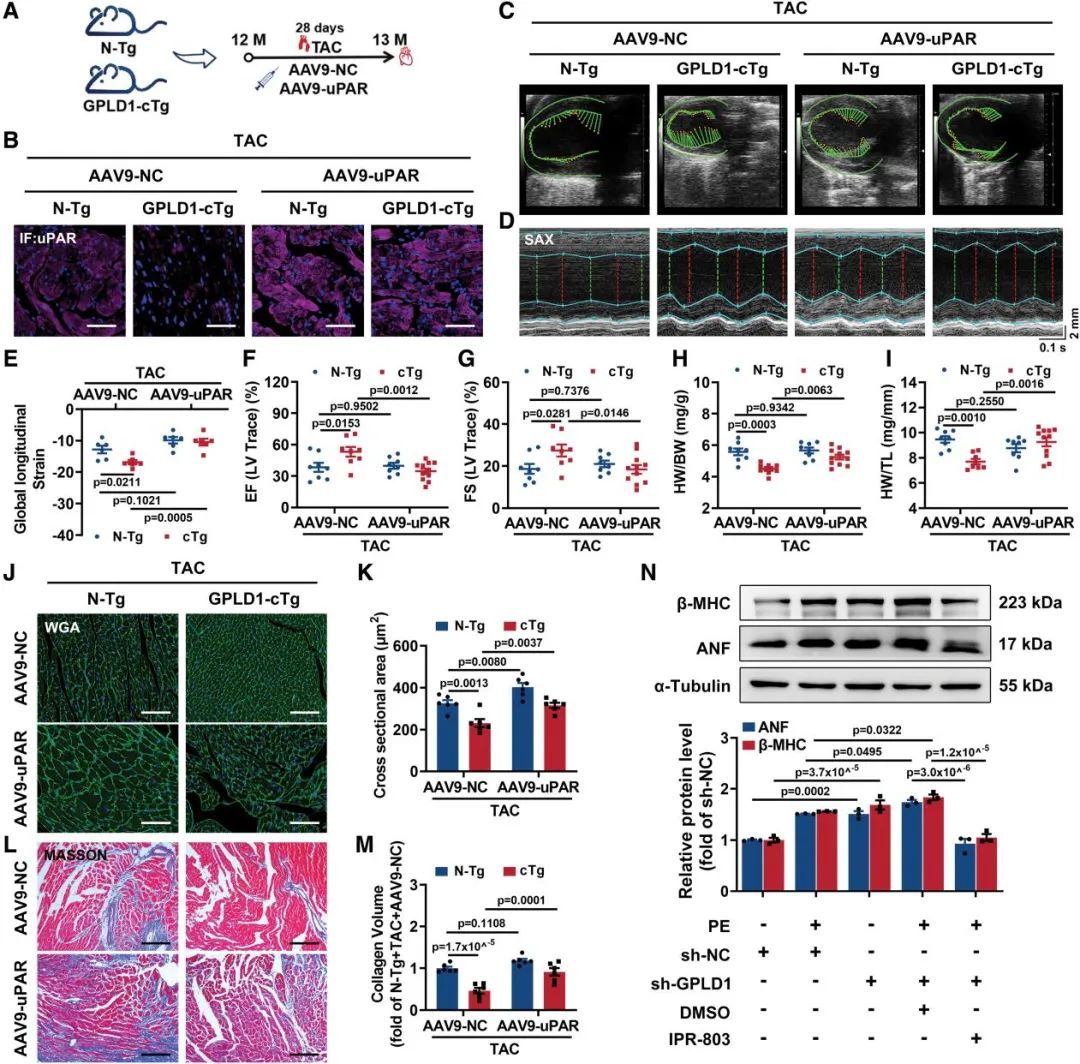
图6. GPLD1通过抑制uPAR水平减轻心功能障碍
通过4D蛋白质组学分析发现,GPLD1缺失显著影响磷脂代谢通路,特别是与磷脂酰肌醇信号密切相关的生物过程。膜磷脂结合实验证实,GPLD1能特异性识别PI(4,5)P2。在病理状态下,去氧肾上腺素(PE)刺激或PI5P4K抑制剂THZ-P1-2处理均可降低PI(4,5)P2水平,导致GPLD1从膜结构向胞质转移,同时伴随uPAR表达上调。值得注意的是,GPLD1过表达能促进其与PI(4,5)P2在膜结构的共定位,而uPAR过表达则通过激活uPA/纤溶酶/PLC通路降解PI(4,5)P2。这些发现揭示了一个精密的双向调控机制:PI(4,5)P2介导GPLD1的膜定位,使其能够切割uPAR的GPI锚定,而uPAR的活化又通过降解PI(4,5)P2调控GPLD1的亚细胞分布。
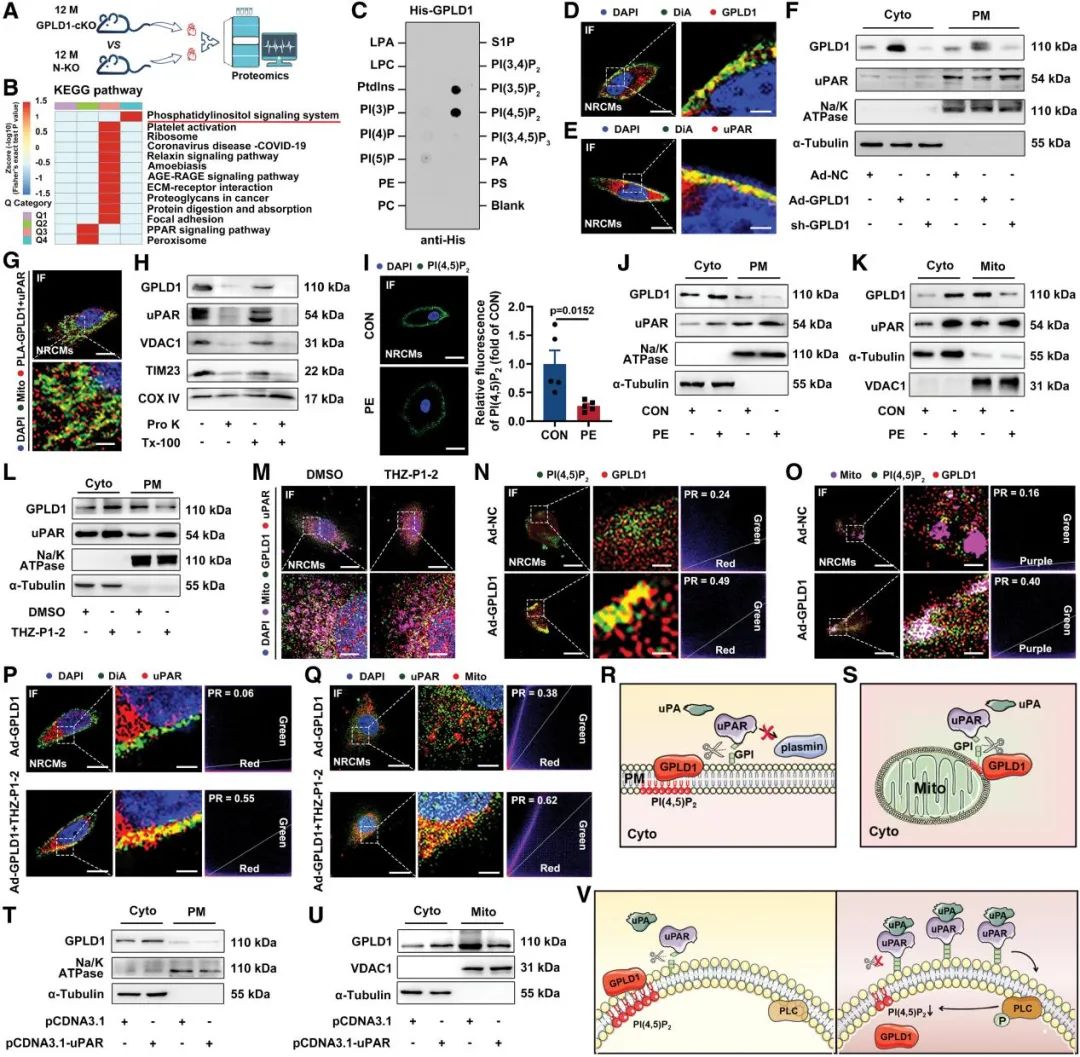
图7. GPLD1通过PI(4,5)P2锚定到细胞膜和线粒体外膜上以调节uPAR
鉴于uPAR激活可显著增强IP3介导的肌浆网钙释放,本研究进一步探讨了GPLD1的心脏保护作用与钙信号调控的关联机制。实验证实,uPAR过表达可显著升高胞质钙浓度,并上调IP3R和p-CaMKI表达水平。GPLD1过表达可拮抗uPAR介导的钙信号激活,减轻PE诱导的胞质及线粒体钙超载,维持线粒体膜电位稳定。GPLD1缺陷导致线粒体呼吸功能受损,加剧TAC模型中的线粒体结构损伤;而其过表达则能改善线粒体生物能量代谢。值得注意的是,uPAR过表达能完全消除GPLD1对线粒体的保护作用,导致线粒体呼吸链功能障碍和结构完整性破坏。这些结果系统阐明了GPLD1通过uPAR调控钙稳态和线粒体功能来减轻心功能障碍。
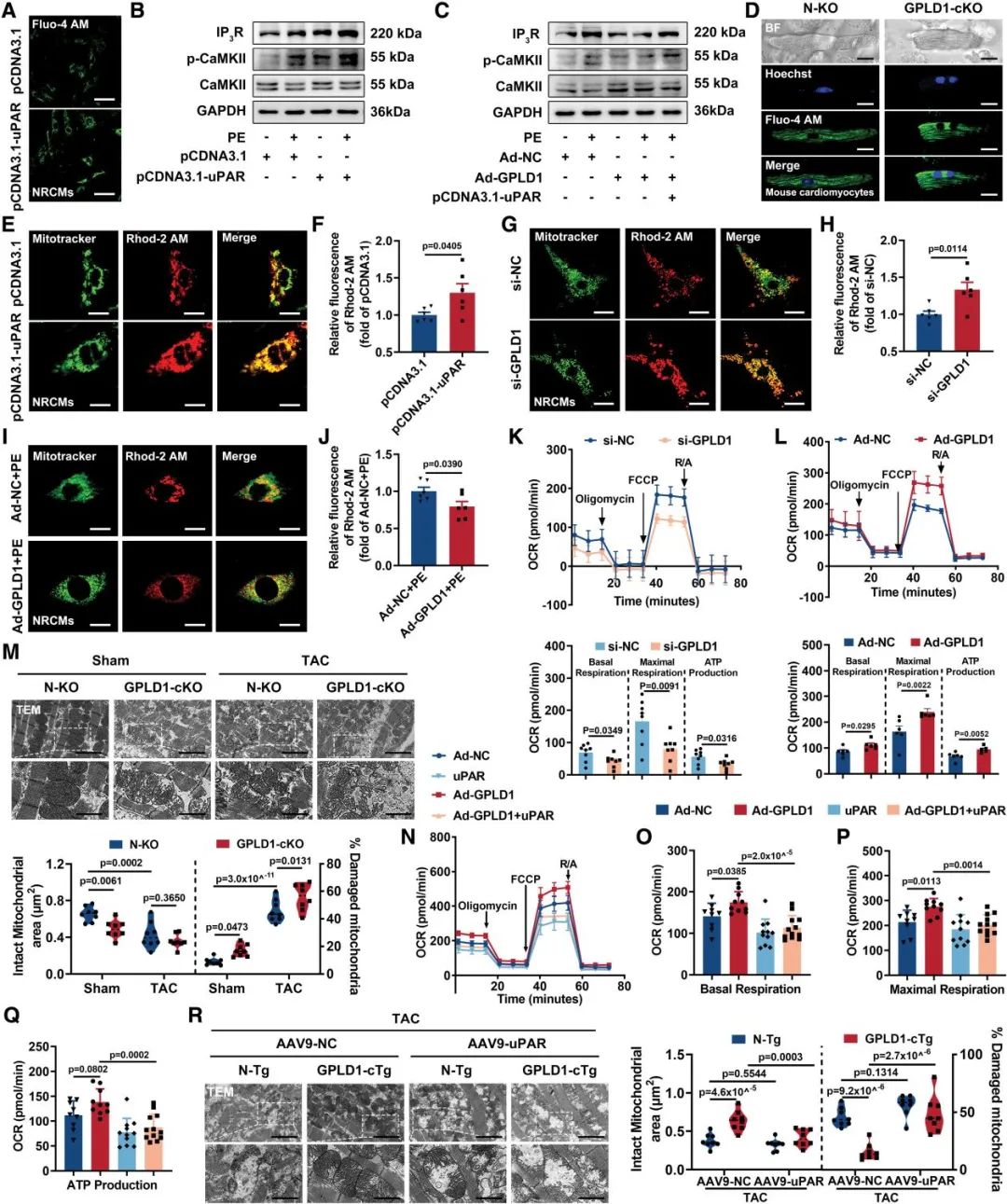
图8. GPLD1通过调节钙稳态和线粒体功能来减轻心功能障碍
综上,本研究系统阐明了GPLD1在心脏保护中的关键作用及其分子机制。GPLD1通过特异性结合PI(4,5)P2定位于细胞膜和线粒体外膜,并切割uPAR的糖基磷脂酰肌醇锚定,从而阻断uPAR介导的PI(4,5)P2/IP3/钙信号通路。这一调控机制可有效改善心肌细胞钙稳态和线粒体功能,减轻病理刺激引起的心脏损伤。研究证实GPLD1与uPAR通过PI(4,5)P2形成动态平衡的调控网络,其功能失衡可能导致心脏功能恶化。这项工作揭示了靶向GPLD1在治疗病理性心脏肥大和心力衰竭中的治疗潜力。
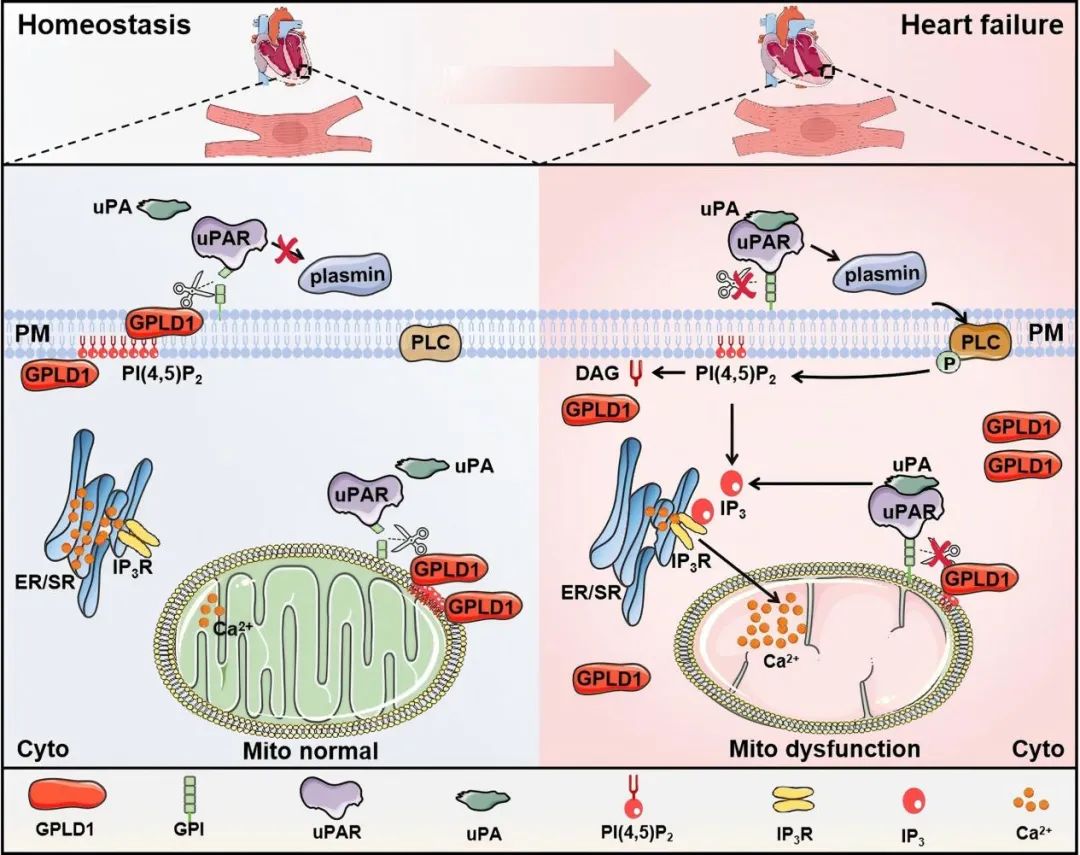
图9. 机制示意图
中山大学药学院刘培庆教授和路静副教授为本文共同通讯作者。中山大学喻文静博士(现美国圣路易斯华盛顿大学医学院博士后)、圣路易斯华盛顿大学医学院郭桢讲师、中山大学药学院梁慧敏硕士研究生为该论文的共同第一作者。该研究得到了国家自然基金、广东省自然基金及美国心脏协会基金等项目的资助。
论文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325623
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)