首页 > 医疗资讯/ 正文
本研究评估了Trop-2、CD47和CD163表达对三阴性乳腺癌(TNBC)患者临床结局的预后影响,并探讨了它们与肿瘤进展的相互作用。研究回顾性分析了92例TNBC患者的队列。将Trop-2、CD47和CD163的表达评分分为阴性/低表达(0-3分)或高表达(4-6分)。主要终点为总生存期(OS)。
队列的中位年龄为50岁。55.4%的患者观察到Trop-2高表达,且与疾病晚期显著相关(p < 0.001)。CD47高表达(44.6%)与晚期阶段相关(p = 0.044),而CD163高表达(45.7%)与晚期阶段(p = 0.021)、无合并症(p = 0.022)和较低的pT分期(p = 0.023)相关。Trop-2与CD47(p = 0.022)、Trop-2与CD163(p = 0.037)、CD47与CD163(p < 0.001)之间分别存在中等程度的正相关。Kaplan-Meier生存分析显示,与Trop-2高表达患者相比,Trop-2低表达患者的OS(p = 0.021)和无进展生存期(PFS)(p = 0.026)显著延长。单因素和多因素分析显示,OS和PFS与Trop-2、淋巴管血管浸润和BRCA状态显著相关。
Trop-2表达是TNBC的重要预后因素,且与更差的结局相关。尽管CD47和CD163显示出预后较差的趋势,但其显著性未得到证实。这些发现为未来联合抗体-药物偶联物(ADC)的研究提供了有希望的前景,因为它们可能为解决TNBC治疗中的多种耐药机制和改善临床结局提供机会。
研究背景
乳腺癌(BC)是全球女性中最常见的恶性肿瘤,也是癌症相关死亡的主要原因。尽管随着早期检测和治疗的进步,生存率显著提高,但晚期疾病仍与预后不良和侵袭性临床进展相关。三阴性乳腺癌(TNBC)约占所有BC病例的10-15%,其生物学特征具有异质性。TNBC中缺乏激素受体和HER2表达,限制了靶向治疗选择的可用性。该亚型通常在较年轻的年龄出现,其特征是侵袭性生物学行为,具有高转移潜力和较短的无病生存期。TNBC的死亡率显著高于其他BC亚型。尽管局部治疗(包括手术和放疗)发挥重要作用,但化疗仍是TNBC的主要全身治疗方式。近年来,免疫治疗和聚(ADP-核糖)聚合酶(PARP)抑制剂等新兴治疗方法已显示出令人鼓舞的结果。然而,预后和预测生物标志物的识别与应用对于制定个体化治疗策略和改善临床管理愈发关键。因此,聚焦于TNBC生物学分层的研究对于推进个性化治疗和改善患者结局至关重要。
滋养层细胞表面抗原-2(Trop-2)是一种由Tacstd2基因编码的35 kDa跨膜糖蛋白。Trop-2最初在滋养层细胞中被发现,参与细胞内钙信号传导,并与癌症病理生理学相关。具体而言,它在MAPK/PI3K/AKT信号通路的关键过程中起核心作用,促进肿瘤增殖、侵袭和转移。Trop-2在皮肤、乳腺和宫颈等多种组织中均有表达,其水平升高通常与多种癌症类型的临床结局较差和生存率降低相关。在快速发展的治疗范式中,免疫治疗或靶向药物与标准化疗的联合方案越来越多地用于应对侵袭性肿瘤行为和耐药机制,抗体-药物偶联物(ADC)已成为一种有前景的治疗策略。值得注意的是,靶向Trop-2的ADC——戈沙妥珠单抗(sacituzumab govitecan)在临床试验中已显示出显著的临床疗效。在获得FDA批准后,它已被纳入TNBC和尿路上皮癌等恶性肿瘤的标准治疗方案,带来了显著的临床获益。
肿瘤相关巨噬细胞(TAMs)是肿瘤微环境(TME)的关键组成部分,显著影响癌症进展、免疫抑制和转移过程。在反映TAMs活性和功能的关键分子中,CD47和CD163尤为突出。CD47通常被称为“不要吃我”信号,是一种允许癌细胞逃避免疫吞噬的免疫检查点分子。多种癌症类型中CD47表达升高与免疫逃逸增强和预后不良相关。相反,CD163是抗炎性M2型巨噬细胞的表面受体,有助于建立促进肿瘤进展的免疫抑制微环境。CD163高表达与肿瘤细胞增殖、血管生成和转移扩散增加相关。最近的研究表明,CD47和CD163的上调均与临床结局不良和生存率降低相关。针对这些分子的新兴治疗策略旨在减轻TAMs的促肿瘤活性,同时增强免疫系统的抗肿瘤反应。具体而言,抗CD47疗法和调节TAMs表型转化的干预措施代表了提高免疫治疗效果的有希望的途径。
从免疫治疗的角度来看,TME中Trop-2与TAMs活性之间的相互作用尤为重要。假设Trop-2的过表达可通过促进TAMs向M2表型极化来放大其促肿瘤功能。这一过程通过增强细胞因子(包括IL-10和TGF-β)的分泌介导,从而形成炎症和免疫抑制微环境。TAMs释放的生长因子和金属蛋白酶可激活Trop-2介导的信号通路,从而增加肿瘤细胞的侵袭和转移能力。临床前研究表明,Trop-2抑制可通过增强巨噬细胞介导的吞噬作用与CD47阻断产生协同效应。此外,Trop-2对PI3K/AKT和MAPK信号通路的激活加强了TAMs与TME的整合,进一步抑制免疫反应并推动肿瘤进展。Trop-2与TAMs之间的这种相互作用导致更具侵袭性的肿瘤表型,并与不良临床结局相关。靶向Trop-2和TAM相关活性(如CD47和CD163)的联合治疗策略为打破这种有害的协同作用提供了有希望的方法。这些策略有可能通过同时抑制肿瘤生长和减轻免疫抑制来拓宽治疗选择并改善癌症管理。这些双靶点方法值得在临床研究中进一步探索,代表了推进免疫治疗策略的创新途径。
本研究的主要目的是探讨通过免疫组织化学在肿瘤组织中评估的Trop-2、CD47和CD163表达水平与TNBC(其特征为侵袭性临床病程和不良预后)的临床结局及生存率之间的关系。本研究为肿瘤学文献提供了潜在贡献,为未来的ADC研究提供见解,这些见解可能扩展治疗选择、解决耐药机制并改善临床结局。
研究结果
患者特征:
本研究队列包含92例患者,中位年龄为50岁(范围:25–79岁),其中48.9%(45例)患者年龄≥50岁。此外,40.2%(37例)为绝经前女性,59.8%(55例)为绝经后女性。35.9%(33例)患者存在合并症,19.6%(18例)检测到BRCA1和BRCA2胚系突变。50%患者的肿瘤位于乳腺外上象限,10.9%(10例)为多灶性肿瘤。82例患者的ECOG PS评分为0–1分,10例为≥2分。64.1%患者的肿瘤为3级,19.6%为pT 3–4期,53.3%存在淋巴结受累,21.7%在诊断时已出现远处转移。另外,53.3%患者为疾病1–2期,46.7%为3–4期。71.8%病例的Ki67增殖指数>50%。根据Trop-2、CD47和CD163表达水平分类的TNBC患者社会人口学及临床病理特征详情见表1。
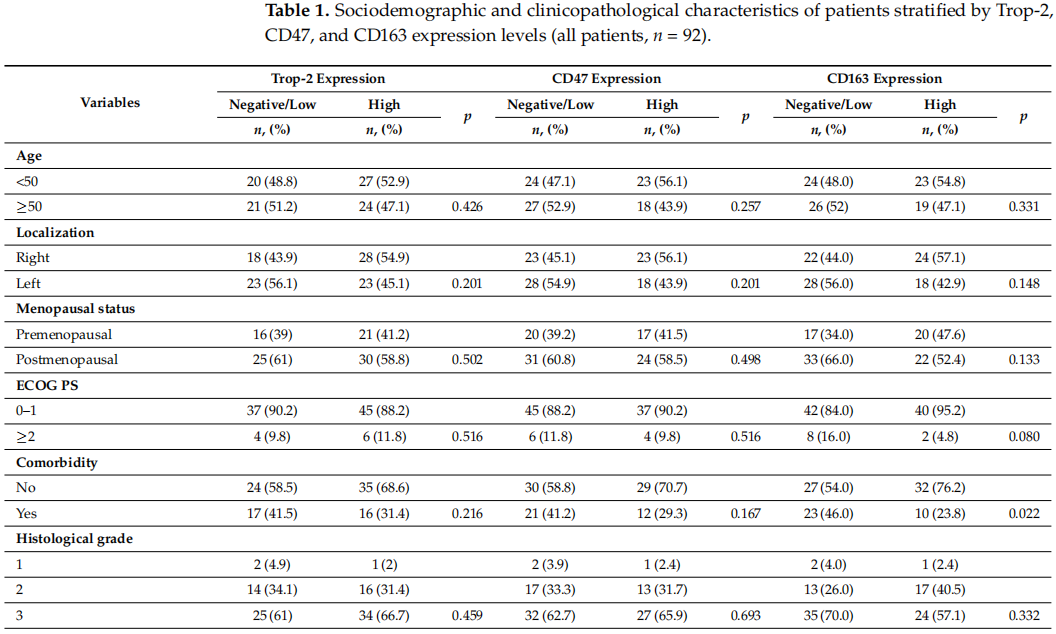
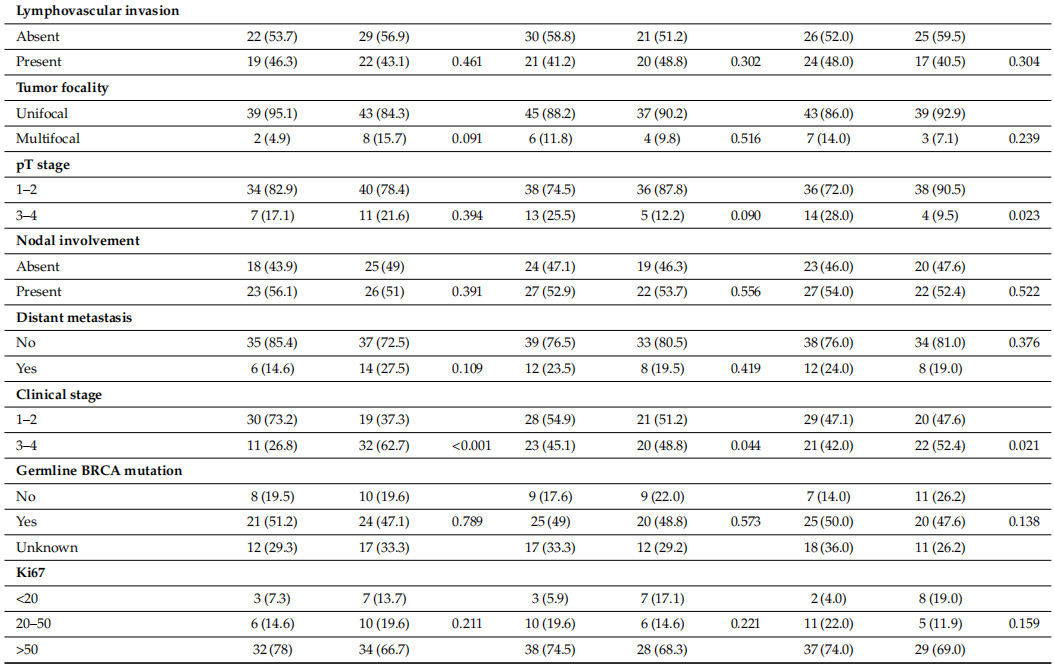
表1
Trop-2、CD47和CD163表达:
在TNBC患者中,44.6%(41例)表现为Trop-2阴性或低表达,55.4%(51例)为Trop-2高表达(图1A,B)。Trop-2高表达更常见于绝经后患者,无合并症者,右侧肿瘤、单灶性病变、低ECOG PS评分、高组织学分级、无淋巴管血管浸润、较低pT分期、淋巴结受累及高Ki67增殖指数的患者,但这些关联均无统计学意义(p > 0.05)。重要的是,Trop-2高表达与疾病晚期显著相关(p < 0.001)(表1)。
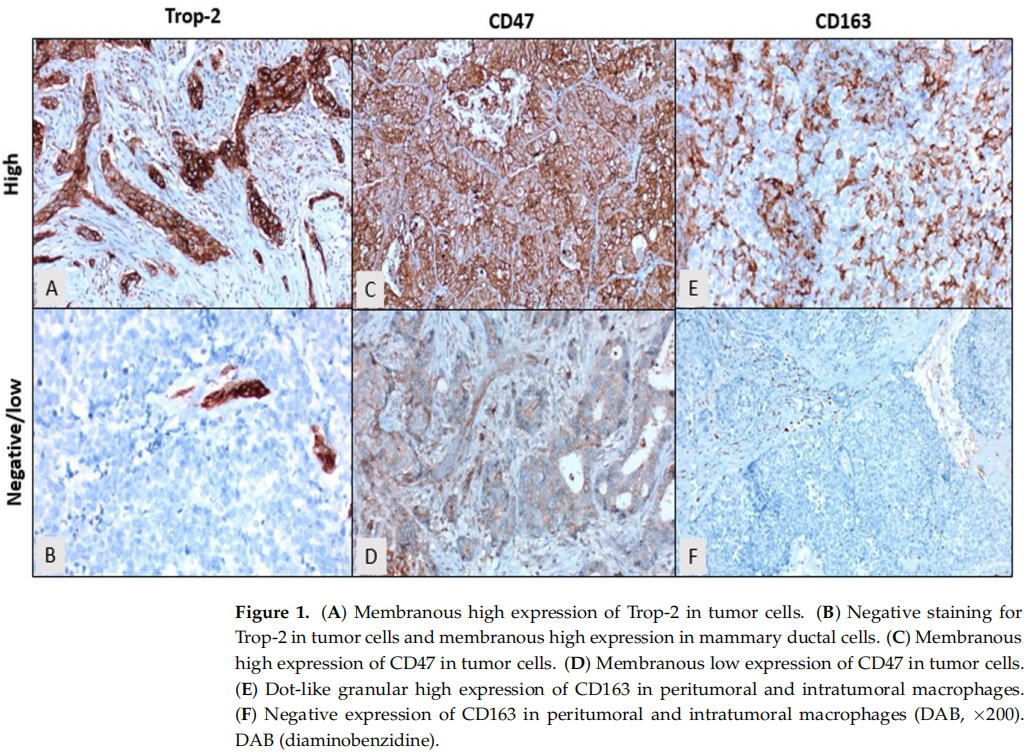
图1
TNBC患者中,55.4%(51例)为CD47阴性或低表达,44.6%(41例)为CD47高表达(图1C,D)。CD47高表达在绝经后女性,无合并症者,右侧肿瘤、单灶性病变、低ECOG PS评分、高组织学分级、无淋巴管血管浸润、较低pT分期、淋巴结受累及高Ki67增殖指数的患者中更为常见,但CD47表达与这些临床因素之间无统计学显著关联(p > 0.05)。值得注意的是,CD47高表达与疾病晚期显著相关(p = 0.044)(表1)。
TNBC患者中,54.3%(50例)为CD163阴性或低表达,45.7%(42例)为CD163高表达(图1E,F)。CD163高表达在绝经后女性,右侧肿瘤、单灶性病变、低ECOG PS评分、高组织学分级、无淋巴管血管浸润、淋巴结受累及高Ki67增殖指数的患者中更常见,尽管存在这些趋势,但CD163表达与上述临床因素无统计学显著关联(p > 0.05)。然而,CD163高表达与疾病晚期(p = 0.021)、无合并症(p = 0.022)及低pT分期(p = 0.023)显著相关(表1)。
此外,Trop-2高表达与CD47高表达之间存在中等程度的正相关(p = 0.022,r = 0.232),Trop-2高表达与CD163高表达之间亦存在正相关(p = 0.037,r = 0.207)。更重要的是,CD47高表达与CD163高表达之间存在显著正相关(p < 0.001,r = 0.364)(表2)。

表2
生存分析:
该队列的中位随访时间为56.8个月,研究期间26例患者(28.1%)死亡。中位OS为76个月(95%CI,66.0–85.9)。此外,11例患者(11.2%)在随访期间出现疾病复发,整个队列的中位PFS为73个月(95%CI,58.2–87.7)。
Trop-2阴性/低表达患者的中位OS为84个月(95%CI:72.3–95.7),中位PFS为80个月(95%CI:65.7–97.6)。相比之下,Trop-2高表达患者的中位OS显著缩短至54个月(95%CI:45.6–62.4),中位PFS为52个月(95%CI:38.7–65.5)。OS(p = 0.021)和PFS(p = 0.026)的组间差异均具有统计学意义(图2和图3)。
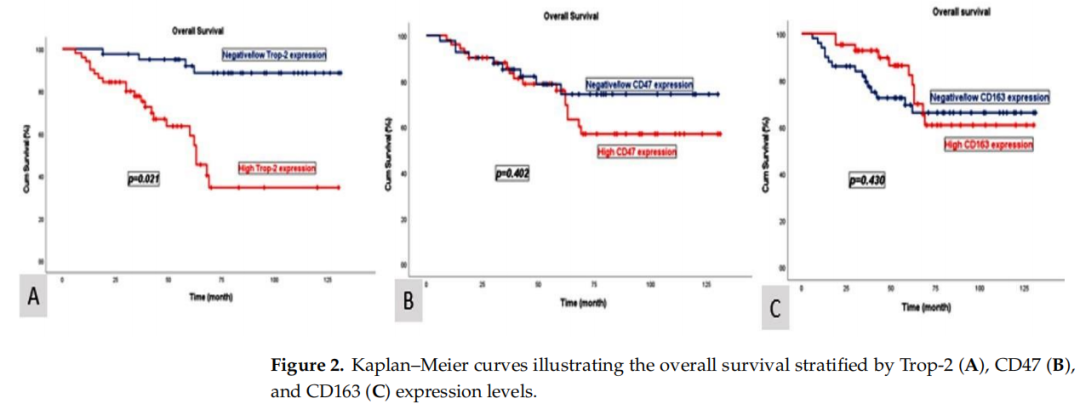
图2
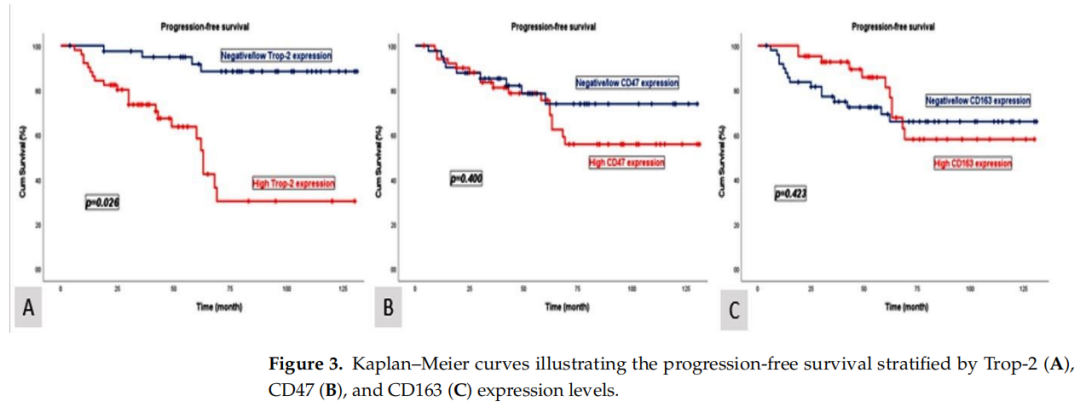
图3
CD47阴性/低表达患者的中位OS为84个月(95%CI:61.6–106.3),中位PFS为82个月(95%CI:66.4–104.8);而CD47高表达患者的中位OS为68个月(95%CI:47.2–88.8),中位PFS为65个月(95%CI:42.1–87.9)。CD163阴性/低表达患者的中位OS为79个月(95%CI:66.0–92.1),中位PFS为77个月(95%CI:59.6–87.9);CD163高表达患者的中位OS为70个月(95%CI:50.4–89.6),中位PFS为65个月(95%CI:40.2–89.8)。根据CD47和CD163表达水平比较的中位OS和PFS结果具有临床意义,但未达到统计学显著水平。中位OS和PFS分析的p值如下:CD47(p = 0.402,p = 0.400),CD163(p = 0.430,p = 0.423)(图2和图3)。
使用Cox比例风险模型进行单因素分析时,发现多个因素与OS显著相关,包括淋巴管血管浸润、BRCA状态、pT分期、远处转移、临床分期和Trop-2表达(p < 0.05)。同样,单因素分析显示PFS与淋巴管血管浸润、BRCA状态、肿瘤灶性、pT分期、远处转移、临床分期和Trop-2表达显著相关(p < 0.05)(表3)。多因素分析中,OS与淋巴管血管浸润、BRCA状态和Trop-2表达显著相关(p < 0.05);PFS的多因素分析显示,肿瘤灶性、BRCA状态和Trop-2表达与PFS显著相关(p < 0.05)(表4)。
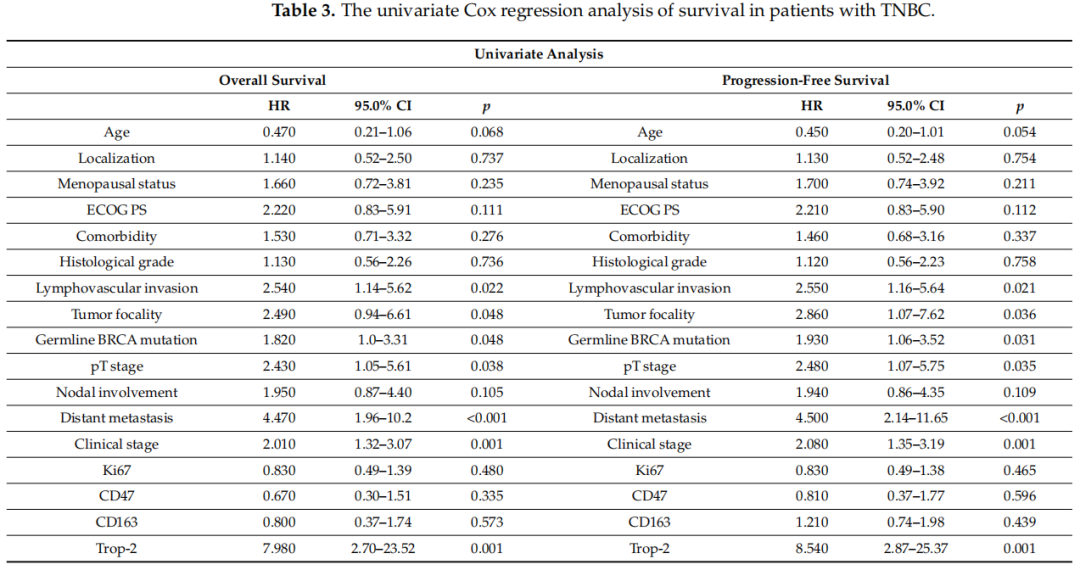
表3

表4
讨 论
TNBC仍是乳腺癌中最具挑战性的亚型之一,其特征为侵袭性生物学行为、高复发率,且缺乏针对性的激素或分子靶向治疗。然而,近期治疗策略的进展为改善患者预后带来了希望。靶向PD-1/PD-L1轴的免疫检查点抑制剂已成为免疫治疗领域的变革性手段。帕博利珠单抗和阿替利珠单抗等药物在PD-L1阳性TNBC患者中显示出显著临床获益,使特定人群的生存结局得到改善。此外,ADC已展现出巨大潜力——首个靶向Trop-2的ADC药物戈沙妥珠单抗显著延长了既往接受过化疗的晚期TNBC患者的生存期。同时,针对肿瘤微环境多种组分(包括肿瘤浸润淋巴细胞(TILs)、巨噬细胞和自然杀伤(NK)细胞)的新兴免疫调节策略正在积极探索中。这些策略正与传统疗法联合评估,旨在通过利用免疫系统识别和清除癌细胞的能力来增强疗效。随着持续的临床试验和生物标志物驱动的研究,这些新型疗法融入临床实践预示着TNBC治疗进入新纪元,强调个体化医疗和改善生存结局。
Trop-2因其在MAPK、PI3K和AKT等关键信号通路中的作用(这些通路对细胞增殖、存活和转移至关重要),近年来在癌症预后研究中备受关注。Trop-2过表达通过激活这些通路促进肿瘤生长和转移,与包括乳腺癌在内的多种癌症的不良预后相关。Trop-2与肿瘤微环境的相互作用,尤其是其对免疫细胞行为的调节,在癌症进展中起关键作用。TAMs,常以CD47和CD163高表达为特征,促进免疫逃逸和肿瘤进展。研究表明,Trop-2表达升高与CD47、CD163水平增加共同导致TAM活性增强和更差的临床结局,在TNBC中尤为明显。此外,有研究提出Trop-2通过PI3K/AKT和MAPK通路,通过促进巨噬细胞向M2表型极化来影响肿瘤微环境,这一过程与组织重塑、血管生成和免疫抑制等促肿瘤过程相关。Trop-2与CD47等免疫检查点分子的相互作用,以及这些关键信号通路之间的串扰,为联合治疗的临床研究指明了有前景的方向。此类策略有望改善癌症(尤其是TNBC)的临床管理并增强治疗效果。
本研究结果强调了Trop-2、CD47和CD163在TNBC病理生物学中的潜在预后意义。具体而言,结果表明Trop-2表达升高与不良临床结局相关,进一步支持其在肿瘤进展和转移扩散中的推测作用。类似地,CD47通过其在免疫逃逸中的功能(尤其是抑制肿瘤微环境内的免疫细胞活性)被认为促进肿瘤侵袭性。CD163高表达进一步突显了TAMs的免疫抑制功能,提示其在营造免疫抑制微环境(尤其在TNBC中)中的关键作用。鉴于TNBC的侵袭性病程和有限的治疗选择,这些分子值得作为独立预后标志物和潜在治疗靶点进行考量。此外,将其抑制剂与免疫治疗联合可能增强现有治疗方式的疗效。尽管本研究受限于样本量相对较小,但其发现为后续研究奠定了基础。需要纳入更大、更多样化队列的前瞻性研究,以验证这些生物标志物的预后价值并阐明其在TNBC临床管理中的潜在应用。
Trop-2和TAM生物标志物的预后意义在既往研究中已被广泛探讨。Tong等人的综述探讨了靶向Trop-2的ADC在TNBC中的作用机制和临床应用,发现这些药物可促进免疫重编程、调节肿瘤微环境并增强抗肿瘤疗效。ASCENT试验的亚组分析显示,抗Trop-2 ADC戈沙妥珠单抗显著改善了TNBC患者的临床结局,无论BRCA1/2突变状态如何。类似地,Rugo等人报道,戈沙妥珠单抗在改善HR+/HER2阴性转移性乳腺癌患者的PFS方面优于标准化疗。此外,III期TROPION-Lung01试验显示,另一种抗Trop-2 ADC药物德达博妥单抗(datopotamab deruxtecan)在转移性非小细胞肺癌(NSCLC)中较多西他赛显著延长PFS。在TAM生物标志物方面,Dawoud等人将CD47和CD163确定为TAM活性的指标,并发现其表达与乳腺癌不良预后相关。同样,Imam等人强调了CD47和CD163表达在胰腺神经内分泌肿瘤中的负预后影响。本研究结果与这些发现高度一致,进一步支持Trop-2及TAM相关生物标志物的预后意义。
本研究强调了TNBC中Trop-2与TAM生物标志物的相互作用及其对临床结局的影响,但存在若干局限性。回顾性设计、依赖单中心数据及相对较小的队列规模可能限制研究结果的普适性。尽管人口统计学分布呈现异质性,但患者选择缺乏随机化过程进一步削弱了研究的可靠性。此外,由于技术和经济限制,无法在所有病例中评估PD-L1表达和微卫星不稳定性(MSI)等因素,降低了研究的整体效能。再者,肿瘤组织中这些生物标志物表达的评分缺乏全球标准化协议,加上临床医生在晚期治疗中疾病管理策略的差异,可能导致结果解释的变异性。探索Trop-2与其他TAM标志物(如CD20)的相关性为未来研究提供了有希望的方向。纳入功能研究以探讨其与PI3K、AKT和MAPK等关键信号通路的下游相互作用,可能产生有价值的见解并大幅推进对其在肿瘤生物学中作用的理解。此外,需要实验研究来验证Trop-2在TNBC细胞系中的功能作用。因此,有必要开展前瞻性多中心研究以解决这些局限性并提供更明确的结论。
本研究强调了Trop-2、CD47和CD163表达在TNBC(一种侵袭性且耐药的乳腺癌亚型)中的预后重要性。Trop-2高表达与疾病晚期及不良临床结局(包括更短的OS和PFS)显著相关。尽管CD47和CD163显示出预后较差的趋势,但其预后价值未达到统计学显著水平。这些生物标志物之间的相互作用表明它们在调节肿瘤微环境中的作用,尤其是通过免疫逃逸和巨噬细胞极化。Trop-2在致癌通路中的参与以及CD47和CD163的免疫抑制效应突显了它们作为治疗靶点的潜力。尽管受限于回顾性设计和小样本量,本研究为进一步研究提供了基础。需要更大规模的前瞻性研究来证实这些发现,并探索其融入临床实践以优化TNBC预后评估和开发新型疗法的可能性。
我司的“Trop2蛋白表达检测”项目,基于免疫组化(IHC)平台检测,辅助乳腺癌患者评估预后,并指导ADC药物的靶向治疗,样本类型为组织、或石蜡块、或4-5张厚度4微米防脱切片(烤片、挂胶),报告周期为5个自然日。
参考文献:
Yüceer, R.O.; Aydın, S.; Gelir, I.; Koc, T.; Tuncer, E.; Ucar, M. Exploring the Prognostic Role of Trop-2, CD47, and CD163 Expression Levels on Survival Outcomes in Patients with Triple-Negative Breast Cancer. Diagnostics 2025, 15, 232. https://doi.org/10.3390/diagnostics15020232

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)