首页 > 医疗资讯/ 正文
简介
侵袭性黏液腺癌(IMA)是肺腺癌的一种组织学亚型,具有明显的临床、影像学、组织病理学和分子特征。与侵袭性非黏液性腺癌(INMAs)相比,IMAs较少见,约占肺腺癌的3-10%。影像学上,IMAs可表现为实性结节或肺样实变区域,多灶性和双侧肺受累很常见,易与肺炎或转移性癌混淆。在这篇综述中,作者回顾了IMAs的组织病理学特征,阐述了其遗传特征的最新进展。
组织学改变
在最新版的WHO分类中,IMAs分为杯状细胞型(类似于胃小凹上皮)和柱状细胞型(类似于反应性呼吸道上皮细胞)。然而,根据肿瘤细胞的特征,其它形态学变异,可存在于IMAs中。这些形态变异,在小活检标本的诊断中具有挑战性。
基于细胞形态的IMA组织学分型
1、腺泡型
MA中最常见的形态。肿瘤细胞位于基底,细胞核温和,可见明显的胞质顶端黏液空泡,以及数量不等的杯状细胞,瘤细胞呈簇状分布。
2、柱状细胞型
WHO分类中公认的形态,在一些病例中,瘤细胞缺乏黏液空泡,可能误诊为非黏液腺癌。瘤细胞核呈长杆状,基底极性存在,核轻度异型。胞质顶端黏液空泡大部分缺失,然而,细胞外黏蛋白的存在,这是黏液腺癌的显著特征。黏蛋白染色,如DPAS,可以有助于突出显示细胞内黏蛋白成分。
3、印戒细胞型
印戒细胞的显著特征,是存在单一的胞质空泡,其细胞核位于偏心位置。印戒细胞与杯状细胞的关键区别特征,在于瘤细胞核缺乏基底极性。目前专家认为,印戒细胞型是一种非黏液腺癌的变异亚型,因此不归类为IMA的特异亚型。
4、透明细胞型
透明细胞型在IMA中很少见,细胞包含透明的细胞质,有或没有核周空泡,类似于非黏液腺癌的透明细胞,以及其它器官系统中的透明细胞肿瘤。镜下可见细胞核基底极性,以及胞质顶端黏液空泡的丢失,这与非黏液腺癌的透明细胞特征相一致。因此,在小活检中,仅见透明细胞,不足以诊断IMA。
5、胎儿型
肿瘤细胞显示柱状细胞形态,可见明显的胞质空泡。肿瘤细胞形态,类似于具有肠母细胞分化的胃腺癌、肺胎儿腺癌。有研究发现,这种形态通常与其它高级别组织学特征相关,然而,目前缺乏相关的预后意义研究。
6、肠型
在少数病例中,IMAs可以表现出肠腺癌的特征,肿瘤细胞包含更多的细胞质,具有长杆核和假复层核。它们类似于发育不良的肠上皮,未见中央凹分化或杯状细胞。肿瘤基质类似于肠道黏膜,包含丰富的免疫细胞群。虽然肺和肠道免疫组化标记物,在IMA中可以共同表达,但细胞外黏蛋白沉积,在肠腺癌中并不明显。
7、壁结节样病变
在IMA的一小部分患者中,有类似于肺外黏液腺癌的壁结节样病变。这些病变表现为肉瘤样或巨细胞形态。由于报告的病例数量较少,不足以检测出生存特征的真正差异,然而,该组织学特征可能反映了IMA的去分化。
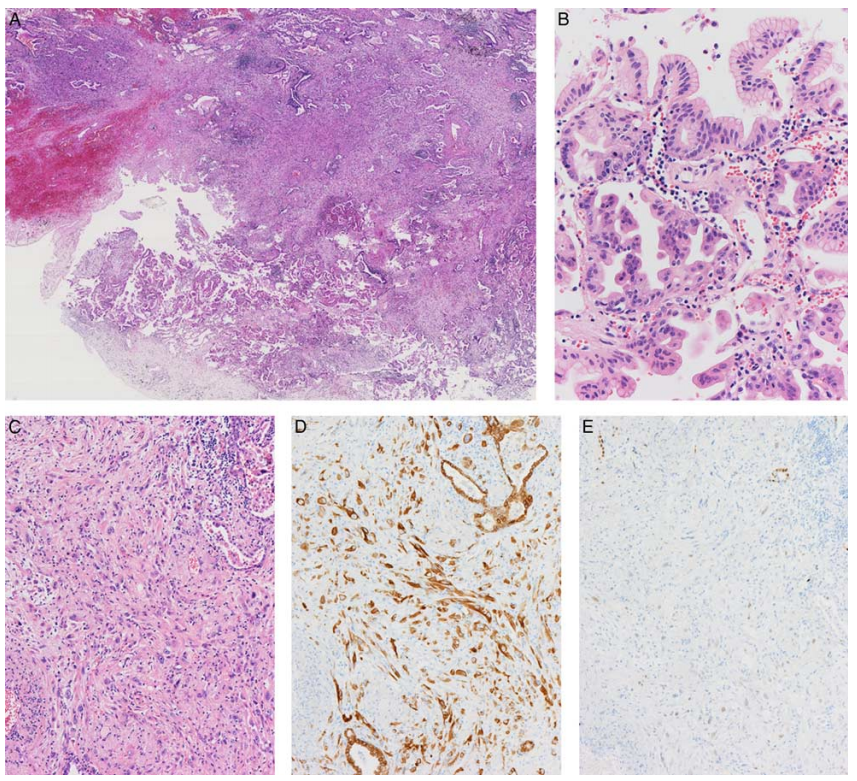
图1. IMA中肉瘤样壁结节样病变。离散结节样区域(A)被IMA包围,后者在组织学上显示典型的杯状和高柱状细胞(B)。壁状结节样病变由梭形细胞和多形细胞(C)组成,AE1/AE3染色阳性(D),突出显示了这种病变的上皮性质。IMA的关键分子HNF4α的表达明显降低(E)。图片源自Am J Surg Pathol 2022;46:1524–1532。
8、胶样腺癌
胶样腺癌是2021年WHO分类中与IMA不同的一种亚型,但两者可能在同一肿瘤中同时存在。胶样腺癌的特点是产生大量的细胞外黏蛋白,可见显著的胶样切面。这导致肺泡壁的破坏和肿瘤细胞从间质脱离,从而产生假囊性外观。
向具有经典IMA形态的区域过渡,是胶样腺癌的诊断线索,特别是肿瘤细胞在黏液基质中稀疏分散的情况下。胶样成分> 50%,是胶样腺癌诊断的重要依据。
9、混合型黏液和非黏液腺癌
混合型黏液腺癌和非黏液腺癌(MMNA),目前在WHO分类中归类为IMA,定义为黏液和非黏液成分的混合,每种成分占肿瘤总体积≥的10%。除外显示非经典形态学和高级特征的病例,大多数病例的组织学区别是显著的。浸润性黏液腺癌的关键特征,是细胞外黏蛋白沉积,无论形态如何,这与非黏液腺癌不同。当在肿瘤的其他区域可见经典的IMA形态学时,肿瘤的组织学异质性,也是重要的诊断依据。在小活检和大切标本之间的组织学特征存在差异的情况下,需要广泛取材。不推荐在小活检中的分类,也没有必要,因为这与目前的治疗方案不相关。
从预后的角度来看,与IMA相比,显著的(≥10%)非粘液腺癌成分,与更差的预后相关。MMNA的预后,介于有和没有高级别特征的IMA之间。
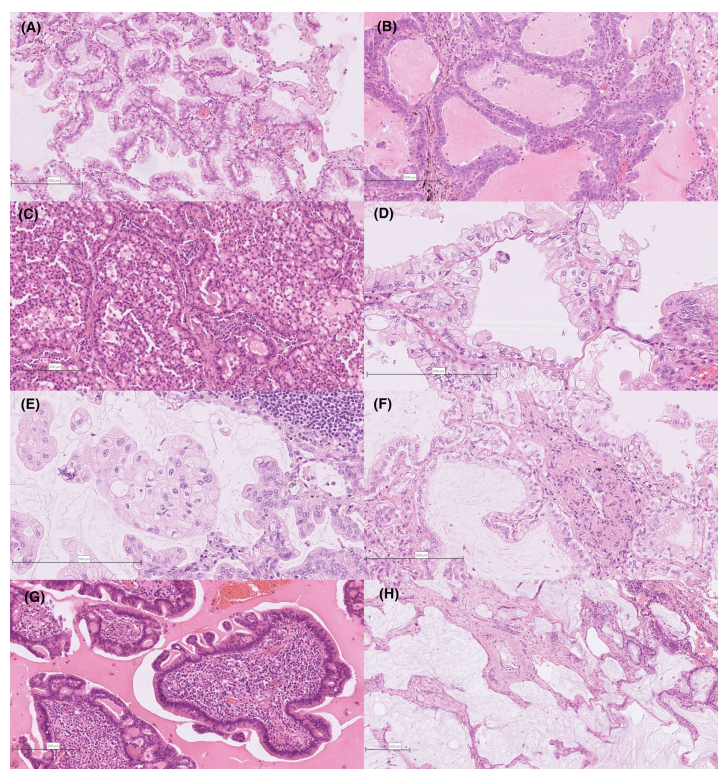
图2。浸润性黏液腺癌的经典和变异亚型。(A)杯状细胞型。(B)柱状细胞型。黏蛋白空泡丢失,细胞外黏蛋白沉积。(C)印戒细胞型。瘤细胞中含有明显的胞质空泡,挤压细胞核。(D、E)透明细胞型。瘤细胞含有透明的细胞质,核周空泡化。(F)胎儿型。瘤细胞类似于透明细胞;然而,关键的区别在于,瘤细胞存在独立的亚核空泡,挤压瘤细胞核远离基质。(G)肠型。瘤细胞类似于发育不良的肠上皮,具有结构和细胞异型性。免疫细胞的微环境也类似于肠道黏膜。(H)胶样腺癌。黏蛋白池破坏肺泡,邻近IMA可见杯状细胞样成分(右)。
分子遗传学改变
IMA中的基因突变
IMA的基因组改变,与INMAs有很大的不同。与INMAs相比,IMA常见KRAS(白种人)和EGFR(亚洲人群)突变。最近的研究使用高通量分析,如NGS和WES,结果显示,在IMA中,KRAS突变仍然是最常见的致癌驱动突变,占所有病例的53.3%。
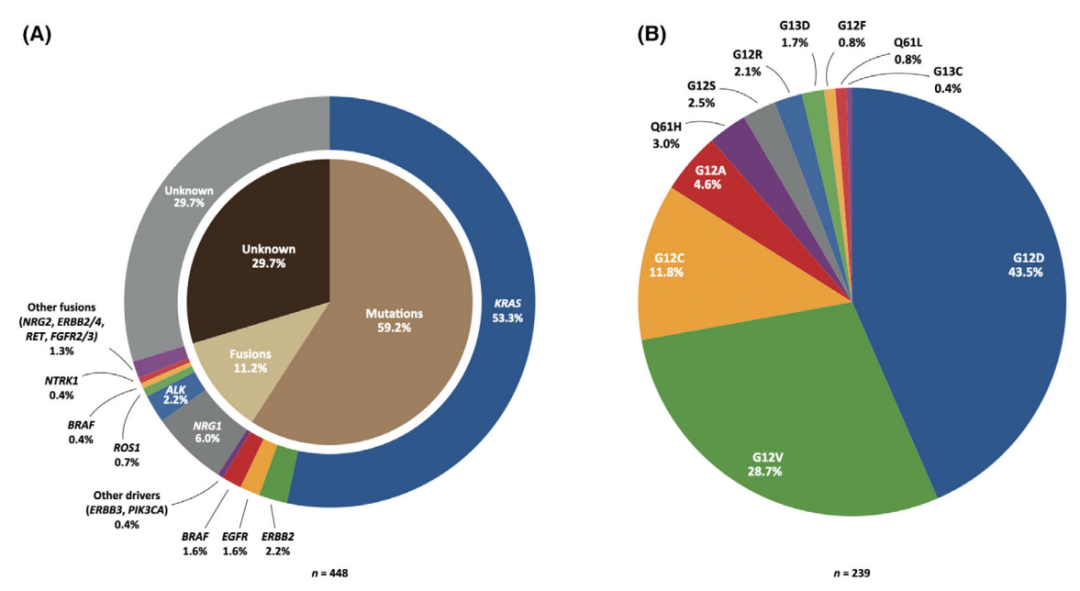
图3. 侵袭性粘液腺癌的基因组改变。
肿瘤细胞的克隆关系
IMAs常表现为多灶性或多叶性病变,提示原发肿瘤或肺内转移同步进行。它们的区别是至关重要的,因为它将直接影响其肿瘤的分期、治疗决定和预后。同步肿瘤是单独分期的,而肺内转移的分期为T3、T4或M1a,这取决于转移性肿瘤是否涉及同一叶、同侧叶或对侧叶。应用NGS技术,研究者发现,出现多个肿瘤病灶的IMAs,主要是肺内转移,很少是同步肿瘤。研究者还发现,初始肿瘤和后发肿瘤,具有相同的KRAS突变,这表明后发肿瘤实际上是肺内扩散的结果,而不是新的原发肿瘤。不同病灶的瘤细胞均具有相同的KRAS和NKX2-1位点突变,也提示肺内转移。
MMNA和胶样腺癌的驱动突变
研究者应用NGS,发现在MMMA中,存在KRAS、BRAF、EGFR突变和ALK重排,其中KRAS突变占优势。约50%的胶样腺癌出现KRAS突变,常见的突变位点包括G12D、G12V、G12R和G12C,其它常见的突变,包括STK11(75%)和PAPR1(50%)。
由先天性肺气道畸形引起的侵袭性黏液腺癌
CPAM是一种罕见的囊性病变由架构扭曲的肺结构,发病率为1/2500。 Stocker分类描述三个不同的亚型,后来扩展到5亚型,0型常见腺泡发育不良,4型为退化囊性形式胸膜母细胞瘤,伴DICER1突变。2型CPAMs是最常见的,通常由<20mm细支气管样囊肿包围发育不良的肺泡实质,1型CPAMs罕见,通常由一个或多个直径大于20mm囊肿,伴较小的囊肿和肺泡实质。
在大约三分之一的病例中,CPAMs囊肿衬内的粘液细胞簇(MCCs),主要见于1型CPAMs,,但在2型和3型CPAMs中很少见。这些细胞可发展成IMAs或MMMA。大多数病例发生在1型CPAMs中,那些单纯的囊内生长(即不延伸到邻近的肺泡实质),与惰性行为和良好的预后相关;然而,那些表现为囊外(伴或无囊内)生长的患者,与侵袭性生长模式、气腔扩散(STAS)、复发或转移有关。
分子遗传学研究发现,在CPAMs中发现的MCCs,经常存在KRAS突变(G12D、G12V和G12C),除了KRAS突变外,还可见FHIT、Rb和p16INK4的突变。
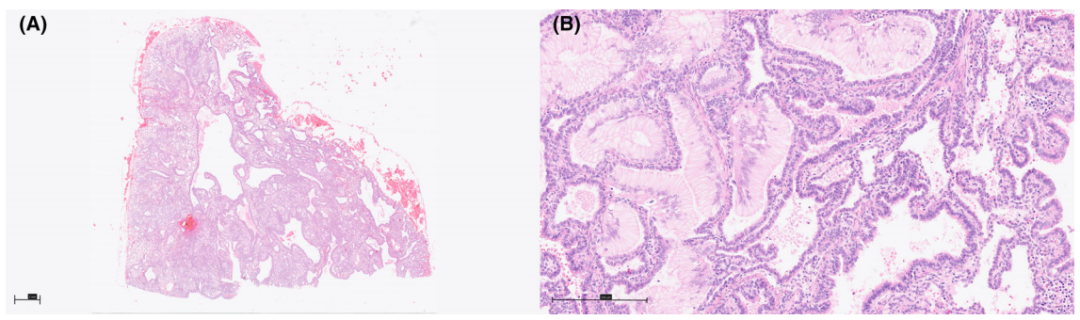
图4. 由1型CPAM引起的黏液腺癌。(A)囊肿内有纤毛呼吸型上皮,其间有肺实质;后者显示晚期囊状至肺泡期发育停滞。(B)囊性病变内多灶性受累,轻度不典型黏液细胞,呈杯状细胞形态,纯鳞状生长模式。这些病变跨越的距离至少为15mm。NGS结果显示KRAS c.35G>A (p。G12D)突变,变异等位基因频率为31.7%。
鉴别诊断
1、伴有细胞内黏蛋白产生的非黏液性腺癌
分散的胞浆内黏蛋白常见于NMA,在缺乏IMA形态和细胞外黏蛋白的情况下,不足以诊断IMA。不建议用组织学染色或IHC检测黏蛋白,应用于IMA的筛查。在小活检标本中,偶尔的病例可能难以分类,在这种情况下,诊断术语“具有粘液和非粘液特征的腺癌”是可取的。
2、肺外源性转移性黏液腺癌
虽然IHC标记物通常有用,但由于免疫谱重叠,部分转移性粘液腺癌与肺原发癌难以鉴别。IMA在基因组、转录组学和甲基组学上,与肺外部位的粘液腺癌相似。因此,目前的分子平台在确定肿瘤起源位置方面的效用有限。临床病史和放射学改变,以及对相关病变的组织学评估,仍然是目前鉴别诊断的最佳策略。
3、细支气管腺瘤,以及其他产生黏蛋白产生的良性肺肿瘤
近端和远端型细支气管腺瘤(BA),均含有粘液上皮细胞,基底细胞层的保留,是两种类型BA的基本特征,它的存在,可以排除IMA。然而,两者的鉴别,在术中冷冻切片的诊断具有挑战性。
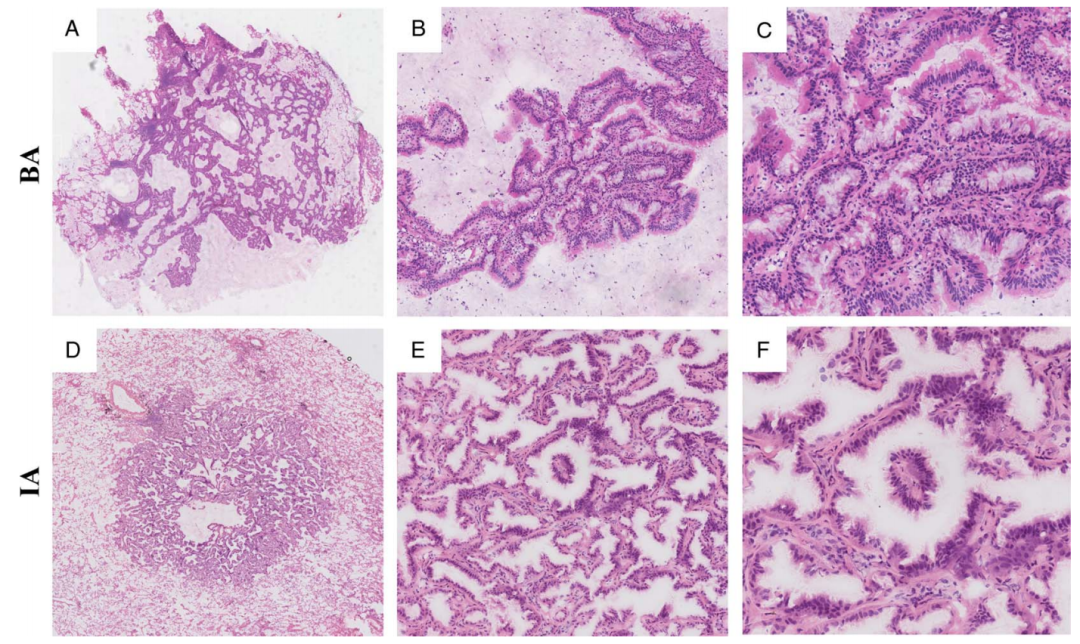
图5. 细支气管腺瘤(BA)和浸润性腺癌(IA)的乳头状结构。A和B,低中倍放大BA的乳头状结构。C,BA的乳头一般为圆形,轮廓光滑,表面有纤毛细胞、粘液细胞和底部连续的基底细胞。D和E,低、中放大倍数下IA的乳头状结构。F,IA的乳头纤细、坚硬、复杂,表面为非典型上皮细胞,底部无基底细胞。图片源自Am J Surg Pathol 2023;47:431–439
4、慢性呼吸道疾病中的黏液性化生
不同程度的杯状细胞化生,是慢性炎症和纤维化肺疾病的显著特征。在这些疾病中,评估支气管血管束和远端肺实质之间的关系存在困难。特别是对于终末期肺纤维化,蜂窝囊肿和细支气管周围化生伴黏液上皮化生,都可类似于IMA的形态。此外,间质性肺炎(UIP)与IMA相关。
在一些形态不典型的病例中,没有形态学或免疫组化标记物,可以可靠地区分IMA和良性病变。基因组测序识别癌症相关突变的范围,会受到小诊断样本中组织数量的影响。最近,空间蛋白质组学研究发现,UIP上皮中的MUC5B和MUC5AC,与IMA的表达模式存在差异。然而,黏蛋白染色在这种情况下的诊断价值,值得进一步研究。
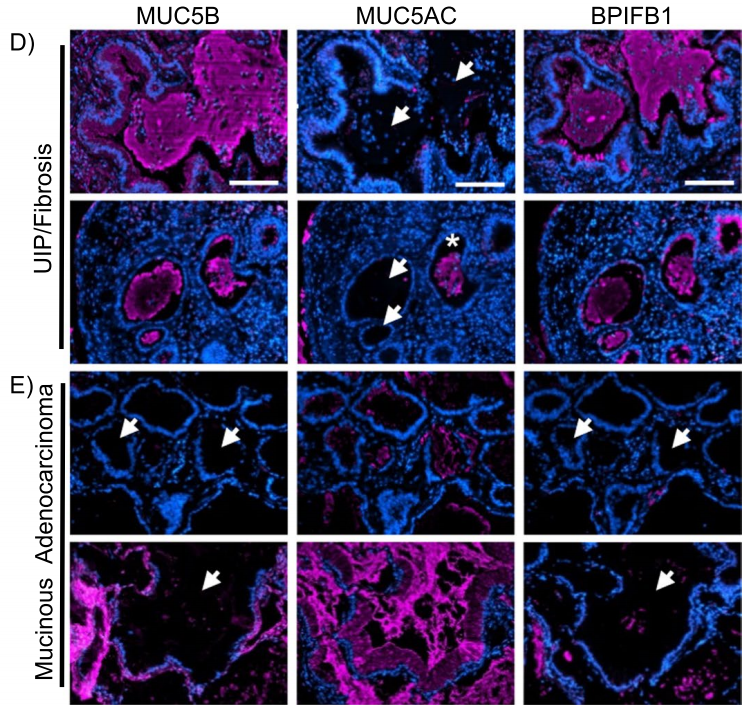
图6. UIP黏液和黏液腺癌黏液中MUC5B、MUC5AC和BPIFB1的免疫荧光,显示每种疾病类型的代表性图像。白色箭头表示黏液积累区域,星号表示UIP黏液中MUC5AC阳性。图片源自Herrera et al. Respiratory Research (2023) 24:99
总结
虽然非黏液腺癌的分型和分级,已成为WHO分类的一部分,但对IMAs和其他黏液腺癌的模式的评估滞后,是由于其相对罕见导致的相关证据缺乏。然而,越来越多的证据表明,分级系统,具有潜在预后价值,以及更准确的生长模式和核特征的评估。基因组学的进展也强调,这些肿瘤有肺内转移的倾向,未来的分期和治疗策略,需要参考IMAs疾病进展的不同模式。
参考文献及书籍:
Chang WC, Zhang YZ, Nicholson AG. Pulmonary invasive mucinous adenocarcinoma. Histopathology. 2024 Jan;84(1):18-31. doi: 10.1111/his.15064. Epub 2023 Oct 22. PMID: 37867404.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)