首页 > 医疗资讯/ 正文
奥希替尼是一种第三代EGFR抑制剂,用于治疗伴有EGFR突变的转移性、局部晚期和早期非小细胞肺癌(NSCLC)。这篇综述重点关注那些促使奥希替尼应用于局部晚期和早期NSCLC的临床研究。3期临床试验支持将奥希替尼作为辅助治疗以及局部晚期疾病治疗的新标准。ADAURA研究报告了辅助使用奥希替尼对完全切除的II-IIIA期EGFR突变肿瘤患者在总生存期(OS)方面的优势,而LAURA研究证明了对于局部晚期疾病接受同步放化疗后使用奥希替尼维持治疗的EGFR突变患者,在无进展生存期(PFS)方面有统计学意义的获益,并且延缓了中枢神经系统转移的发生。在新辅助治疗方面,关于奥希替尼疗效的数据存在矛盾;因此,Neo-ADAURA研究正在评估新辅助使用奥希替尼单独或联合化疗对II-IIIB期NSCLC且伴有常见EGFR突变患者的有效性和安全性。研究者还讨论了几个需要阐明的问题,例如该药物对罕见突变的疗效、对生存期的长期影响以及耐药机制的管理。此外,研究者报告了一些试图识别潜在疗效生物标志物(如循环肿瘤DNA(ctDNA))的研究,目的是筛选出最能从奥希替尼治疗中获益的患者。
研究背景
EGFR突变NSCLC患者的治疗,在EGFR TKIs应用于临床实践后发生了根本性变化,无论是在转移性阶段还是在疾病的早期阶段。文献数据显示,在白种人和亚洲NSCLC患者中,EGFR突变的检测率分别约为13%和50%。这些突变在非鳞状细胞组织学类型、女性以及从不吸烟或轻度吸烟的患者中更为常见。EGFR突变位于激酶的ATP结合位点内,并且对EGFR抑制剂表现出不同的敏感性。大多数EGFR突变(85-90%)是19号外显子的框内缺失和21号外显子L858R突变:这些是常见的激活突变,对EGFR TKIs高度敏感。其余的突变(10-15%)包括18号外显子点突变、21号外显子L861X、20号外显子插入和20号外显子S768I:这些突变与较短的生存期相关,并且对TKIs表现出不同的敏感性。具体而言,20号外显子插入的肿瘤预后与野生型肿瘤相似,并且对化疗反应更好。此外,在790位氨基酸处由蛋氨酸替代苏氨酸的继发性点突变(T790M)已成为对EGFR TKIs的主要获得性耐药机制。
多年来,已经开发出几种针对转移性EGFR突变NSCLC中EGFR突变的TKIs。第一代TKIs吉非替尼和厄洛替尼在伴有EGFR常见激活突变的NSCLC患者中,与化疗相比显示出显著更长的PFS。随后,第二代TKIs阿法替尼和达可替尼与第一代TKIs相比,报告了更好的生存期。最后,第三代TKI奥希替尼最初被批准用于在EGFR TKI治疗期间或之后发生EGFR T790M突变的患者,因为它与化疗相比在生存期方面具有优势,然后被用作未接受过治疗患者的一线治疗,与第一代TKIs相比在生存期方面具有统计学意义的获益(表1)。
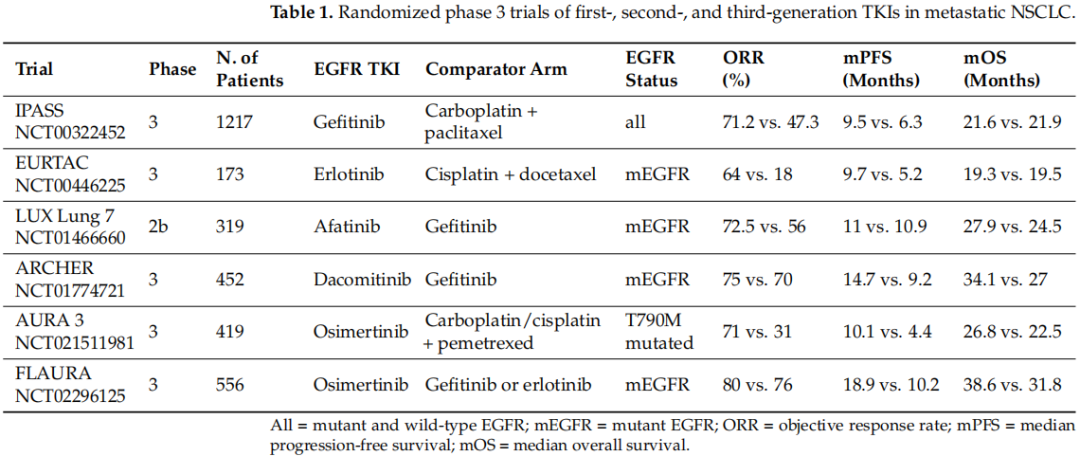
表1
基于在转移性疾病中报告的结果,奥希替尼已经在疾病的早期阶段进行了研究,也证实了它在这些阶段对生存期的显著影响,并成为国际指南中的新治疗标准。
研究者回顾了奥希替尼作为完全切除的EGFR突变NSCLC的辅助治疗、局部晚期疾病同步放化疗后的维持治疗以及新辅助治疗中的术前治疗的科学证据和临床影响。此外,研究者讨论了与奥希替尼治疗管理相关的未解决问题,包括在治疗期间可能出现的耐药机制(图1)。这些机制可以是内在的或获得性的,后者可分为EGFR依赖性(或靶内)和EGFR非依赖性(或脱靶)。通过组织重新活检或液体活检准确检测这些机制,使我们能够确定最佳治疗选择,并为每位患者定制治疗方案。
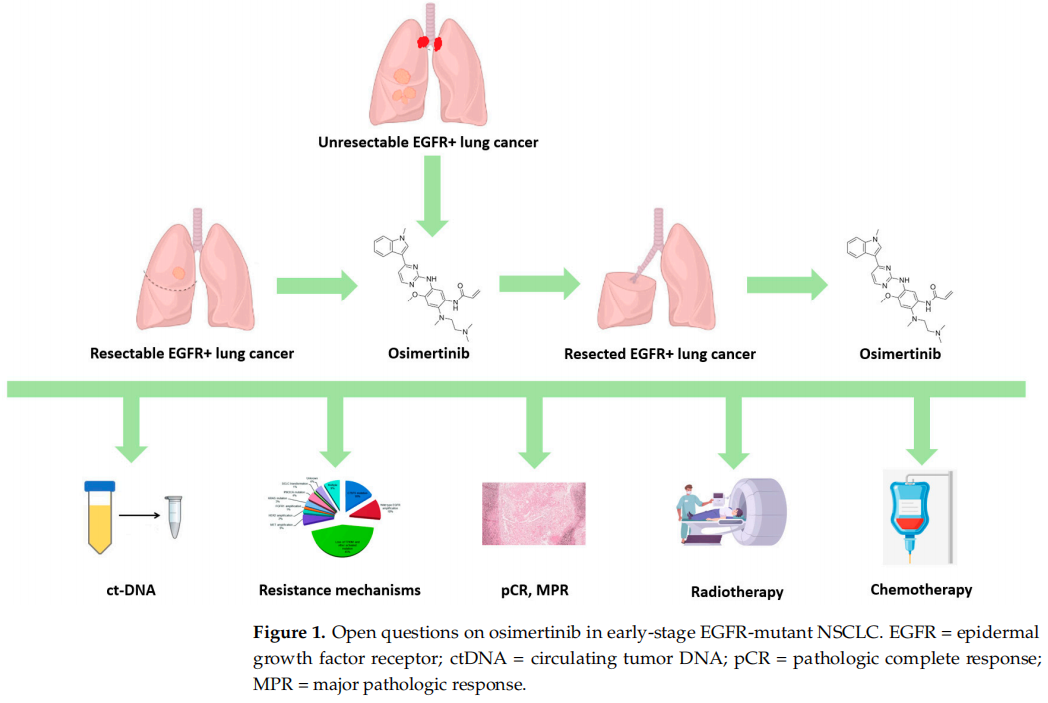
图1
奥希替尼用于辅助治疗
约30%的NSCLC病例在确诊时可切除。多年来,对于病理分期为IIB和III期(根据TNM第8版)的患者,手术后化疗是指南推荐的唯一术后治疗方法,而对于IIA期(T ≥ 4 cm)的患者,化疗仅作为可考虑的治疗手段。然而,无病生存期(DFS)和OS方面生存获益有限,5年生存率估计为4%-5%。近年来,免疫疗法和奥希替尼分别应用于EGFR野生型和突变型患者,辅助治疗发生了彻底变革。奥希替尼已被批准用于术后II至IIIA期EGFR突变患者的辅助治疗。
ADAURA研究是一项3期、双盲、安慰剂对照的国际试验,该试验将完全切除的伴有常见EGFR突变的NSCLC患者按1:1的比例随机分配,接受口服奥希替尼(剂量为80毫克,每日一次)或安慰剂治疗,为期3年,患者之前接受或未接受辅助化疗。患者根据疾病分期(IB、II或IIIA期)、EGFR突变状态(19号外显子缺失或L858R)和种族(亚洲或非亚洲)进行分层。主要终点和次要终点见表2。从2015年11月至2019年2月,共纳入682例患者:339例接受奥希替尼治疗,343例接受安慰剂治疗。两组患者的基线特征良好平衡。在奥希替尼组中,大多数患者为女性(68%)、亚洲人(64%)和从不吸烟者(68%),中位年龄为64岁,腺癌患者占96%;术后分期为IB、II和IIIA期的患者分别占32%、34%和35%;60%的患者淋巴结阳性并接受了辅助化疗。在2020年1月的数据截止时,中位随访22.1个月后,该研究达到了主要终点,II至IIIA期患者中,奥希替尼组的DFS明显长于接受安慰剂的患者(HR为0.17;96.06%CI为0.11-0.26;p < 0.001)。奥希替尼组的中位DFS未达到(95% CI,38.8-未达到(NR)),而安慰剂组为19.6个月(95% CI,16.6-24.5)。在总体人群中也观察到DFS方面的获益(HR 0.20;99.12% CI,0.14-0.30;p < 0.001),并且在所有亚组患者中,无论分期和之前是否使用化疗,均有获益。
这些结果在随后2022年4月的数据截止时得到了证实。中位随访44.2个月后,总体人群和II期及III期人群的DFS风险比分别为0.27(95% CI,0.21-0.34)和0.23(95% CI,0.18-0.30)。接受奥希替尼治疗的患者发生局部/区域和远处复发的比例低于接受安慰剂的患者。接受奥希替尼治疗的II-IIIA期患者4年无病生存的概率为70%,而接受安慰剂治疗的患者为29%。此外,在同一人群中,奥希替尼治疗与较低的中枢神经系统复发率相关(中枢神经系统DFSHR 0.24;95% CI,0.14-0.42)。
2023年,成熟的OS数据公布:在总体人群中,奥希替尼组的5年OS为88%,安慰剂组为78%(HR,0.49;95.03% CI,0.34-0.70;p < 0.001)。在II-IIIA期疾病人群中,奥希替尼组的5年OS为85%(95% CI,79-89),安慰剂组为73%(95% CI,66-78)(HR 0.49;95.03% CI,0.33-0.73;p < 0.001)。
关于毒性方面,奥希替尼显示出良好的安全性(表2)。与奥希替尼相关的最常见的任何级别毒性包括腹泻(46%)、甲沟炎(25%)、皮肤干燥(23%)和瘙痒(19%)。奥希替尼组和安慰剂组中,间质性肺病的报告发生率分别为3%和0%。表2总结了因不良事件导致的剂量中断、剂量减少和停药情况。
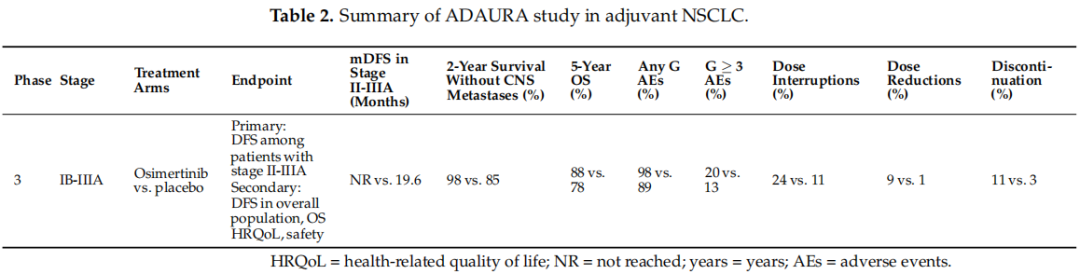
表2
正在进行的奥希替尼用于切除的EGFR突变NSCLC辅助治疗的临床试验见表3。
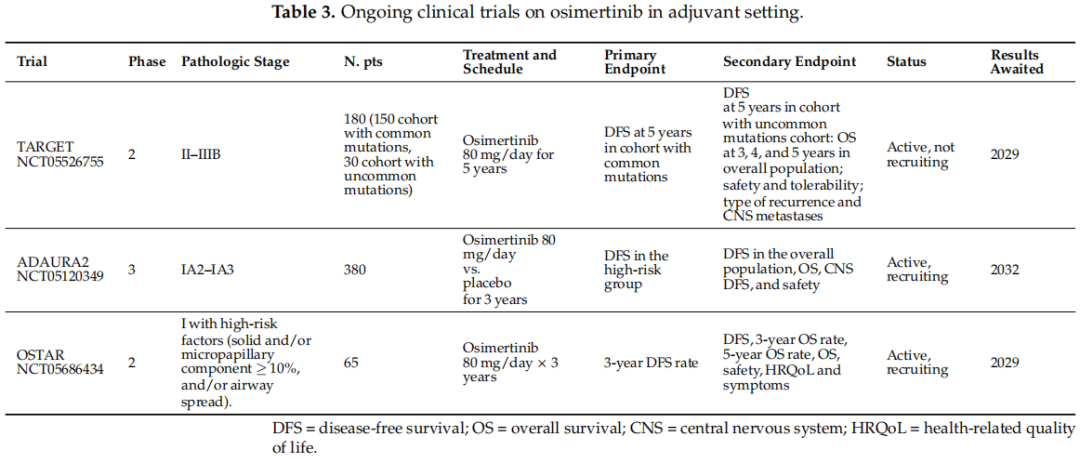
表3
待解决的问题:
尽管ADAURA研究报告了相关结果,但仍有许多问题尚未解决。首先,我们将讨论辅助化疗的作用。在ADAURA研究中,化疗主要用于年龄≤70岁且处于II期或IIIA期的患者;此外,60%的患者接受了铂类联合长春瑞滨或培美曲塞治疗。而且,患者没有根据先前是否使用过化疗进行分层。因此,虽然我们知道奥希替尼的获益与先前是否进行过化疗无关,但我们没有依据来决定哪些患者应接受化疗联合奥希替尼治疗,哪些患者应仅接受奥希替尼治疗。对于因年龄原因身体虚弱或存在合并症且美国东部肿瘤协作组(ECOG)体能状态较差的患者,可以考虑单独使用奥希替尼,而不进行先前的化疗。另一方面,对于复发风险较高的患者,例如淋巴结阳性的患者,应考虑先前使用化疗。
其次,应考虑最佳治疗持续时间。在ADAURA研究中,只有66%的患者完成了计划的3年奥希替尼治疗。可以推测,治疗持续时间越长,疾病控制效果越好,复发风险降低,DFS和OS改善。因此,设计了TARGET研究,目前正在进行中。这是一项2期、多中心、开放标签、单臂试验,针对完全切除的II至IIIB期非小细胞肺癌患者,这些患者伴有常见的(19号外显子缺失或L858R)或罕见的(G719X、L861Q和/或S768I)EGFRTKI敏感突变。他们接受每日一次80毫克奥希替尼治疗,为期5年,或直至疾病复发、停药或死亡。允许先前进行辅助化疗。主要终点是常见突变队列的5年无病生存期。次要终点包括罕见突变队列的5年DFS;总体人群的3年、4年和5年OS;安全性和耐受性;复发类型;以及中枢神经系统转移(两个队列)。预计该研究结果将于2029年得出(表3)。
第三,奥希替尼对罕见突变的疗效值得关注。在ADAURA研究中,只有伴有常见突变(19号外显子缺失和L858R)的患者接受了辅助奥希替尼治疗;因此,不推荐对罕见突变患者使用奥希替尼。在转移性一线治疗中,尽管FLAURA研究排除了伴有罕见突变的患者,但来自真实世界实践和前瞻性2期研究的证据证实了奥希替尼在这部分患者亚组中的疗效。这表明奥希替尼在辅助治疗伴有罕见突变的患者中也可能有效,但仍需前瞻性数据支持。
共存突变的预后作用是影响奥希替尼在辅助治疗中疗效的另一个因素。ADAURA研究缺乏这方面的数据,但文献数据表明,在早期EGFR突变的非小细胞肺癌中,蛋白53(p53)是最常见的共存突变基因,并且在这种情况下也与不良预后相关。
然而,p53仅具有预后作用,不具有预测作用,因此,仅p53阳性不能作为排除患者接受奥希替尼治疗的充分依据。
另一个问题是辅助奥希替尼在更早期阶段的作用。在ADAURA研究中,从肿瘤≥3 cm的患者开始,所有阶段的患者都显示出奥希替尼的优势,尽管优势相对有限。ADAURA2是一项3期、随机、双盲、安慰剂对照研究,评估了手术切除后IA2-IA3期EGFR突变非小细胞肺癌患者中辅助奥希替尼与安慰剂的疗效,根据疾病复发的病理风险(高风险与低风险)、EGFR突变类型(19号外显子缺失与L858R)和种族(中国亚裔、非中国亚裔与非亚裔)进行分层。患者将接受每日80毫克奥希替尼或安慰剂治疗,直至疾病复发、停药或最长治疗持续时间为3年。主要终点是高风险组的DFS。次要终点包括总体人群的DFS、OS、中枢神经系统DFS和安全性。该研究目前正在招募患者,主要终点的中期结果预计于2027年8月得出。与此同时,不建议对I期患者提供辅助奥希替尼治疗。
另一个话题是如何选择接受辅助奥希替尼治疗的患者。在48个月时,奥希替尼组无病生存的患者比例为73%(95%CI,67%-78%),安慰剂组为38%(95%CI,32%-43%)。这意味着大约三分之一的患者即使不接受奥希替尼治疗也可能被治愈。因此,确定复发高风险且可能从辅助治疗中获益的患者至关重要。最有前景的复发生物标志物是基于术后循环肿瘤DNA(ctDNA)检测的微小残留病(MRD)。
ADAURA研究中关于ctDNA的数据在2024年ASCO年会上公布。在682例随机分组的患者中,两组中32%(220例)的患者样本可用于评估MRD。在基线时,奥希替尼组112例患者中有5例(4%)和安慰剂组108例患者中有13例(12%)为MRD阳性:接受奥希替尼治疗的5例患者中有4例(80%)转为MRD阴性,而接受安慰剂治疗的13例患者中没有一例转为MRD阴性。MRD检测的临床敏感性和特异性分别为65%和95%,并且在两组中,在DFS事件发生前中位时间为4.7个月(95%CI,2.2-5.6个月)检测到MRD。在3年时,接受奥希替尼治疗的患者中86%为MRD阴性且无疾病,而安慰剂组为36%(HR:0.23;95%CI,0.15-0.36)。这些数据支持使用MRD检测来识别可能从更长时间的辅助奥希替尼治疗中获益的患者。
CTONG 2201是一项正在进行的前瞻性、多中心、单臂研究,旨在证明病理分期为IB-IIIA期的NSCLC患者在术后纵向检测不到MRD时不需要辅助治疗。
ECTOP-1022(NCT06323148)是一项3期研究,将评估II-IIIA期NSCLC伴EGFR突变且ctDNA阳性患者中辅助奥希替尼与观察治疗的应用情况。
最后一个需要考虑的问题是在辅助奥希替尼治疗期间或完成后疾病进展的治疗方案。在ADAURA研究中,奥希替尼组76例患者(22%)接受了后续抗癌治疗,而安慰剂组为184例(54%)。在奥希替尼组中,58例(76%)患者接受了EGFR TKI治疗:31例(41%)患者首选奥希替尼,而只有20例(26%)患者接受了化疗。在文献中,没有来自3期临床试验的数据来指导疾病复发时的治疗选择。我们知道,通过EGFR TKIs可能会产生多种耐药机制,但这些数据主要来自接受一线或后续治疗的患者。两项病例报告描述了在辅助奥希替尼治疗后复发的患者中再次使用奥希替尼成功治疗的情况,这与在辅助厄洛替尼治疗后复发的患者中再次使用厄洛替尼的2期试验结果一致。然而,这种方法仅适用于辅助奥希替尼治疗完成后经过足够时间间隔的情况。当在治疗期间出现复发时,应考虑化疗,或者后续治疗应根据确定导致疾病进展的特定耐药机制来指导。然而,我们知道,由于并非所有癌症中心都能进行NGS,并且难以获得患者在生物分子重新鉴定后可能适用的药物,后一种方法实施起来较为困难。NCT06530719研究是一项正在进行的研究,目前尚未开始招募患者,旨在验证在根治性手术后接受辅助靶向治疗后疾病进展的EGFR突变NSCLC患者中再次使用奥希替尼的疗效和安全性。
ROSIE (NCT06053099)是一项正在进行中的前瞻性队列研究,旨在评估奥希替尼辅助治疗具有常见EGFR突变的完全切除的IB-IIIA期NSCLC的分子预后因素和耐药机制。评估通过对ctDNA和福尔马林固定石蜡包埋(FFPE)组织进行集中NGS来进行。RAISE(NCT06477055)是另一项前瞻性、多中心2期研究,将评估切除的EGFR突变NSCLC中辅助奥希替尼治疗后的复发基因谱。
奥希替尼用于局部晚期NSCLC
III期患者约占确诊NSCLC病例的30%。根据PACIFIC研究的结果,这些患者中的大多数患有不可切除的疾病,适合接受同步放化疗,随后接受度伐利尤单抗维持治疗一年。对该研究的事后探索性分析报告了35例EGFR突变患者的疗效和安全性数据,其中24例接受度伐利尤单抗治疗,11例接受安慰剂治疗:在PFS和OS方面未观察到差异。然而,由于纳入分析的患者数量较少,这些数据必须谨慎解读;此外,大多数患者为男性(54%)和吸烟者(54%)。尽管真实世界数据也证实了度伐利尤单抗维持治疗在EGFR突变患者中的潜在作用,但多年来,基于TKI维持治疗EGFR突变患者的策略被认为是最有前景且值得研究的。
LAURA研究是一项3期、双盲、安慰剂对照试验,将不可切除的III期非小细胞肺癌患者(伴有EGFR 19号外显子缺失或21号外显子L858R点突变,且在放化疗期间或之后未出现疾病进展)按2:1的比例随机分组,接受奥希替尼或安慰剂治疗,直至疾病进展。主要终点和次要终点见表4。从2018年8月至2022年7月,共纳入216例患者:143例接受奥希替尼治疗,73例接受安慰剂治疗。两组患者的基线特征良好平衡。在奥希替尼组中,大多数患者为女性(63%)、亚洲人(81%)和从不吸烟者(71%),中位年龄为62岁,腺癌患者占97%;分期为IIIA、IIIB和IIIC期的患者分别占36%、47%和17%;52%的患者为19号外显子突变,48%的患者为L858R突变;92%的患者接受了同步放化疗。在2020年1月的数据截止时,中位随访22个月后,接受奥希替尼治疗的患者的PFS明显长于接受安慰剂的患者(39.1个月 vs. 5.6个月;PFS风险比:0.16;95%CI,0.10-0.24;p < 0.001)。在1年和2年时,试验组患者的生存率分别为74%和65%,而安慰剂组分别为22%和13%。在所有亚组患者中均观察到PFS方面的获益。奥希替尼组的局部进展和远处转移发生率低于安慰剂组(分别为21%和16%)。反应率、中位反应持续时间和不良事件的数据见表4。最常见的副作用是放射性肺炎(奥希替尼组为48%,安慰剂组为38%)、腹泻(36% vs. 14%)和皮疹(24% vs. 14%)。
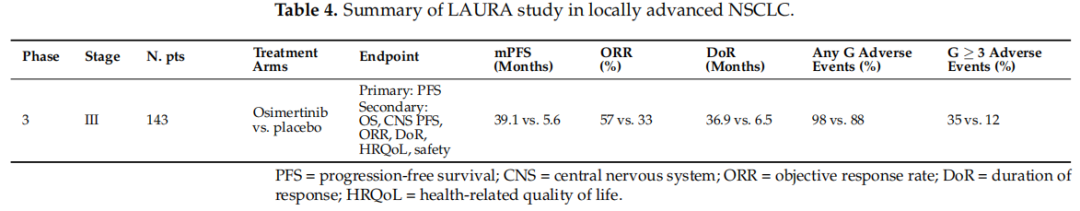
表4
LAURA研究中关于奥希替尼对CNS疾病控制影响的分析最近已发表。与安慰剂相比,奥希替尼与更少的CNS PFS事件相关:分别为29/143(20%)和30/73(41%)。在两组中,大多数CNS PFS事件是由于中枢神经系统进展(奥希替尼组和安慰剂组分别为13%和36%)。接受奥希替尼治疗的患者的中位CNS PFS明显长于接受安慰剂治疗的患者(未达到vs. 14.9个月,95%CI 7.4-未达到),对应于奥希替尼使中枢神经系统进展或死亡的风险降低83%(HI 0.17;95%CI 0.09-0.32,p < 0.001)。奥希替尼组中枢神经系统进展的累积发生率低于安慰剂组:1年时为9% vs. 36%,2年时为12% vs. 37%。此外,奥希替尼组中发生死亡或远处转移事件的患者百分比低于安慰剂组(23% vs. 42%)。奥希替尼组发生远处转移的中位时间(TTDM)未达到(95%CI 39.3个月-未达到),而安慰剂组为13.0个月(95%CI 9.0个月-未达到);HR 0.21(95%CI 0.11-0.38;p < 0.001)。这意味着与安慰剂相比,奥希替尼使远处转移或死亡的风险降低79%。奥希替尼组远处转移的累积发生率低于安慰剂组:1年时为11% vs. 37%,2年时为14% vs. 39%。
一项最近的回顾性研究比较了奥希替尼和度伐利尤单抗作为III期不可切除非小细胞肺癌且伴有EGFR敏感突变患者放化疗后维持治疗的情况,结果表明巩固性奥希替尼治疗与显著更长的PFS相关。
正在进行的奥希替尼用于局部晚期EGFR突变非小细胞肺癌的临床试验见表5。
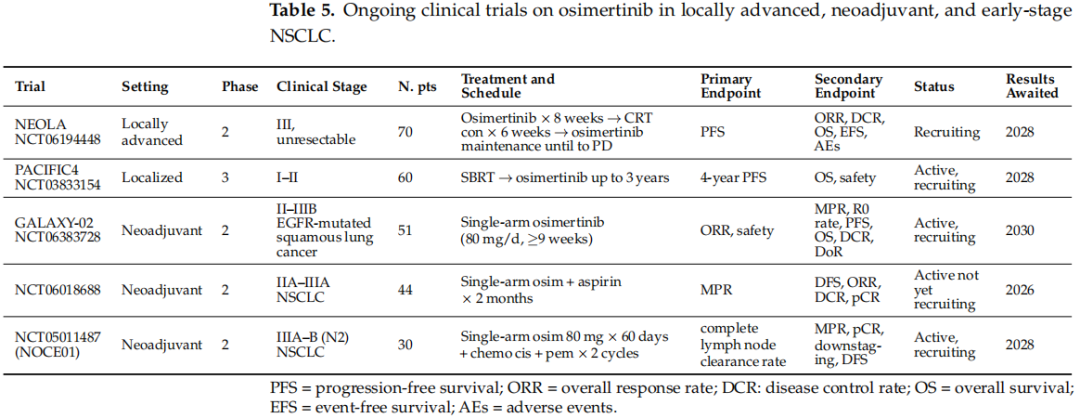
表5
待解决的问题:
LAURA研究的数据彻底改变了EGFR突变局部晚期NSCLC患者的治疗,成为这些患者的新标准治疗方法。然而,一些问题仍需进一步探讨。
与ADAURA研究类似,LAURA研究也仅纳入了伴有常见突变的患者。因此,奥希替尼对罕见突变患者的获益仍需进一步研究。真实世界数据可能支持奥希替尼的疗效及其在罕见突变患者中的应用,但需要前瞻性研究的数据来证实这一方法。
第二个问题是奥希替尼的长期疗效。到目前为止,LAURA研究的OS数据尚未公布,因为随访时间较短,数据尚不成熟。在OS的中期分析中,数据成熟度为20%,在OS方面未发现奥希替尼和安慰剂之间的显著差异。
根据研究设计,奥希替尼一直使用至疾病进展,但尚不清楚是否所有患者都需要在疾病进展前一直服用该药物。从这个意义上说,ctDNA的数据将有助于量化残留疾病,并确定哪些患者真正从持续使用奥希替尼直至疾病进展中获益。这一点非常重要,因为持续治疗与耐药性的产生相关。
此外,另一个问题是如何处理疾病进展。在LAURA试验中,两组患者在疾病进展后都可以接受奥希替尼治疗。在安慰剂组中,81%发生疾病进展的患者接受了后续的奥希替尼治疗。在奥希替尼组中,如果患者在疾病进展后仍能从奥希替尼治疗中获得临床获益,则28%的患者会继续使用奥希替尼。显然,在没有确凿证据的情况下,在临床实践中,选择在疾病进展后继续使用该药物而不是切换到二线化疗,需要仔细评估风险-获益比。
奥希替尼用于新辅助治疗
近年来,多项随机临床试验研究了免疫检查点抑制剂(ICIs)联合化疗作为可切除非小细胞肺癌新辅助治疗的作用,结果显示无事件生存期(EFS)有统计学意义的延长,病理完全缓解(pCR)率增加,pCR被认为是OS的替代指标。然而,除了KEYNOTE-671研究外,所有这些研究都排除了EGFR突变患者,这些患者被纳入了专门针对EGFR突变疾病设计的临床试验。
NEOS研究是一项单臂2期试验,研究了奥希替尼作为新辅助治疗在40例IIA-IIIB期肺腺癌且伴有经典EGFR突变患者中的作用。在完成6周奥希替尼治疗的38例患者中,ORR为71.1%;32例患者接受了手术,其中30例患者切缘阴性(93.8%)。尽管75%的患者出现了不良事件,但毒性是可控的,最常见的不良事件为皮疹(50%)、腹泻(30%)和口腔溃疡(30%)。
在另一项2期试验中,I-IIIA期EGFR突变(19号外显子缺失或L858R)非小细胞肺癌患者在手术前接受每日80毫克奥希替尼治疗,最多两个28天周期。共有27例患者在手术前接受了中位时间为56天的治疗,89%的患者接受了手术。主要病理缓解(MPR,定义为新辅助治疗后手术中发现的肿瘤不同部位存活肿瘤细胞的比例)为14.8%;未观察到pCR,但96%的患者达到部分缓解或疾病稳定。手术切除后的中位DFS为32个月(95%CI;26个月,未达到),中位随访时间为11个月。然而,未达到50%MPR这一主要终点。
NeoADAURA是一项3期研究,评估新辅助奥希替尼单独使用或联合化疗与单纯化疗相比,在II-IIIB期NSCLC且伴有常见EGFR突变患者中的有效性和安全性,随后进行手术和辅助治疗。该研究的主要终点是评估切除时的MPR;次要终点包括EFS、pCR、切除时的淋巴结降期、DFS、OS、健康相关生活质量(HRQoL)、在筛查时ctDNA中可检测到或未检测到EGFR突变患者的MPR,以及基线肿瘤DNA和ctDNA之间的一致性。该研究预计招募351例患者,以检测20%的MPR的统计学显著差异。该研究正在进行中。
新辅助奥希替尼也被研究用于放疗前的疾病降期。一项非随机、单臂、2期前瞻性试验纳入了不可手术的III期EGFR突变NSCLC患者,这些患者接受每日80毫克奥希替尼治疗12周。有反应的患者接受根治性放疗(RT)和/或手术;无反应的患者接受标准同步放化疗(CRT);然后,患者在无辅助治疗的情况下随访2年。主要终点是ORR;次要终点是安全性以及奥希替尼治疗前后肿瘤体积变化的相关参数。该研究纳入了24例IIIA-C期患者,其中大多数为腺癌患者。奥希替尼的ORR为95.2%;在诱导使用奥希替尼后,20例患者中有13例接受了放疗,3例接受了手术。此外,奥希替尼诱导显著降低了近50%的放疗野,并且与肿瘤大小呈线性相关。
最后,奥希替尼目前也正在被研究作为立体定向体部放疗(SBRT)后的巩固治疗。PACIFIC-4是一项国际3期研究,纳入了60例局部疾病的EGFR突变NSCLC患者队列,这些患者适合接受SBRT,随后接受每日口服80毫克奥希替尼治疗,最长36个月。纳入标准为常见EGFR突变(19号外显子缺失或L858R)、未切除的I-II期(T1-T3,N0,M0)以及ECOG PS为0-2。主要终点是4年PFS;次要终点是OS和安全性。该试验正在招募患者(表5)。
其他正在进行的将奥希替尼作为EGFR突变NSCLC新辅助治疗的临床试验见表5。
待解决的问题:
新辅助奥希替尼在EGFR突变NSCLC中具有多项益处:它可以使肿瘤降期并使其可手术切除;此外,早期开始使用奥希替尼可能降低远处转移的风险。然而,也需要强调一些缺点:首先,存在延迟手术干预或出现手术并发症(如粘连或纤维化)的风险;此外,一定比例的患者对奥希替尼治疗无反应,且从未接受手术。其次,从方法学角度来看,关于新辅助奥希替尼的研究存在一些弱点:病理缓解尚未被验证为肺癌OS的替代指标,且缺乏长期生存的成熟数据。此外,这些研究的数据有时不一致:尽管ORR较高,但并非总是能达到主要病理缓解终点。
另一个未解决的问题是新辅助治疗与辅助治疗之间的比较:事实上,由于缺乏随机对照研究,无法确定新辅助奥希替尼是否优于辅助奥希替尼。
在新辅助治疗期间,ctDNA可能在识别术后微小残留病患者方面发挥重要作用,这些患者单独使用奥希替尼获益有限,需要升级为全身治疗。
Neo-Bio-ADAURA(NCT06206850)是一项单臂2期研究,将从NeoADAURA研究中招募20例患者,其肿瘤标本(包括组织活检)将用于识别对治疗耐药的分子机制。
奥希替尼的耐药机制
耐药的产生是治疗EGFR突变非小细胞肺癌时面临的主要问题之一。在关于奥希替尼用于辅助治疗和局部晚期治疗的部分中,已经对这一话题进行了部分探讨。特别是,基于纯粹的临床评估,例如在奥希替尼治疗期间或结束后疾病进展的情况,已经对患者的临床管理给出了一些建议。然而,最合适的方法应该是基于对疾病的生物分子重新表征,以便根据导致疾病进展的分子机制来确定个性化治疗方案。
我们尚未完全理解在疾病早期使用奥希替尼时产生的耐药机制,目前我们使用的是来自转移性疾病的数据。然而,我们知道,即使将该药物作为一线或二线治疗用于经治患者,耐药机制在发生率和类型方面也有所不同。同样,当奥希替尼用于非小细胞肺癌早期时,这些机制也可能不同。对奥希替尼的耐药可以是内在的或获得性的;获得性耐药可分为EGFR依赖性(或靶内)和EGFR非依赖性(或脱靶)。内在耐药机制在开始使用奥希替尼的6个月内出现,约20%-30%的患者会发生。这些机制包括20号外显子插入、除20号外显子插入之外的罕见EGFR突变,以及同时发生的基因组变异,如TP53、MET、RB1、ERBB2、KRAS和PIK3CA。近年来,还发现酪氨酸激酶受体AXL与肿瘤进展、上皮-间质转化(EMT)以及对奥希替尼的原发性耐药相关:它加速了T790M的出现,并且其水平与患者肿瘤的突变负荷呈正相关。AXL还通过激活低保真度DNA聚合酶、激活MYC以及导致吡啶/嘧啶代谢失衡,保护药物耐受细胞免受治疗诱导的DNA损伤,从而促使对奥希替尼的耐药。
人们对利用ctDNA来评估对奥希替尼耐药的肿瘤中AXL和高保真度DNA聚合酶的水平非常感兴趣,并且基于使用能够靶向EGFR和AXL并延缓对奥希替尼耐药的联合用药,其潜在的治疗意义也备受关注。
两种更常见的EGFR依赖性耐药机制是T790M缺失和C797S突变。反式C797S与T790M同时出现可恢复对第一代EGFRTKI和奥希替尼联合治疗的敏感性。EGFR非依赖性耐药机制包括MET变异(如扩增或14号外显子跳跃)、HER2扩增、KRAS突变、BRAF变异(突变或重排)、PTEN缺失和PIC3AK变异。
最近的数据表明,来自常规多基因panel检测的载脂蛋白B mRNA编辑酶催化多肽样(APOBEC)突变特征,可以提供关于对奥希替尼耐药机制的基因组信息,并指导克服耐药的干预策略。
临床前数据和临床报告支持在检测到可靶向的致癌变异(突变、扩增或融合)时,将奥希替尼与另一种抑制剂联合使用:例如,奥希替尼与MET或BRAF抑制剂联合分别是克服由MET扩增或BRAF突变引起的对奥希替尼耐药的合理策略。
然而,这些治疗方法尚未在随机临床试验中得到评估;此外,约30%-50%的奥希替尼耐药机制仍不清楚。因此,当对奥希替尼治疗出现进展时,化疗仍然是标准治疗方法。此外,3%-15%的患者可能会发生组织学转化,主要转化为小细胞癌。这凸显了尽可能通过组织重新活检获取当时样本的重要性;否则,可以进行液体活检。
结论
奥希替尼应用于临床实践后,无论是转移性疾病还是局部晚期/早期的EGFR突变非小细胞肺癌的治疗都发生了彻底的改变。我们必须实现的首要目标是对所有患者进行EGFR检测:的确,鉴于奥希替尼在不同疾病阶段的可及性,在不了解EGFR突变状态的情况下选择治疗方案是不可接受的。基于ADAURA研究的数据,我们必须将奥希替尼作为根治性切除的非小细胞肺癌且术后分期为II至IIIA期患者辅助治疗的新标准。事实上,奥希替尼在总生存期方面的获益不仅具有统计学意义,而且最重要的是具有临床相关性。因年龄原因身体虚弱的患者以及存在合并症和ECOG体能状态较差的患者应单独接受奥希替尼治疗,而复发风险较高的患者,如淋巴结阳性的患者,可能从先前的以铂类为基础的辅助化疗中获益。奥希替尼的使用不应仅限于伴有常见EGFR突变的患者,也应扩展到伴有罕见突变的患者。到目前为止,p53共存突变仅具有预后作用;因此,仅检测到p53突变不足以排除患者接受奥希替尼治疗。
根据LAURA研究,对于同步放化疗后未进展的局部晚期EGFR非小细胞肺癌患者,奥希替尼也必须被视为维持治疗的新标准。奥希替尼的获益非常显著,不仅体现在生存期方面,还体现在延缓脑转移的发生方面。考虑到EGFR突变患者发生脑转移的高风险,这是一项重大成功。同样在这种情况下,我们认识到一系列尚未解决的问题,例如该药物对罕见突变的疗效、对生存期的长期影响以及耐药的处理。关于最后一点,我们建议,在缺乏随机研究数据的情况下,当出现寡进展时继续使用奥希替尼而不是切换到二线化疗是合理的,但要仔细评估风险-获益比。最后,奥希替尼已在新辅助治疗方面进行了研究,尽管临床研究的数据存在争议,因为只有少数研究达到了主要病理缓解的主要终点。因此,到目前为止,这种方法仍需被视为试验性的。此外,同样在这种情况下,一些问题需要澄清,例如少数患者延迟手术或不进行手术的风险,以及病理完全缓解和无事件生存期作为总生存期替代指标的作用。当奥希替尼用作维持治疗或在新辅助治疗中时,ctDNA监测是对奥希替尼治疗反应以及确定切除患者残留疾病的最有前景的生物标志物。然而,到目前为止,其在临床实践中的应用在成为标准方法之前需要进行适当的验证。
未来方向
多项临床研究正在对奥希替尼展开调查,以解决其在早期EGFR突变非小细胞肺癌应用中尚未解决的问题。TARGET研究将尝试确定辅助治疗的最佳持续时间,比较手术干预后II-IIIB期患者接受3年和5年治疗的情况。ADAURA2是一项正在进行的3期试验,与OSCAR研究类似,该试验测试I期患者接受3年辅助奥希替尼治疗与安慰剂相比的疗效,OSCAR研究是一项单臂研究,评估具有高危因素的I期患者的DFS(表3)。需要进行转化研究,以更好地确定组织和血液中ctDNA在检测微小残留病方面的潜在用途,并识别复发风险较高且可能从辅助奥希替尼治疗中获益最多的患者。在不可切除的III期患者中,选择那些需要接受奥希替尼治疗直至疾病进展的患者,以及那些在足够疗程后可以停止治疗的患者,这一点非常重要。在这种情况下,ctDNA可能会提供有价值的帮助。此外,NEOLA研究正在评估同步放化疗前后给予奥希替尼对治疗反应和生存期的影响。在新辅助治疗方面,多项研究正在评估奥希替尼单独使用或与其他药物(如阿司匹林或化疗)联合使用对术后病理反应以及生存期结局的影响(表5)。在这方面,许多转化研究也在积极开展。手术干预后ctDNA阴性的患者可以避免接受辅助奥希替尼治疗,从而避免不必要的毒性。此外,NeoADAURA研究正在收集组织活检样本,以确定对治疗耐药的分子机制。这是接受奥希替尼治疗的EGFR突变患者中最重要的问题:这项转化研究通过识别耐药机制,可能会指导临床医生为患者选择最佳治疗方案。
参考文献:
Veccia, A.; Dipasquale, M.; Lorenzi, M.; Monteverdi, S.; Kinspergher, S.; Zambotti, E.; Caffo, O. Osimertinib in the Treatment of Epidermal Growth Factor Receptor-Mutant Early and Locally Advanced Stages of Non-Small-Cell Lung Cancer: Current Evidence and Future Perspectives. Cancers 2025, 17, 668. https://doi.org/10.3390/cancers17040668

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)