首页 > 医疗资讯/ 正文
近年来,免疫检查点阻断疗法在对抗包括胃癌 (GC) 在内的恶性肿瘤方面取得了显著进展。然而,免疫疗法在胃癌患者中的疗效仍然有限,需要进一步探索其潜在的分子机制以改善治疗效果。癌症高甲基化基因 1 (HIC1) 被认为是对细胞发育多个方面至关重要的转录调控因子,但其在抗肿瘤免疫反应中的作用仍不完全清楚。
2025 年 4 月 25 日,徐州医科大学基础医学院裴冬生唯一通讯在Advanced Science 在线发表题为“HIC1 suppresses Tumor Progression and Enhances CD8+ T Cells Infiltration Through Promoting GSDMD-induced Pyroptosis in Gastric Cancer”的研究论文。该研究揭示了胃癌中 HIC1 的显著下调,与预后不佳相关。HIC1 的过表达促进了细胞焦亡的发生。
从机制上讲,细胞焦亡的关键执行者 Gasdermin D (GSDMD) 被确定为 HIC1 的下游靶点,并在转录水平上被 HIC1 激活。随后,GSDMD N 端区域的裂解会刺穿细胞膜,引发细胞焦亡并释放炎症因子。此外,HIC1 能增强 CD8+ T 细胞的浸润,从而对抗免疫逃逸。HIC1 过表达与 PD-L1 抗体的组合疗法在胃癌治疗中显示出协同治疗作用。此外,c-Jun 激活结构域结合蛋白 1 (Jab1) 介导 HIC1 在 Lys517 位点的泛素化和蛋白酶体降解。最终,这些发现强调了 HIC1 作为胃癌免疫治疗靶点的潜力。

在全球范围内,胃癌 (GC) 是第五大常见恶性肿瘤,也是第四大癌症死亡原因,2020 年每 100 万例病例中约有 768 000 人死亡。值得注意的是,年轻人中 GC 的患病率明显上升。绝大多数患者在晚期才被诊断出患有 GC,预后较差。医学免疫学和分子生物学的最新进展引起了人们对免疫治疗领域的极大兴趣。例如,程序性死亡配体 1 (PD-L1) 与 T 细胞上的程序性死亡 1 (PD-1) 结合,触发 T 细胞失活并使肿瘤细胞逃避宿主的免疫反应。GC 衍生的外泌体促进 PD1 + TAM (肿瘤相关巨噬细胞) 的积累,这进一步削弱 CD8 + T 细胞的有效性并阻碍 GC 进展。此外,越来越多的证据表明,肿瘤微环境 (TME) 不仅在肿瘤发生发展中起着关键作用,而且与免疫疗法的疗效密切相关。Derks 等人指出了胃癌 (GC) 中肿瘤免疫微环境的异质性,强调了 TME 在胃癌免疫治疗反应中的重要作用。尽管免疫疗法已被证实对多种癌症有益,但并非所有 GC 患者都同样受益。因此,阐明 GC 发生发展的潜在机制以及 GC 细胞如何增强抗肿瘤免疫反应,可以为 GC 的前沿生物标志物和综合治疗策略提供参考。
现有证据表明,程序性细胞死亡 (PCD),包括细胞凋亡、铁死亡和细胞焦亡,在调控肿瘤发生发展中发挥着不可或缺的作用,为癌症免疫疗法带来了希望。细胞焦亡最初出现于20世纪80年代,其特征是细胞扩张、膜破裂、孔隙形成以及炎症细胞因子(例如白细胞介素-1β (IL-1β) 和白细胞介素-18 (IL-18))的产生,从而引发强烈的免疫反应。此外,研究表明,Gasdermin D (GSDMD) 是细胞焦亡的执行者。细胞焦亡涉及两条不同的炎症通路:经典通路和非经典通路。经典通路的激活主要依赖于 Caspase-1(在人类中)或 Caspase-4/5(在小鼠中)或 Caspase-11(在小鼠中)。近几十年来,越来越多的证据揭示了非凋亡性程序性细胞死亡与抗肿瘤免疫之间错综复杂的相互作用。值得注意的是,CD8+ T 淋巴细胞已被证明能显著降低 SLC7A11 的表达,SLC7A11 是一种负责半胱氨酸摄取、谷胱甘肽合成和铁死亡诱导的蛋白质。此外,在髓系细胞中,炎症小体介导的细胞焦亡与癌症进展和免疫力密切相关。Wang 等人的研究发现,肿瘤细胞焦亡显著增加了 CD8+ T 细胞和 CD4+ T 细胞的浸润百分比,并且在 T 细胞耗竭或免疫缺陷的小鼠中,肿瘤消退被消除。因此,阐明细胞焦亡与免疫之间错综复杂的相互作用对后续研究具有重要价值。
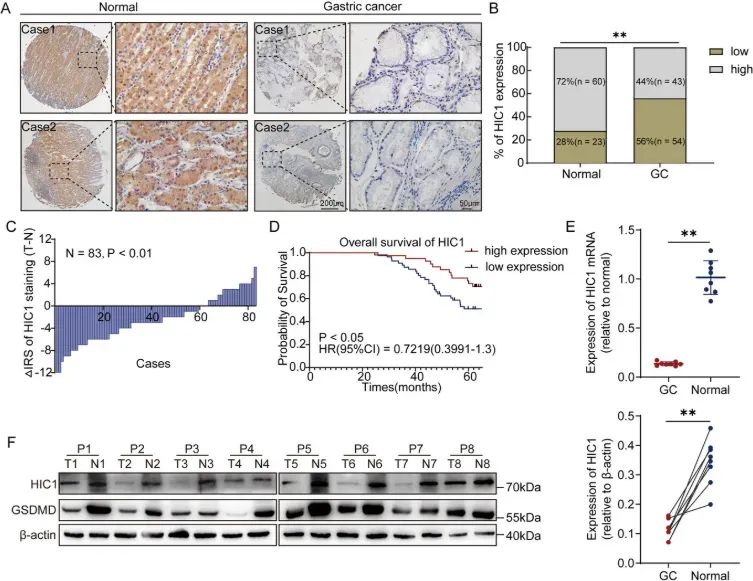
图1(图源自Advanced Science )
HIC1,通常被认为是Cancer 1基因的高甲基化基因,位于17p 13.3染色体上,参与了细胞增殖、转移和迁移等一系列生物学过程。此外,HIC1已被广泛认为编码了一个抑癌基因,该基因在多种癌症中通常处于表观遗传沉默状态,例如胰腺癌、乳腺癌、前列腺癌、肾细胞癌和喉癌。此外,HIC1还是BTB/POZ结构域和C2H2Krüppel样锌指家族的成员,这使其能够通过与特定基序结合发挥转录调控功能。最近的文献表明,HIC1启动子的高甲基化可能是胃癌中HIC1基因下调的关键因素。此外,HIC1可能通过维持正常的细胞代谢和减弱mTOR信号通路的激活来抑制胃癌的进展。HIC1表达的缺失与细胞增殖增强、细胞焦亡减弱和抗肿瘤免疫反应减弱密切相关,所有这些因素共同导致了肿瘤进展,并预示着我们研究中的不良预后。同样重要的是,研究表明HIC1还存在其他翻译后修饰机制,例如SUMO化、糖基化和乙酰化。本文重点介绍了HIC1与c-Jun激活结构域结合蛋白1(Jab1)之间的直接相互作用。Jab1也称为组成型光形态发生蛋白9(COP9)信号体复合物(CSN)的第五个亚基,参与调节蛋白质的稳定性、转录、蛋白质磷酸化和细胞内分布。尽管HIC1在多种恶性肿瘤中的作用已得到充分证实,但其在胃癌中的确切机制仍未得到充分阐明。因此,探讨HIC1表达与胃癌发病机制之间的相关性具有重要的科学意义。
本研究证实HIC1在胃癌中表达下调,且与预后不良显著相关。功能上,HIC1抑制细胞增殖,同时促进细胞焦亡,其特征是膜破裂和气泡形成。随后,我们的研究发现HIC1通过转录激活下游靶点GSDMD促进细胞焦亡,从而导致肿瘤浸润CD8+T细胞增多。最终,我们阐明了内源性Jab1与HIC1蛋白相互作用,并通过质谱分析鉴定了泛素化位点。这些发现强调了靶向HIC1作为增强治疗效果的策略的潜力。
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202412083
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)