首页 > 医疗资讯/ 正文
血管生成是指从已有血管形成新血管,其在胚胎发育以及肿瘤进展等过程中均发挥着重要作用。以肝癌为代表的高血管化肿瘤,往往展现出强烈的血管生成活性。此类过程主要受血管内皮生长因子(VEGF)、Notch Signaling以及血管生成素等因子的调控。鉴定新的血管新生调控因子不仅有助于理解心血管发生和形成的过程及其调控机制,而且也有助于找到心血管系统疾病的分子靶点,为治疗和预防缺血性疾病、代谢疾病及肿瘤等相关疾病提供新的思路和途径。
近日,南通大学刘东教授团队在Angiogenesis杂志在线发表一篇题为“G protein-coupled receptor GPR182 negatively regulates sprouting angiogenesis via modulating CXCL12-CXCR4 axis signaling”的研究论文,通过分析肝细胞癌病人组织样本特点,结合斑马鱼动物模型以及体外培养的血管内皮细胞实验验证,揭示了G蛋白偶联受体GPR182负调控血管新生的机制。

研究人员首先利用TCGA数据库中的公开数据,分析了肝细胞癌(HCC)患者中GPR182的表达水平。分析结果显示,在HCC患者中,GPR182的表达水平显著低于正常组织。此外,GPR182高表达与总体生存率(OS)和无病生存率(DFS)的提高呈正相关。对HCC样本进行免疫组化分析发现:GPR182仅表达于癌旁组织。另外,研究人员构建了斑马鱼HCC模型,利用原位杂交检测了HCC发生发展中gpr182在肝脏中的时空表达谱。结果显示:在斑马鱼HCC模型的肝脏中,gpr182的表达水平显著降低,并且随着肿瘤进展,其表达水平逐渐下降(图1)。
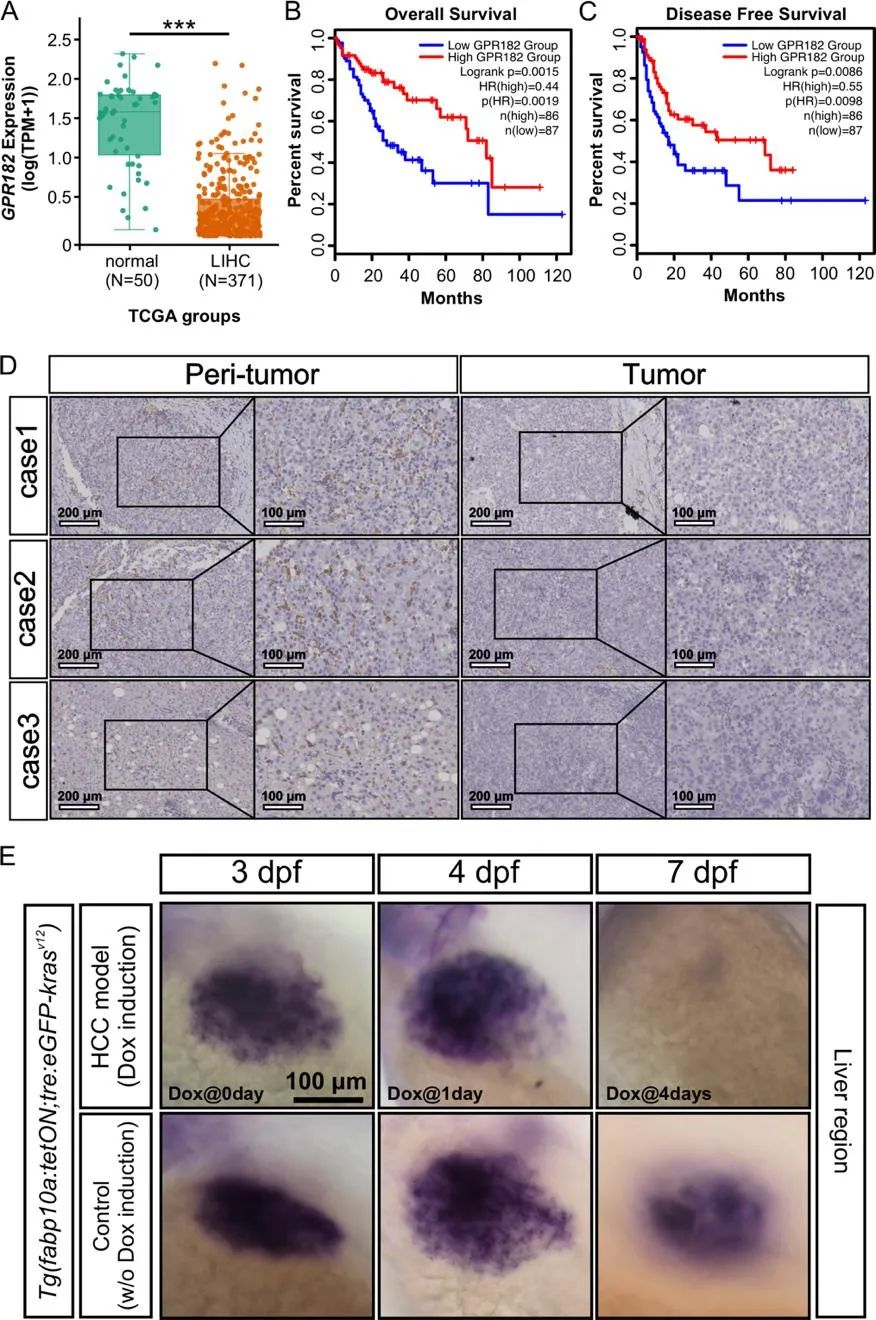
图1. GPR182在肝癌中的表达
为明确GPR182在不同物种中的表达模式,研究人员对来自于人、小鼠和斑马鱼的单细胞测序数据进行整合分析。结果显示,GPR182在三个物种的内皮细胞(EC)中富集。进一步通过免疫荧光和免疫组化分析HCC组织中GPR182与内皮细胞标志物CD31的关系发现,CD31在GPR182 低表达的肿瘤区域表达升高。相反,GPR182在癌旁组织高表达,与血管密度呈负相关。全胚胎原位杂交实验表明,斑马鱼gpr182在胚胎发生过程中表达于整个血管系统,在斑马鱼胚胎发育的后期阶段,gpr182在肝脏内皮中表达明显升高(图2)。斑马鱼gpr182在血管中的时空表达涵盖了胚胎血管新生的关键阶段,提示其可能参与血管新生调控。
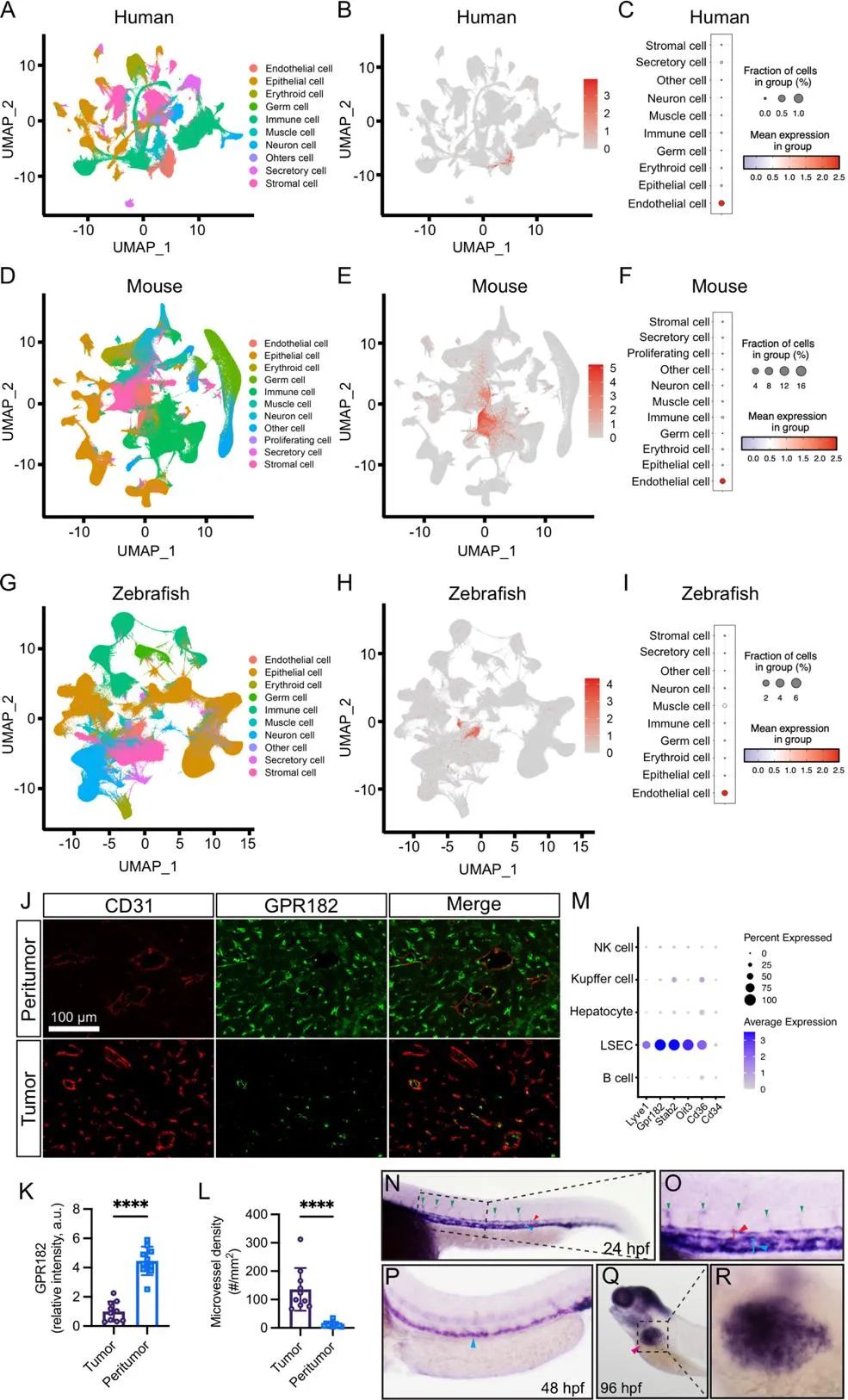
图2. GPR182在不同物种中的表达
为明确GPR182在血管形成中的作用,研究人员敲降其表达,并利用shRNA敲降GPR182在人脐静脉内皮细胞(HUVEC)中的表达。敲降gpr182导致斑马鱼节间血管异常过度出芽,且内皮细胞数量显著增加(图3)。细胞系中敲低GPR182促进内皮细胞迁移和成管(图4)。
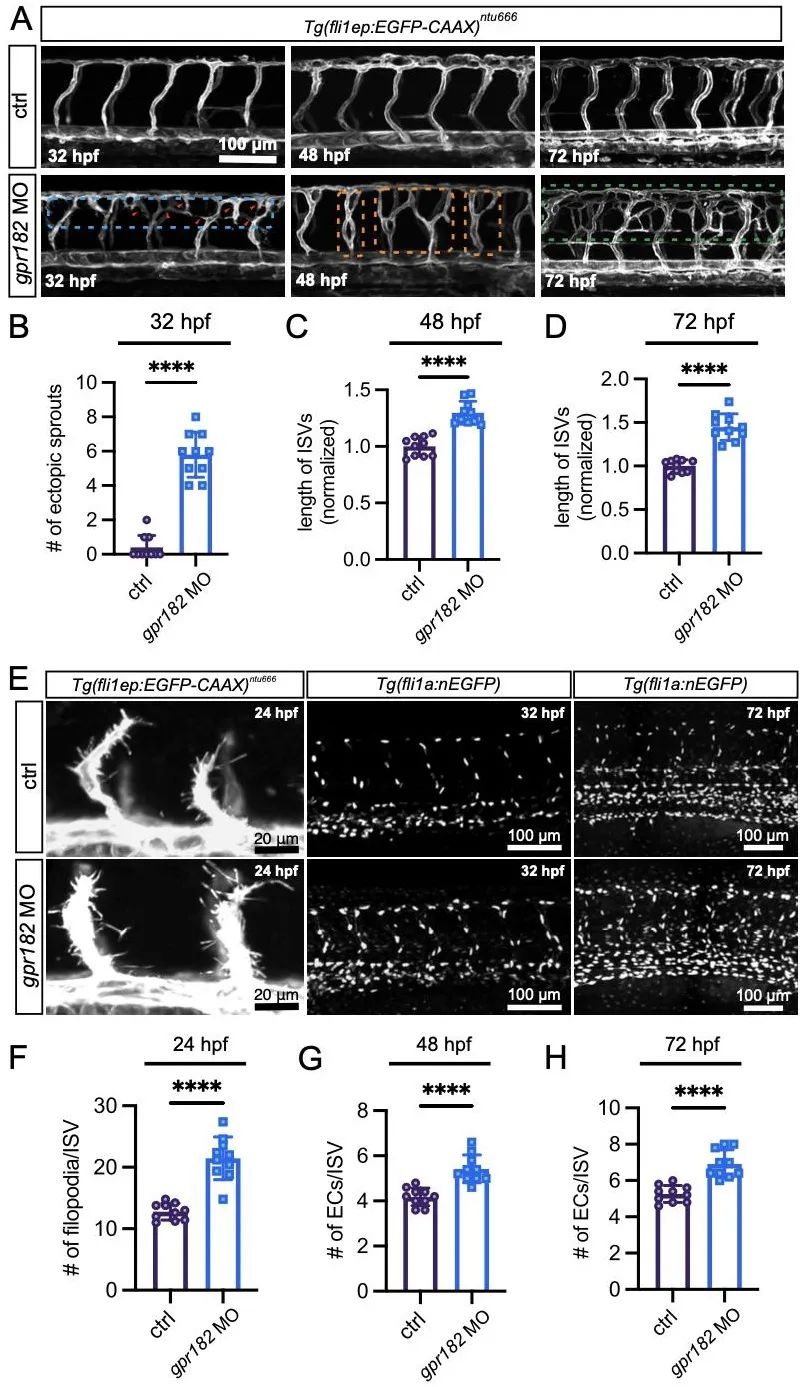
图3. Gpr182功能缺陷导致斑马鱼胚胎过度血管新生
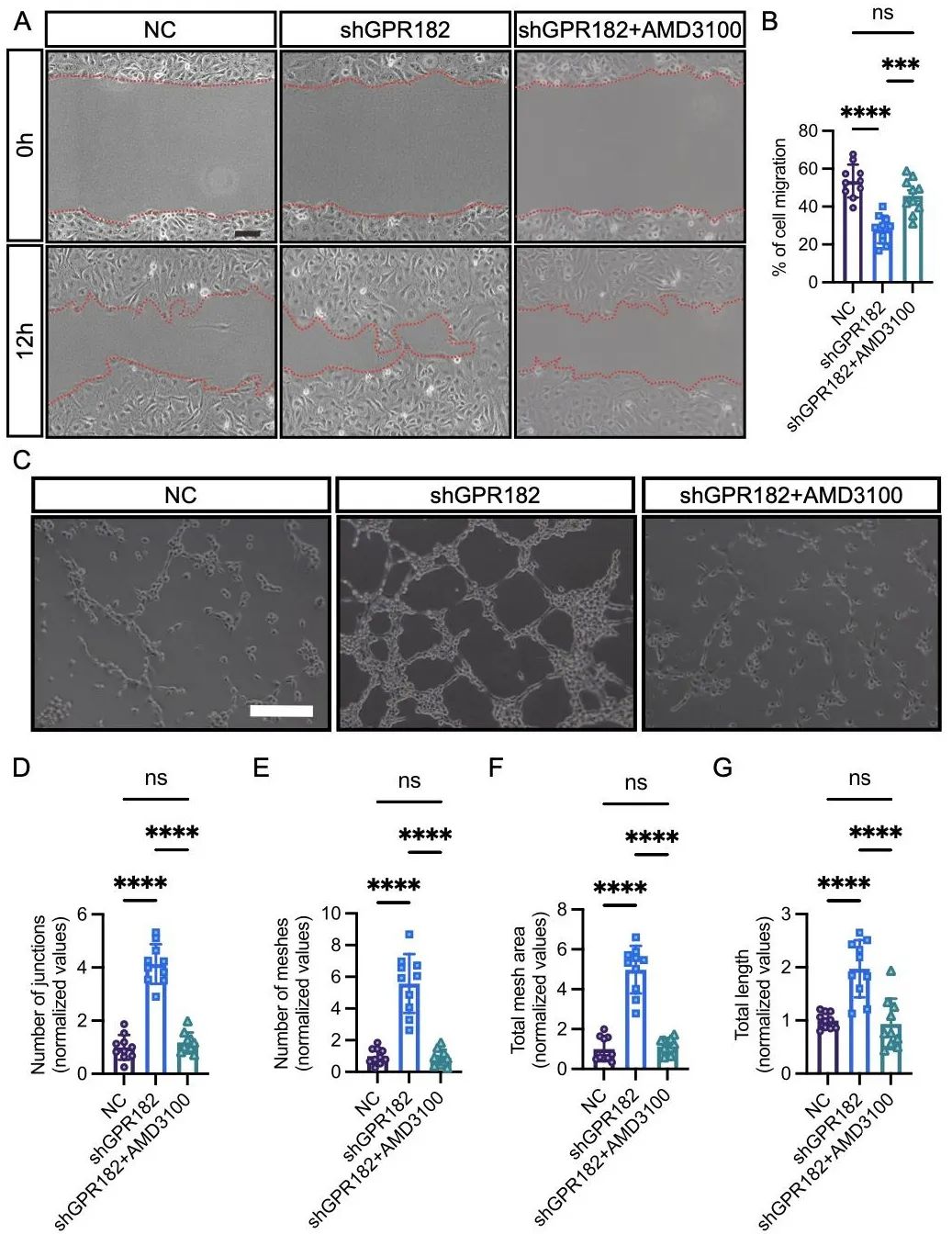
图4. HUVEC中敲低GPR182促进内皮细胞迁移和成管
接着,研究人员利用转录组测序分析了gpr182敲降后的基因表达变化。结果显示:趋化因子受体cxcr4a在gpr182敲降后的表达显著上调(图5)。利用CXCR4抑制剂AMD3100处理转染shGPR182的HUVECs,可有效恢复因GPR182下调导致的异常表型。这些发现提示,GPR182可能通过CXCR4信号通路参与血管新生调控。
图5. 转录组分析gpr182敲降后的基因表达变化
CXCR4作为典型的趋化因子受体,通常受非典型趋化因子受体(ACKRs)调节。两种类型的趋化因子受体虽然结构相似,但由于ACKRs缺乏胞内G蛋白结合motif,使其无法通过下游G蛋白传递信号,而通常以清除受体的功能存在。尽管GPR182同样缺失这一motif,但其是否能够启动下游G蛋白介导信号传递仍然存在争议。为此,研究人员利用一种可监测GPCR下游信号的动态变化的活细胞荧光成像系统分析其下游可能的G蛋白信号。使用CXCR4的特异性配体CXCL12激活GPR182 (CXCL12与GPR182被证明存在高亲和力),利用上述活细胞成像系统对下游cAMP、Ca2+、RhoA和ERK信号检测并追踪其动态变化。结果显示:表达GPR182的HeLa细胞在CXCL12刺激下,cAMP和RhoA信号并无变化,与未表达GPR182的细胞相似。尽管对照细胞中ERK和Ca2+的基础水平较高,但GPR182的表达也并未增强这些信号(图6)。这些研究结果表明,GPR182在CXCL12刺激下无法触发下游信号级联反应,支持了其是一种非典型趋化因子受体。
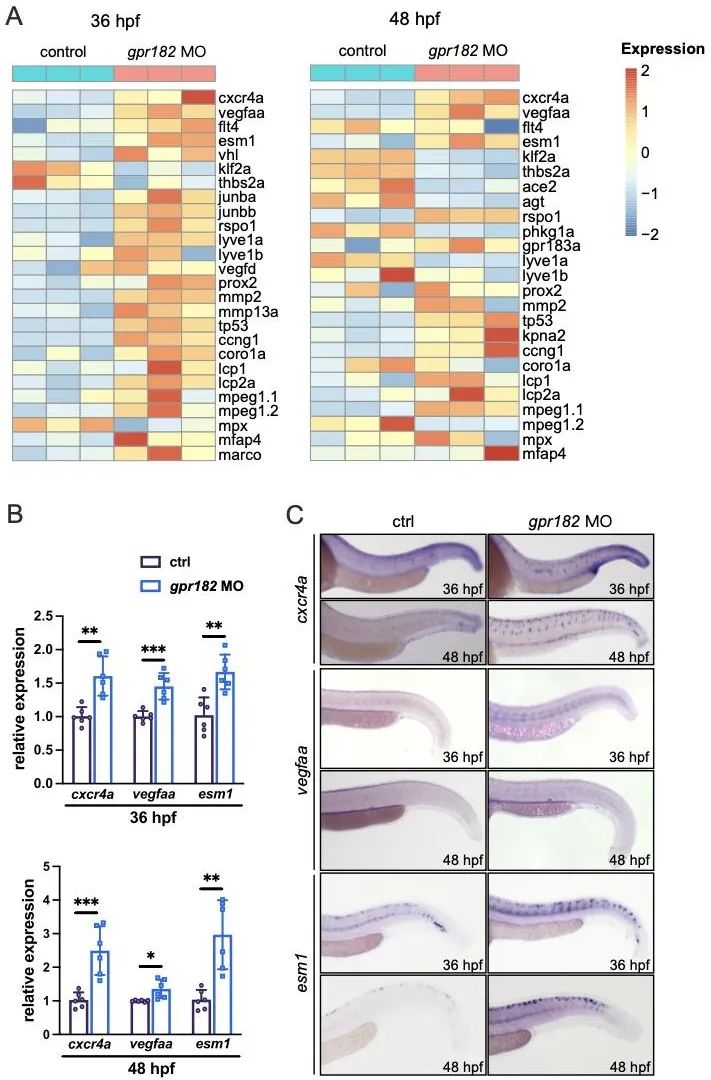
图6. 利用活细胞荧光成像系统检测GPR182下游信号变化
为了探索GPR182与CXCR4信号通路的关系,研究人员首先采用了荧光共振能量转移(FRET)技术检测二者的相互作用。结果表明,GPR182与CXCR4并不存在相互作用,排除了GPR182介导CXCR4受体内化并降解的可能。为确定GPR182是否作为清除受体直接参与调节CXCL12的水平,研究人员追踪了CXCL12在表达GPR182受体的细胞中的内吞。结果证明,GPR182介导了CXCL2的内吞,进而调控了胞外CXCL2的水平(图7)。
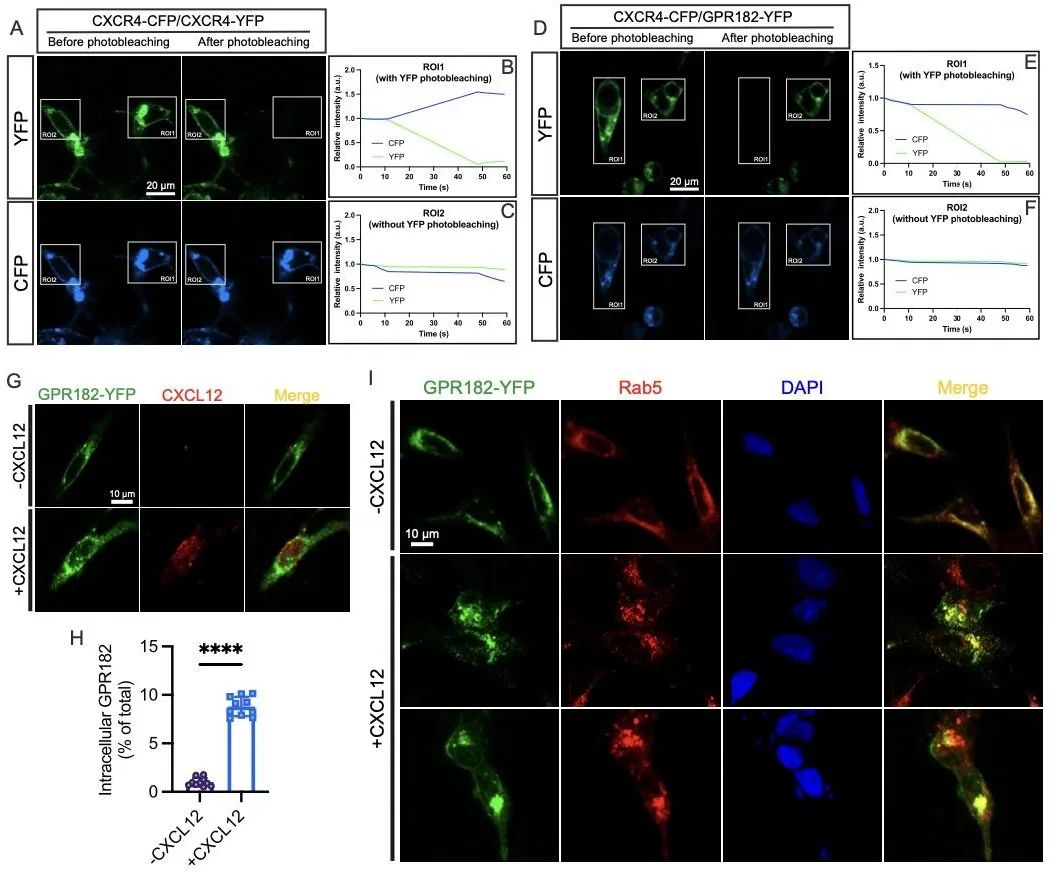
图7. GPR182通过内吞CXCL12调控CXCR4信号通路
为进一步探索抑制CXCR4在HCC治疗中的潜力,研究人员在斑马鱼HCC模型中使用AMD3100,并分析肝脏血管变化。HCC肝脏血管表现出复杂网络、过度分支和不规则生长等紊乱特征。为量化血管参数,研究人员重建了肝脏血管的三维结构。量化结果显示,HCC肝脏总血管长度和分支点显著增加,表明其出现肿瘤血管新生。尽管HCC肝脏血管平均直径与对照组无差异,但其管腔口径更不均匀,这些形态特征与人类肝癌相似。AMD3100处理使HCC模型的异常肝脏血管正常化,并且抑制CXCR4信号显著提高了HCC斑马鱼的存活率(图8)。这些结果表明,靶向CXCR4信号通路可能是HCC血管正常化的潜在治疗策略。
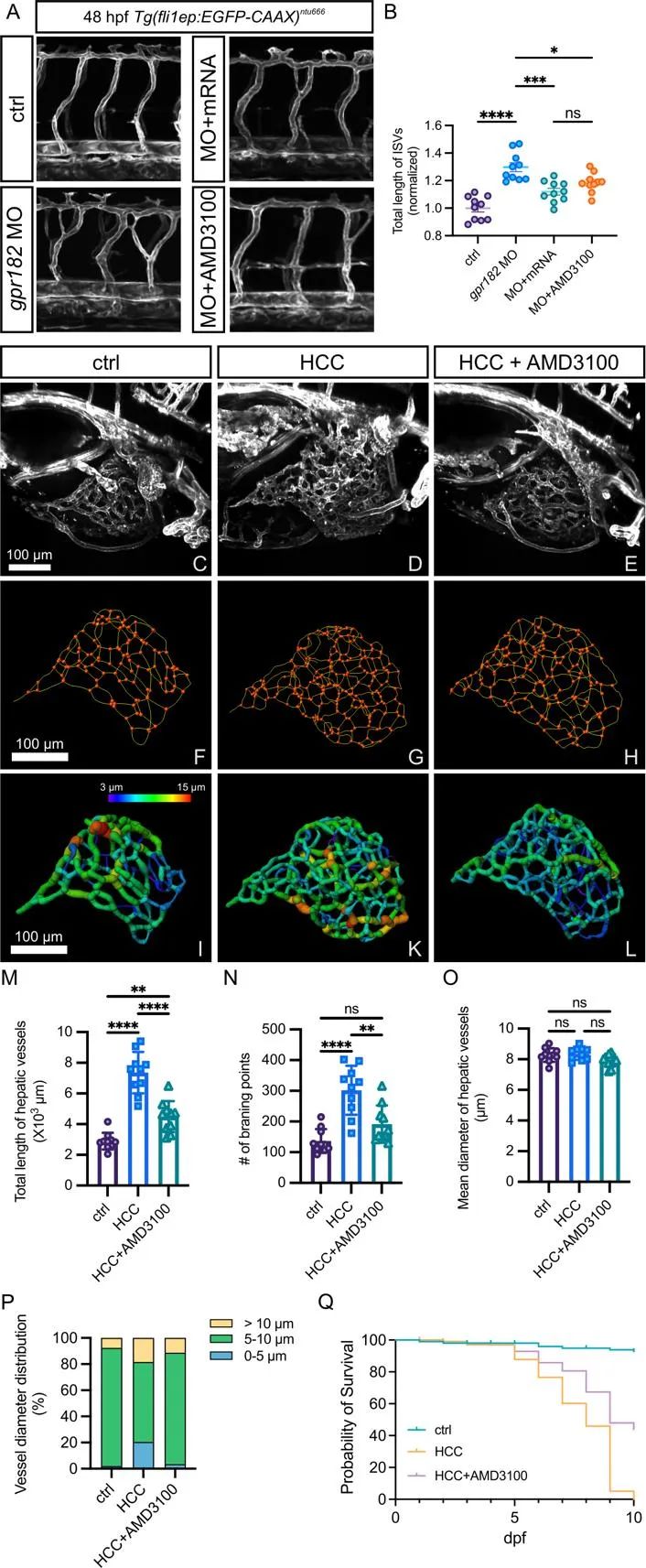
图8. 抑制CXCR4信号通路可挽救HCC中的异常血管表型
综上,该研究揭示了G蛋白偶联受体GPR182在血管新生中的作用(图9)。药物靶向GPR182有望为开发治疗肿瘤相关的新生血管异常提供新的手段。
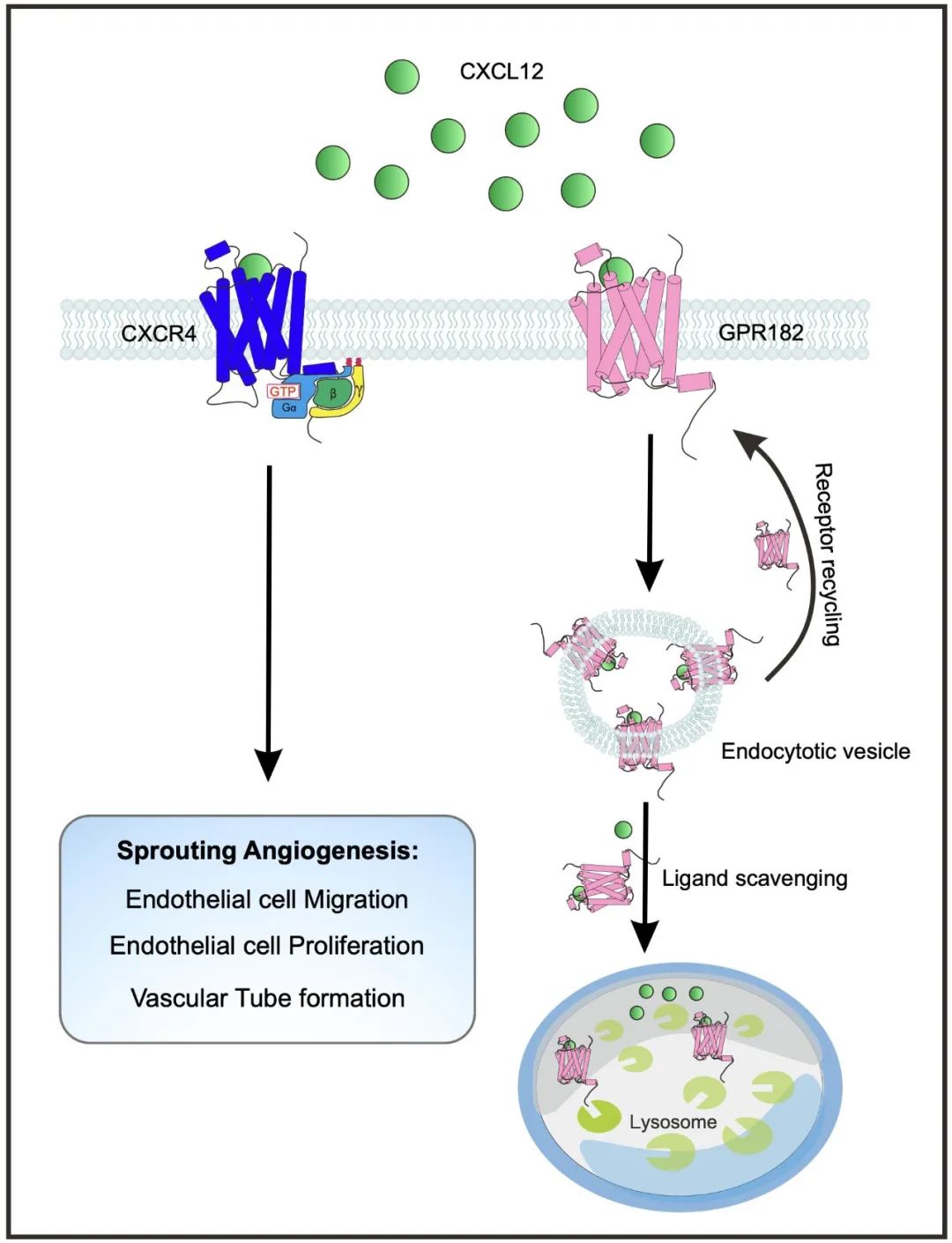
图9. GPR182调控血管新生的机制
南通大学陈昌盛副教授、硕士研究生刘伟、袁芳以及王晓宁博士为论文的第一作者,南通大学刘东教授和陈昌盛副教授为论文的通讯作者。该研究获得了国家自然科学基金和江苏省自然科学基金等项目联合支持。
原文链接:
https://link.springer.com/article/10.1007/s10456-025-09977-5
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)