首页 > 医疗资讯/ 正文
获得性耐药性和免疫抑制性肿瘤微环境显著限制了化疗和免疫疗法对晚期前列腺癌的疗效。阻断PI3K/mTOR信号通路是提高对化疗和免疫疗法敏感性的新策略。
2025 年 4 月 21 日,中国医学科学院/北京协和医学院邢念增及中国科学院肖海华共同通讯在Advanced Material 在线发表题为“PSMA-Targeted Nanoparticles with PI3K/mTOR Dual Inhibitor Downregulate P-Glycoprotein and Inactivate Myeloid-Derived Suppressor Cells for Enhanced Chemotherapy and Immunotherapy in Prostate Cancer”的研究论文。该研究开发了谷胱甘肽(GSH)敏感纳米颗粒(PSMA-NP/BEZ),其可以靶向载有PI3K/mTOR双重抑制剂前药BEZ235的前列腺特异性膜抗原(PSMA)。
PSMA-NP/BEZ可响应前列腺癌组织中GSH水平升高,释放BEZ235,抑制PI3K/AKT/mTOR通路并损害下游细胞功能,如细胞增殖、DNA修复和蛋白质合成。当与紫杉醇联合使用时,PSMA-NP/BEZ可以通过下调癌细胞中P-糖蛋白的表达来减少药物外流,从而提高对化疗的敏感性。此外,PSMA-NP/BEZ可以损害髓源性抑制细胞的免疫抑制功能,重塑前列腺癌中的“冷”免疫微环境,增强免疫治疗效果,包括对肿瘤复发的长期免疫记忆。PSMA-NP/BEZ为提高晚期前列腺癌化疗和免疫治疗效果,提供了一种安全有效的策略。

前列腺癌因其高患病率和死亡率成为一项艰巨的挑战。尽管早期诊断和治疗取得了进展,但晚期前列腺癌的治疗选择仍然有限,特别是由于化疗和免疫疗法的耐药性。化疗药物的获得性耐药和免疫抑制性肿瘤微环境(TME)对当前治疗构成了重大障碍。开发创新策略以提高治疗敏感性和低全身毒性,对晚期前列腺癌的治疗具有重要意义。
近期研究强调了ATP结合盒转运蛋白,特别是P-糖蛋白(P-gp)在前列腺癌细胞紫杉醇耐药中的关键作用。研究表明,髓源性抑制细胞(MDSC)在促进肿瘤免疫逃逸方面至关重要,循环MDSCs的丰度与PSA水平和肿瘤转移有关。PI3K/AKT/mTOR(PAM)信号通路是一种保守的信号转导网络,可促进癌细胞存活和增殖。PAM通路的过度激活可以上调P-gp,从而促进化疗耐药并维持肿瘤免疫抑制。此外,MDSC的免疫抑制作用还取决于PAM通路的激活。因此,靶向PAM信号转导成为提高前列腺癌对化疗和免疫疗法敏感性的一种有效方法。
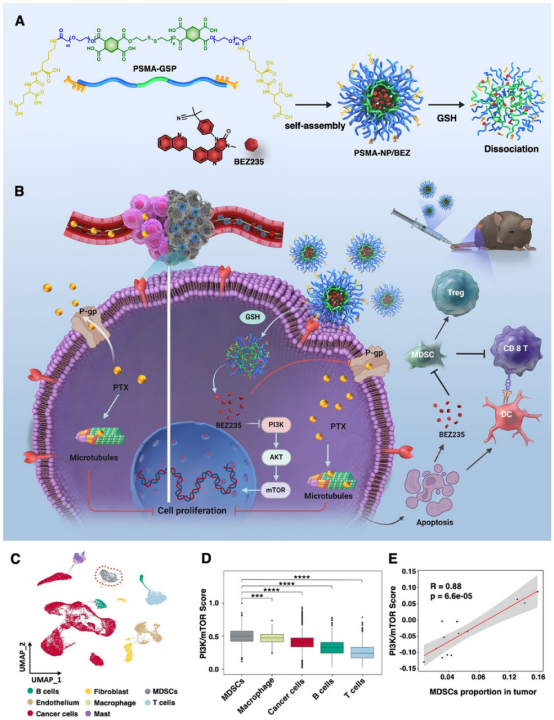
图1 PSMA-NP/BEZ的制备和作用机制示意图(摘自Advanced Materials)
BEZ235是一种双重PI3K/mTOR抑制剂,能够逆转前列腺癌、肺癌、卵巢癌和胃癌等多种癌症类型的耐药性。然而,仅关注单个机制忽视了其在前列腺癌化疗耐药中调节P-gp表达和抑制肿瘤免疫微环境中MDSCs的潜力。此外,BEZ235等PAM通路抑制剂的临床转化受到其水溶性差和生物利用度低的阻碍。
该研究开发了一种靶向前列腺特异性膜抗原(PSMA)的纳米药物递送系统,PSMA是一种在前列腺癌中特异性表达的跨膜糖蛋白。PSMA配体与谷胱甘肽(GSH)敏感聚合物(GSP)偶联,形成PSMA-GSP。然后,PSMA-GSP可以自组装并负载BEZ235前药以形成纳米颗粒(PSMA-NP/BEZ)。PSMA-NP/BEZ的开发不仅增强了BEZ235的水溶性和生物利用度,还确保了对前列腺癌组织的精确靶向。PSMA-NP/BEZ可在前列腺癌组织中主动积累,响应GSH水平升高释放BEZ235,抑制PAM通路,抑制癌细胞增殖,下调P-gp表达,增强化疗敏感性。此外,释放的BEZ235可以抑制MDSC的活性,从而重新编程免疫抑制微环境。当与PD-1单克隆抗体(αPD-1)联合使用时,PSMA-NP/BEZ可以协同增强免疫治疗的疗效。通过将PSMA-NP/BEZ与化疗和免疫疗法相结合,改善了治疗结果并降低了毒性,为治疗晚期前列腺癌患者提供了一种新方案。
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202415322
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)