首页 > 医疗资讯/ 正文
[摘要] 乳腺癌是女性最常见的恶性肿瘤。早期乳腺癌指病灶局限在乳房和区域淋巴结,并无远处转移的乳腺癌,其治疗策略包括术前新辅助治疗、局部治疗[手术和(或)放疗]以及术后辅助治疗。早期乳腺癌具有高度异质性,因此需要根据不同的分子亚型以及临床病理学特征制定对应治疗策略。目前将乳腺癌根据雌激素受体、孕激素受体和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达,进一步划分为激素受体阳性型、三阴性乳腺癌(triple-negative breast cancer,TNBC)、HER2阳性型等亚型,伴随着不同分子分型的生物学特性的深入探索,一系列新药的推陈出新,譬如针对激素受体阳性型的CDK4/6抑制剂、针对HER2阳性的抗HER2靶向治疗药物、针对TNBC的免疫治疗药物、针对BRCA突变的多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂及新一代的抗体药物偶联物(antibody-drug conjugates,ADC)相继进入临床实践。结合精确的个体化治疗策略的实施,目前早期乳腺癌的预后不断提升,局部治疗也从“最大可耐受”模式更新至“最小最有效”模式。曾经绝大多数乳腺癌患者接受了全乳切除联合腋窝淋巴结清扫手术,而目前保乳手术和前哨淋巴结活检术已成为早期乳腺癌标准的手术方式。近20年来新辅助治疗促使肿瘤降期,更是为原本不可保乳、不可保腋窝的患者提供了外科降阶梯的可能。近年来,如何缩小手术范围,在保障治疗效果的同时减轻患者的身体、心理及经济负担的降阶梯局部治疗理念也不断普及。本文就早期乳腺癌局部和系统性治疗的现状、研究进展及展望予以综述,旨在为广大临床工作者提供参考。
[关键词] 乳腺癌;保乳手术;前哨淋巴结活检;新辅助治疗;辅助治疗
[Abstract] Breast cancer is the most common malignant tumor in women. Early breast cancer refers to primary lesion localized in the breast and regional lymph nodes, and without distant metastasis. Treatment strategies include preoperative neoadjuvant therapy, local treatment (surgery and/or radiotherapy), and postoperative adjuvant therapy. Early breast cancer is highly heterogeneous, hence currently treatment strategies need to be formulated according to different molecular subtypes and pathology stages. At present, breast cancer is further divided into hormone receptor positive, triple negative breast cancer (TNBC), human epidermal growth factor receptor 2 (HER2) positive and other undefined subtypes. With the in-depth exploration of the biological characteristics of different molecular types, a series of new drugs have been developed, such as CDK4/6 inhibitors for hormone receptor positive, anti HER2 targeted therapy for HER2 positive, immunotherapy for TNBC, poly (ADP-ribose) polymerase (PARP) inhibitors for BRCA mutations, and new generation of antibody-drug conjugates (ADCs) drug have entered clinical practice. Combined with the implementation of precision individualized treatment strategy, the prognosis of early breast cancer is also constantly improving, and local treatment is also updated from the "most tolerable" mode to the "least effective" mode, also known as “less is more”. Breast conserving surgery and sentinel lymph node biopsy have become the standard surgical methods for early breast cancer. The neo-adjuvant treatment has promoted the tumor down-staging, and it has also provided the possibility of surgical step-down for patients who could not have breast conserving surgery or sentinel lymph node biopsy. In recent years, the concept of reducing the scope and trauma of surgery, ensuring treatment effectiveness while reducing the physical, psychological, and economic burden on patients through local treatment, has been increasingly popular. This article reviewed the updated research progress and future prospects of local and systematic treatment of early breast cancer aimed to provide reference for clinical workers.
[Key words] Breast cancer; Breast conserving surgery; Sentinel lymph node biopsy; Neoadjuvant therapy; Adjuvant therapy
乳腺癌是全球女性最常见的恶性肿瘤,2024年乳腺癌在所有女性的新确诊的病例中占32%,在所有恶性肿瘤中位居第一[1]。早期乳腺癌指确诊时病灶局限在乳房和区域淋巴结而无远处转移,其治疗策略包括术前新辅助治疗、局部治疗[手术和(或)放疗]以及术后辅助治疗。手术的目的是完整切除病灶,同时提供精准分型分期指导系统性治疗策略;新辅助治疗使肿瘤降期,增加可手术、可保乳、可保腋窝的机会,同时评估治疗的敏感性,指导辅助强化治疗;辅助治疗根据患者疾病复发风险予以分型治疗,改善患者的预后[2]。近年来,随着精准医学概念的提出,无论是局部治疗还是系统性全身治疗均走向更加精确的个体化治疗方式。在2024年上海国际乳腺癌论坛上,与会专家详细探讨了局部治疗和系统性治疗在早期乳腺癌治疗中的进展。本文以相关临床研究为基础,就早期乳腺癌手术和系统性治疗的发展史、研究进展及未来展望进行综述,着重介绍在系统性治疗效果不断提升的当下,乳腺外科治疗精准降阶梯的进程,以期为广大临床工作者提供参考。
1 早期乳腺癌的分型和分期
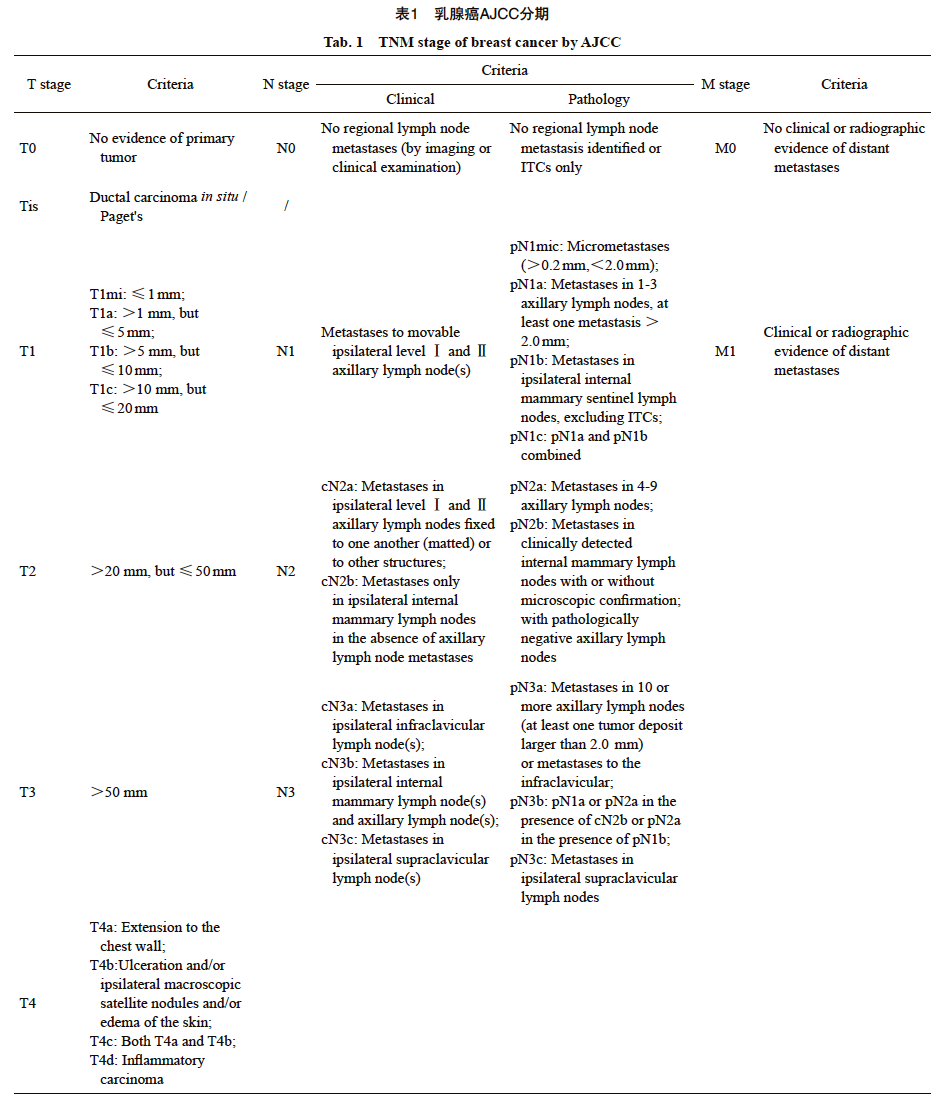
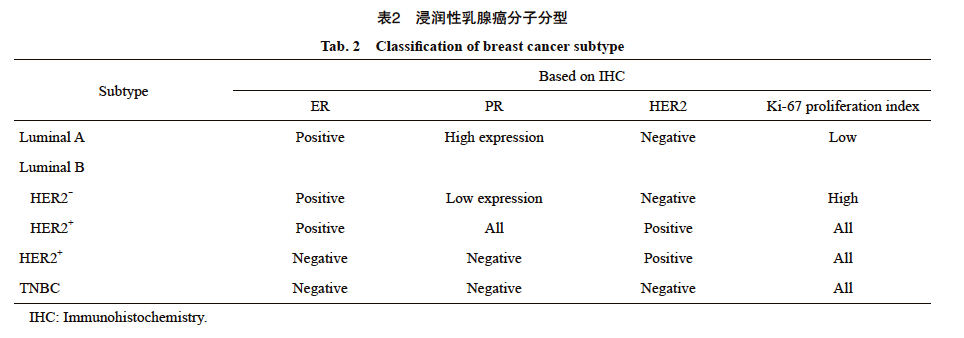
局部治疗和(或)系统治疗策略的制定均依赖于对早期乳腺癌分期和分型的精准评估,当前采用的乳腺癌分期原则基于美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版乳腺癌分期系统(包括传统的解剖学分期和预后分期),同时将乳腺癌进一步划分为激素受体阳性型、三阴性乳腺癌(triple-negative breast cancer,TNBC)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性型(表1、2)。《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[2]规定应对所有乳腺浸润性癌患者进行雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2免疫组织化学检测,对HER2(2+)的患者应进一步行原位杂交(in situ hybridization,ISH)检测。ER/PR阳性定义:>10%的肿瘤细胞呈阳性染色;当阳性细胞1%~10%时为ER/PR低表达。HER2检测免疫组织化学检测结果为3+或ISH扩增定义为HER2阳性。HER2经免疫组织化学检测结果为1+和免疫组织化学检测结果为2+/ISH无扩增的局部晚期/晚期乳腺癌患者可从抗体药物偶联物(antibody-drug conjugates,ADC)治疗中获益,目前大多数研究将免疫组织化学检测结果为1+和免疫组织化学检测结果为2+/ISH无扩增者定义为HER2低表达。通常建议乳腺浸润性癌的病理学检查报告应包括与患者治疗和预后相关的所有相关内容,如肿瘤大小、组织学类型、组织学分级、有无并存的导管原位癌(ductal carcinoma in situ,DCIS)、有无淋巴管血管侵犯(lymphovascular invasion,LVI)、切缘和淋巴结情况等,还应包括ER、PR、HER2表达情况及Ki-67增殖指数[2]。
2 早期乳腺癌的系统性治疗
早期乳腺癌的系统性全身治疗,包含新辅助治疗和辅助治疗,治疗决策应基于复发风险的个体化评估、肿瘤病理学的分子分型以及对不同治疗方案预期的反应性。系统性治疗药物近50年发展迅猛,从1970年代开始联合化疗方案登上历史舞台,CMF(环磷酰胺、甲氨蝶呤、氟尿嘧啶)方案成为经典的辅助化疗方案,显著降低了复发率和死亡率;20世纪70年代,他莫昔芬作为首个选择性ER调节剂被用于HR阳性乳腺癌的辅助治疗,成为HR阳性乳腺癌患者的治疗基石;随后芳香化酶抑制剂逐渐取代他莫昔芬,成为绝经后女性的首选内分泌治疗药物;20世纪末曲妥珠单抗获批用于HER2阳性乳腺癌治疗,进一步加速了精准治疗的进程。
2.1 早期乳腺癌辅助治疗进展
辅助治疗是指在手术后开展的系统性全身治疗。目前不同亚型的早期乳腺癌在治疗后,患者的预后均得到显著改善。对于中高复发风险的乳腺癌患者,多项研究展示了良好的治疗效果。MonarchE研究[3]入组了5 637例患者,治疗组接受辅助阿贝西利联合标准内分泌治疗方案治疗,中位随访54个月,结果显示,复发风险降低了32%,5年无浸润性疾病生存(invasive disease-free survival,iDFS)率从较对照组显著提升(83.6% vs 76.0%)。NATALEE研究[4]进一步证实,在5 101例淋巴结阳性或淋巴结阴性高危的患者中,辅助3年瑞波西利较常规内分泌治疗降低了29%的复发风险,4年iDFS绝对获益率为4.9%[3-4];复旦大学附属肿瘤医院团队对TNBC患者进行分层治疗,结果显示,低危患者接受常规化疗后,3年的无病生存(disease-free survival,DFS)率高达90.1%,高危患者接受蒽环类与紫杉类药物后序贯吉西他滨和铂类药物的加强化疗方案,其3年DFS率达到了90.9%,显著高于常规化疗组的80.6%[5]。APHINITY研究[6]报道了患者在术后接受曲妥珠单抗和帕妥珠单抗治疗并联合化疗的随访情况。结果显示,腋窝淋巴结阳性的患者8年iDFS率为86.1%,腋窝淋巴结阴性的患者8年iDFS率为92.3%。而对于存在胚系BRCA突变的高危HER2阴性的早期乳腺癌患者,Ⅲ期随机对照临床试验OlympiA研究[7]证实,采用奥拉帕利辅助治疗1年可进一步降低患者42%的复发风险,3年的iDFS率从77.0%提升至85.9%。以上研究均入组了临床高危各亚型的早期乳腺癌患者,经过优化的系统性辅助治疗后,整体预后显著改善,这也为外科降阶梯治疗理念的形成、推广和普及奠定了基础。
2.2 早期乳腺癌新辅助治疗进展
新辅助治疗开始于20世纪70年代,过去主要采用化疗的治疗方式,此前曾采用过的名称包括术前化疗、初始化疗、诱导化疗等。新辅助治疗将不可手术的乳腺癌变得可手术,并增加了保乳、保腋窝的机会。目前,乳腺癌已进入分子亚型的个体化治疗时代,新辅助治疗药物的选择也有必要基于患者肿瘤负荷和ER、PR、HER2的表达水平以及Ki-67增殖指数。从不同的角度出发,新辅助治疗的优点包括:① 从肿瘤发生发展机制角度来看,新辅助治疗使肿瘤远处微小转移病灶获得更早和更有效的治疗;防止因血管生成抑制因子减少和耐药细胞数目增加而导致术后肿瘤复发和转移;② 从临床角度来看,新辅助治疗使乳腺癌的原发病灶及区域淋巴结降期,使原本不能手术的肿瘤通过新辅助治疗后得以根治;使原本不能保乳的患者有机会接受保乳手术;使原本需要腋窝清扫的患者在腋窝降期后避免了腋窝淋巴结清扫(auxiliary lymph node disp,ALND);监测肿瘤对治疗方案的敏感性,为术后辅助治疗的选择提供了依据;③ 从科研角度来看,新辅助治疗提供一个研究平台,加速生物标志物的发现,确立预测疗效的指标以及残留肿瘤或肿瘤耐药的相关生物标志物;检测新的联合治疗的疗效,可快速地评估新药疗效,加快抗肿瘤新药的研发。基于目前循证医学的证据,相同方案和疗程的新辅助治疗的效果与辅助治疗的效果是相同的,如治疗有效应完成足疗程新辅助治疗后再手术,而新辅助治疗后未达病理学完全缓解(pathologic complete remission,pCR)的患者有机会使用强化治疗方案进一步降低复发和死亡风险。在TNBC方面,Keynote522研究[8]结果显示,化疗联合帕博利珠单抗可获得64%的pCR率。类似地,在HER2阳性型乳腺癌患者中,采用紫杉类药物和铂类药物联合曲妥珠单抗和帕妥珠单抗能使患者获得超过60%的pCR率[9],给外科降阶梯治疗特别是新辅助治疗后的局部治疗降阶梯带来了更为广泛的探索空间。
3 早期乳腺癌的局部治疗
3.1 乳腺癌手术发展史
20世纪初期,基于Halsted理论创立的乳腺癌根治术,强调彻底切除乳腺组织及周围所有的淋巴结,尽管手术方式创伤大,但在当时的医疗水平下提高了患者的生存率、降低了局部复发风险,被认为是典型的常规手术[10]。1948年Handley的第二肋间内乳淋巴结的活检手术证实该淋巴结亦是乳腺癌转移途径的第一站,从而开展了各种清除内乳淋巴结的扩大根治手术。然而手术范围的增大似乎并没有为乳腺癌患者带来显著的生存获益。基于肿瘤转移的机制学说, Fisher首先提出乳腺癌在发病时即为全身性疾病[11]。该观点的诞生进一步推动了保乳手术作为早期乳腺癌标准治疗的变革。近年来手术治疗的理念也在不断突破,倡导在清除肿瘤组织的同时减轻手术创伤,提倡提升患者术后生活质量的 “最小最有效”治疗模式[12]。当然乳腺癌的手术方式很多,没有一种固定的手术方式可适合于各种不同情况的乳腺癌,对手术方式的选择应结合患者病情及医疗条件来全面考虑,如放疗的条件等。
3.2 乳腺癌保乳手术
保乳手术是根治性的乳腺癌手术治疗方式,旨在确保无肿瘤残留的同时,尽量保留正常的乳腺组织。2002年Fisher的研究表明,接受全乳切除术和保乳联合放疗的患者,局部复发率(local recurrence rate,LRR)和总生存率差异均无统计学意义[13]。因此,保乳手术使乳腺组织创伤最小和临床获益最大的实现成为可能。在实际手术过程中,切除的肿瘤及周边正常乳腺组织越多,越容易实现切缘阴性,这与“最小损伤”的原则相矛盾,而切缘阳性又存在更高的LRR,因此客观的标准化切缘评估方式尤为重要。在2014年,美国肿瘤外科学会(Society of Surgical Oncology,SSO)和美国放射肿瘤学会(American Society for Therapeutic Radiology and Oncology,ASTRO)建议保乳手术的阴性切缘的标准应遵循“No ink on tumor”原则,即保证切缘无肿瘤累及。根据2016年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)-SSO-ASTRO共识指南,对于DCIS患者,推荐2 mm作为阴性切缘的标准[14]。2009年以来,《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[2]推荐采用墨汁染色评估切缘,随后用福尔马林固定石蜡包埋,通过垂直切缘放射性取材的方法,详细完整地观察和评估肿瘤细胞和边缘的位置以确定保乳手术的切缘。2022年英国的一项回顾性分析对保乳术后切缘与疾病转移情况、癌症生存率的关联进行了最大规模的meta分析[15]。在该研究纳入的112 140例患者中,切缘阳性(墨缘肿瘤累及)患者占为9.4%,切缘接近(肿瘤距墨缘2 mm范围内)的患者占17.8%;切缘阳性患者的总体远处复发风险和局部复发风险高于切缘接近和切缘阴性的患者——这些综合数据表明,切缘距离不足可能会导致局部、远处复发,以及更高的乳腺癌死亡率。因此,对于侵袭性乳腺癌或原位导管癌,建议外科医师应实现至少1 mm的最小无肿瘤清晰边缘,以改善患者预后。当前认为不断缩小切缘的同时,尽可能保留乳房的自然外形,术后残留乳腺组织中即便存在少量癌细胞,这些病灶通过术后放疗和全身系统性治疗,并不会引起更高的同侧乳房复发率和远处转移的风险,就是临床可以接受的保乳根治性手术的结局。
这些理念也拓宽了保乳手术适应人群的范围,包括多病灶的患者接受保乳手术和新辅助治疗后降期保乳手术的患者。在ACOSOG(联盟)Z11102 Ⅱ期单臂前瞻性临床试验中,保乳手术在多病灶同侧乳腺癌(multiple ipsilateral breast cancer,MIBC)中的疗效得到了证实,经过术前MRI评估的MIBC患者接受保乳手术并获得阴性切缘,术后辅以放疗,5年LRR可控制在 3.2%[16]。2018年对早期新辅助治疗队列的meta分析表明,新辅助化疗组的女性保乳率高于具有相同化疗方案的术后辅助化疗组,却有更高的局部复发风险[17]。因此,为了进一步降低新辅助治疗降期后接受保乳手术的患者的局部复发风险,建议在新辅助治疗前后完整评估病灶范围,完整切除影像上异常的病灶(X线检查显示的钙化灶、MRI显示的强化灶),切除一定的正常乳腺组织以确保切缘阴性。此外,如果切除的病灶组织经病理学检查结果显示病灶筛状残留,即使是切缘阴性,仍可再次行广泛切除[18]。这些理念为乳腺癌患者提供了更多的保乳机会,但也带来了一系列挑战,需要在多学科团队合作的基础上,寻找降低复发风险的有效路径。
3.3 乳腺癌前哨淋巴结活检(sentinel lymph node biopsy,SLNB)
ALND术后部分患者出现淋巴水肿、肢体疼痛麻木及上肢活动受限等后遗症,而各期乳腺癌的淋巴结转移率仅为40%~50%,因而常规进行ALND,可能使50%~60%的患者接受了不必要的手术。1960年,前哨淋巴结(sentinel lymph node,SLN)的概念应运而生,定义为原发肿瘤中最先接受淋巴引流、最先发生肿瘤细胞转移的区域淋巴结。临床淋巴结阴性的患者采用SLNB,在乳腺癌中的应用无疑在很大程度上避免了术后并发症的发生,且对患者预后无明显影响[19]。
意大利的SLNB185前瞻性临床试验[20]对SLN阴性患者仅行SLNB,对SLN阳性则转为ALND,中位随访64.6个月的结果显示,乳腺癌相关事件包括腋窝淋巴结复发、远处转移及死亡的发生率在SLNB与ALND组之间差异均无统计学意义。该结果证实了SLN阴性患者中SLNB可以安全替代ALND[20]。随后开展的一系列ALMANAC、NSABP-B32和ACOSOG Z0010等前瞻性、多中心、大样本临床试验均证实对SLN阴性患者实施SLNB与ALND后具有相同的LRR、 DFS率和总生存率,以上研究结果进一步奠定了SLNB在腋窝淋巴结临床阴性早期乳腺癌患者中的标准治疗地位。
随后大量临床研究显示,40%~70%乳腺癌患者腋窝清扫的标本中,SLN是唯一出现肿瘤转移的淋巴结,即对于该部分患者,仅需要实施SLNB。ACOSOG Z0011研究[21]和AMAROS研究[22]对1~2枚SLN阳性患者随机分为ALND和SLNB两组,结果显示,LRR、DFS率以及总生存率差异无统计学意义。近期的SENOMAC 研究[23]再次证实了低负荷SLN阳性的患者可以考虑区域放疗替代ALND。ASCO指南也提示,对于低负荷SLN阳性的患者,如果其非SLN阳性率低且整体局部复发风险低(T1a,ER阳性,仅1枚SLN阳性并会接受系统性辅助治疗),也可以考虑豁免区域淋巴结放疗[24]。
随着SLNB临床的广泛运用,进一步的外科降阶梯治疗理念也在不断拓宽适用人群。首先对于新辅助治疗后腋窝降期的患者,新辅助治疗后实施SLNB是否可以准确地评估腋窝淋巴结的病理学状态,从而也得到豁免ALND的机会?前期研究提示,对于新辅助治疗前评估为cN1期的患者,新辅助治疗可使约40%的患者淋巴结转阴,特别是在TNBC或HER2阳性型的cN1期乳腺癌患者中,约有2/3的患者在治疗后未见腋窝淋巴结转移。ACOSOG Z1071、SENTINA和SN FNAC三项多中心前瞻性临床试验评估了新辅助化疗后SLNB在初始腋窝淋巴结阳性患者中应用的可行性和准确性,结果提示,活检SLN个数≥3个、双示踪剂淋巴显像及新辅助治疗前标记转移淋巴结的腋窝活检技术,均可有效地降低新辅助治疗后SLNB的假阴性率,满足以上条件患者新辅助治疗后SLN为阴性,可安全地豁免ALND[25]。此后研究者发现,尽管SLNB带来的并发症发生率较ALND显著降低,但是对于腋窝淋巴结未转移的患者,豁免SLNB在降低术后并发症,提高患者生活质量方面依然具有重要意义。近年来,术前影像学诊断准确率的提升也为筛选部分早期临床腋窝淋巴结阴性患者豁免SLNB提供了很好的契机,诸多前瞻性研究陆续问世。譬如前瞻性、随机对照Ⅲ期的SOUND研究[26],纳入了1 463例肿瘤直径不超过2 cm且术前腋窝淋巴结超声检查阴性的70岁以下的女性患者(37%超过65岁,92.9%ER阳性),采用非劣效的设计,其结果表明SLNB组与无腋窝手术组之间的5年DFS、 LRR及远处转移率差异均无统计学意义。
3.4 早期乳腺癌的放疗
放疗与手术治疗是早期乳腺癌局部治疗的重要方法。无论是保乳术后的放疗还是中高危全乳切除术后的患者,辅助放疗均可以显著降低局部复发风险并改善患者的整体预后。早期乳腺癌放疗适用人群及放疗计划的设定可参考《中国抗癌协会乳腺癌诊治指南与规范(2024版)》[2]。
3.5 早期乳腺癌局部治疗进展
在乳腺癌综合治疗手段不断更新、治疗效果不断提高的背景下,早期乳腺癌外科降阶梯的发展趋势不可逆转,未来需要临床医师综合考量不同乳腺癌区域复发风险以及系统治疗强度以确定个体化的治疗策略。近年来,新辅助治疗后当患者达到pCR是否能豁免手术治疗[乳房和(或)腋窝]引起较大的关注,虽然pCR原则上需要通过完整手术后才能确认。2022年发布的一项前瞻性、多中心、单臂的Ⅱ期临床试验研究对象为年龄在40岁及以上的女性,确诊为TNBC或HER2阳性浸润性癌,肿瘤直径小于5 cm,N0/N1(超声活检疑似异常淋巴结小于或等于4个),并接受了新辅助治疗。最终的乳房影像学检查需显示肿瘤缩小至2 min或以下,采用9G的针穿刺至少12条,病理学检查无浸润性癌和原位癌残留的患者豁免开放手术。结果发现,在中位随访26.4个月后,OS/DFS均为100%,支持了新辅助治疗后通过影像引导的真空辅助活检确定pCR后,在高度筛选的患者群体中免除乳腺手术的可行性[27]。对于术后美容效果和生活质量的提升也在不断追求中。传统乳腺癌外科手术的手术切口较大,美容效果不佳从而影响患者的生活质量,因此腔镜和达芬奇机器人手术的发展为微创乳腺癌手术提供了可能,一项回顾性队列研究纳入了2 412例诊断为0~Ⅲ期的乳腺癌患者,对其中603例接受微创手术(MABS组),1 809例接受常规乳腺手术(CBS组),MABS组和CBS组的10年无局部复发生存率为93.3%和96.3%,无远处转移生存率为81.0%和82.0%,结果提示MABS组的长期结局与CBS组差异无统计学意义[12]。乳房重建手术适合部分不能进行保乳手术但对外形有追求的患者,在保证治疗效果的基础上,提高患者的生活质量。目前常用的几种重建技术包括自体组织重建(背阔肌肌皮瓣乳房重建、带蒂/游离腹直肌皮瓣乳房重建)、假体重建(扩张器置换假体)以及乳头重建技术等,根据手术的时机主要分为即刻重建和延期重建。外科医师应强化多学科协作理念,在术前评估、治疗决策、手术实施、术后监护、康复随访等各个环节通力合作,制订最佳的乳房重建方案,最大程度地提高患者满意度,实现患者利益最大化[28]。
4 总结与展望
综上所述,乳腺癌的治疗已从“单一局部治疗”演变为“多学科协作、局部与全身相结合” 的综合治疗模式。随着乳腺癌治疗模式的精准分类,新型技术的出现以及更多高效、低毒的新药投入使用,系统性治疗策略将得以不断优化。在对早期乳腺癌患者进行积极有效的治疗的同时,应更多地考虑患者生活质量的提升。目前,早期乳腺癌的治疗日趋精准化、精细化,外科手术范围也在不断缩小;未来随着各种治疗技术的进步,可望进一步提升患者的生活质量,使更多的患者从中获益。
第一作者及通信作者:
李俊杰,副主任医师,副教授,复旦大学附属肿瘤医院乳腺外科副主任。
[参考文献]
[1] SIEGEL R L, GIAQUINTO AN, JEMAL A. Cancer statistics, 2024[J]. CA Cancer J Clin, 2024, 74: 12-49.
[2] 中国抗癌协会乳腺癌专业委员会, 中华医学会肿瘤学分会乳腺肿瘤学组. 中国抗癌协会乳腺癌诊治指南与规范(2024年版)[J]. 中国癌症杂志, 2023, 33(12): 1092-1187.
The Society of Breast Cancer China AntiCancer Association, Breast Oncology Group of the Oncology Branch of the Chinese Medical Association. Guidelines for breast cancer diagnosis and treatment by China Anti-cancer Association(2024 edition)[J]. China Oncol, 2023, 33(12): 1092-1187.
[3] JOHNSTON S R D, HARBECK N, HEGG R, et al. Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, node-positive, high-risk, early breast cancer (monarchE)[J]. J Clin Oncol, 2020, 38(34): 3987-3998.
[4] SLAMON D, LIPATOV O, NOWECKI Z, et al. Ribociclib plus endocrine therapy in early breast cancer[J]. N Engl J Med, 2024, 390(12): 1080-1091.
[5] HE M, JIANG Y Z, GONG Y, et al. Intensive chemotherapy versus standard chemotherapy among patients with high risk, operable, triple negative breast cancer based on integrated mRNA-lncRNA signature (BCTOP-T-A01): randomised, multicentre, phase 3 trial[J]. BMJ, 2024, 387: e079603.
[6] LOIBL S, JASSEM J, SONNENBLICK A, et al. Adjuvant pertuzumab and trastuzumab in early human epidermal growth factor receptor 2-positive breast cancer in the APHINITY trial: third interim overall survival analysis with efficacy update[J]. J Clin Oncol, 2024, 42(31): 3643-3651.
[7] GEYER C E Jr, GARBER J E, GELBER R D, et al. Overall survival in the OlympiA phase Ⅲ trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer[J]. Ann Oncol, 2022, 33(12): 1250-1268.
[8] SCHMID P, CORTES J, PUSZTAI L, et al. Pembrolizumab for early triple-negative breast cancer[J]. N Engl J Med, 2020, 382(9): 810-821.
[9] VAN RAMSHORST M S, VAN DER VOORT A, VAN WERKHOVEN E D, et al. Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2018, 19(12): 1630-1640.
[10] GHOSSAIN A, GHOSSAIN M A. History of mastectomy before and after Halsted[J]. J Med Liban, 2009, 57(2): 65-71.
[11] FISHER B, WOLMARK N, REDMOND C, et al. Findings from NSABP protocol No. B-04: comparison of radical mastectomy with alternative treatments. Ⅱ. The clinical and biologic significance of medial-central breast cancers[J]. Cancer, 1981, 48(8): 1863-1872.
[12] WAN A D, LIANG Y, CHEN L, et al. Association of longterm oncologic prognosis with minimal access breast surgery vs conventional breast surgery[J]. JAMA Surg, 2022, 157(12): e224711.
[13] FISHER B, ANDERSON S, BRYANT J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer[J]. N Engl J Med, 2002, 347(16): 1233-1241.
[14] MORAN M S, SCHNITT S J, GIULIANO A E, et al. Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages Ⅰ and Ⅱ invasive breast cancer[J]. J Clin Oncol, 2014, 32(14): 1507-1515.
[15] BUNDRED J R, MICHAEL S, STUART B, et al. Margin status and survival outcomes after breast cancer conservation surgery: prospectively registered systematic review and meta-analysis[J]. BMJ, 2022, 378: e070346.
[16] BOUGHEY J C, ROSENKRANZ K M, BALLMAN K V, et al. Impact of breast conservation therapy on local recurrence in patients with multiple ipsilateral breast cancer-results from ACOSOG Z11102 (alliance)[J]. Cancer Res, 2023, 83(5_Suppl): GS4-1-GS4-01.
[17] Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Long-term outcomes for neoadjuvant versus adjuvant chemotherapy in early breast cancer: meta-analysis of individual patient data from ten randomised trials[J]. Lancet Oncol, 2018, 19(1): 27-39.
[18] 《中国乳腺癌新辅助治疗专家共识(2022年版)》专家组. 中国乳腺癌新辅助治疗专家共识(2022年版)[J]. 中国癌症杂志, 2022, 32(1): 80-89.
Expert group of expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition). Expert consensus on neoadjuvant treatment of breast cancer in China (2022 edition)[J]. Chin Oncol, 2022, 32(1): 80-89.
[19] LY M A N G H , G I U L I A N O A E , S O M E R F I E L D M R , et al. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer[J]. J Clin Oncol, 2005, 23(30): 7703-7720.
[20] VERONESI U, PAGANELLI G, VIALE G, et al. A randomized comparison of sentinel-node biopsy with routine axillary disp in breast cancer[J]. N Engl J Med, 2003, 349(6): 546-553.
[21] GIULIANO A E, BALLMAN K V, MCCALL L, et al. Effect of axillary disp vs no axillary disp on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (alliance) randomized clinical trial[J]. JAMA, 2017, 318(10): 918-926.
[22] BARTELS S A L, DONKER M, PONCET C, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer: 10-year results of the randomized controlled EORTC 10981-22023 AMAROS trial[J]. J Clin Oncol, 2023, 41(12): 2159-2165.
[23] DE BONIFACE J, TVEDSKOV T F, RYDÉN L, et al. Omitting axillary disp in breast cancer with sentinel-node metastases[J]. N Engl J Med, 2024, 390(13): 1163-1175.
[24] BRACKSTONE M, BALDASSARRE F G, PERERA F E, et al. Management of the axilla in early-stage breast cancer: Ontario health (cancer care Ontario) and ASCO guideline[J]. J Clin Oncol, 2021, 39(27): 3056-3082.
[25] BOUGHEY J C, SUMAN V J, MITTENDORF E A, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial[J]. JAMA, 2013, 310(14): 1455-1461.
[26] GENTILINI O D, BOTTERI E, SANGALLI C, et al. Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: the SOUND randomized clinical trial[J]. JAMA Oncol, 2023, 9(11): 1557-1564.
[27] KUERER H M, SMITH B D, KRISHNAMURTHY S, et al. Eliminating breast surgery for invasive breast cancer in exceptional responders to neoadjuvant systemic therapy: a multicentre, single-arm, phase 2 trial[J]. Lancet Oncol, 2022, 23(12): 1517-1524.
[28] 中国抗癌协会乳腺癌专业委员会, 中国医师协会外科医师分会乳腺外科医师委员会, 上海市抗癌协会乳腺癌专业委员会. 乳腺肿瘤整形与乳房重建专家共识(2022年版)[J].中国癌症杂志, 2022, 32(9): 836-924.
Committee of Breast Cancer Society, Chinese Anti-Cancer Association; Breast Surgeons Committee of Surgeons Branch, Chinese Medical Doctor Association; Committee of Breast Cancer Society, Shanghai Anti-Cancer Association. Expert consensus on oncoplastic surgery of breast tumor and breast reconstruction (2022 edition)[J]. Chin Oncol, 2022, 32(9): 836-924.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)