首页 > 医疗资讯/ 正文
横纹肌肉瘤(RMS)在儿童癌症中相当常见,其中肺泡型横纹肌肉瘤(ARMS)是一种风险极高、侵袭性强且易转移的肿瘤,尽管其基因突变数量相较于另一种亚型——胚胎型横纹肌肉瘤(ERMS)较低,但其肿瘤复发率更高,生存预后较差。ARMS由于染色体易位,产生致癌PAX3/7-FOXO1融合蛋白,目前尚无有效的小分子抑制手段,且缺乏可靠的动物模型。因此,开发能够在适当发育窗口内表达融合蛋白的实验模型,不仅有助于深入理解PAX融合蛋白介导的基因组和表观基因组事件,还可推动有效疗法的发展。
近日,纽约大学等研究人员在 Cell 发表题为 PAX translocations remodel mitochondrial metabolism through altered leucine usage in rhabdomyosarcoma 的文章,通过工程化的人类诱导多能干细胞来源的肌肉祖细胞模型,采用表观基因组学方法解析了PAX3/7-POXO1融合蛋白介导的重编程事件,揭示了其重塑染色质图谱和转录增强致癌基因表达,并鉴定了高微型横纹肌肉瘤中线粒体氧化磷酸化代谢特征及关键调控因子,为治疗提供了新的成药靶点及策略。

研究人员分析了PAX融合阳性的ARMS肿瘤样本及异种移植模型(O-PDX)的转录特征,并与不同发育时期的肌肉谱系细胞进行比较,发现ARMS肿瘤或O-PDX与PAX7+表达阳性的MPs(骨骼肌干细胞)基因表达谱密切相关(图1A-C)。据此,在人多能干细胞iPSC中加入Dox诱导PAX7表达,使iPSC分化为MP样细胞(图1D);并在这些细胞中表达PAX3\7-FOXO1融合蛋白,在移除Dox后,MP细胞仅表达PAX3\7融合蛋白,并且在体外肿瘤球和克隆形成能力更强,PAX3-FOXO1异常增殖能力强于PAX7-FOXO1(图1D-H)。表明PAX3/7融合蛋白在骨骼肌干细胞中表达可以模拟ARMS肿瘤细胞的异常生长和增生。随后,转录组分析发现表达PAX3/7融合蛋白后,与正确肌肉分化表达模式呈现显著差异,而骨骼系统发育和Wnt信号通路相关基因下调,与RMS肿瘤的转录特征一致,表明该模型可用于进一步研究ARMS发生机制。

图1 构建表达PAX融合蛋白的肺泡型横纹肌瘤iPSC细胞模型
CUT&RUN实验发现PAX融合蛋白能够结合基因组中启动子、内含子及远端区,尽管启动子区域的结合位点较少,但启动子区域的组蛋白甲基化修饰(H3K4me3)显著增加。进一步分析发现,融合表达PAX融合蛋白后增强子和和超级增强子SE数量显著增加,在增强子区域具有H3K27ac 修饰的被定义为超级增强子。与PAX7相比PAX7融合蛋白在基因组结合上差异更大,可占据20%的增强子和90%的超级增强子区域(图2C-E)。为了解PAX7融合蛋白如何影响细胞染色质结构和基因表达的全基因组变化,通过HiC和启动子捕获pCHiC技术,分析启动子与增强子和超级增强子之间的相互作用,结果显示PAX7融合蛋白在加强染色质重塑和增强启动子与增强子相互作用方面发挥着关键作用,以增强靶基因表达(图2F-H)。
ARMS中致癌基因突变很少,为探究PAX3/7融合蛋白在促进肌肉祖细胞转化中的作用,联合融合蛋白基因组结合和染色质相互作用数据,发现MYCN、MET、JUN和FOXM1等多个癌基因,被PAX3\7融合结合并激活(图2I-J)。还发现PAX3\7融合蛋白介导了关键肌肉调节因子MYOD1和MYOG特异性启动子和增强子相互作用,导致这些基因表达量显著上调,与RMS中表达情况类似,表明融合蛋白介导染色质重塑激活肌肉调节因子表达,从而使细胞维持高度增殖和异常生长状态(图2K-L)。
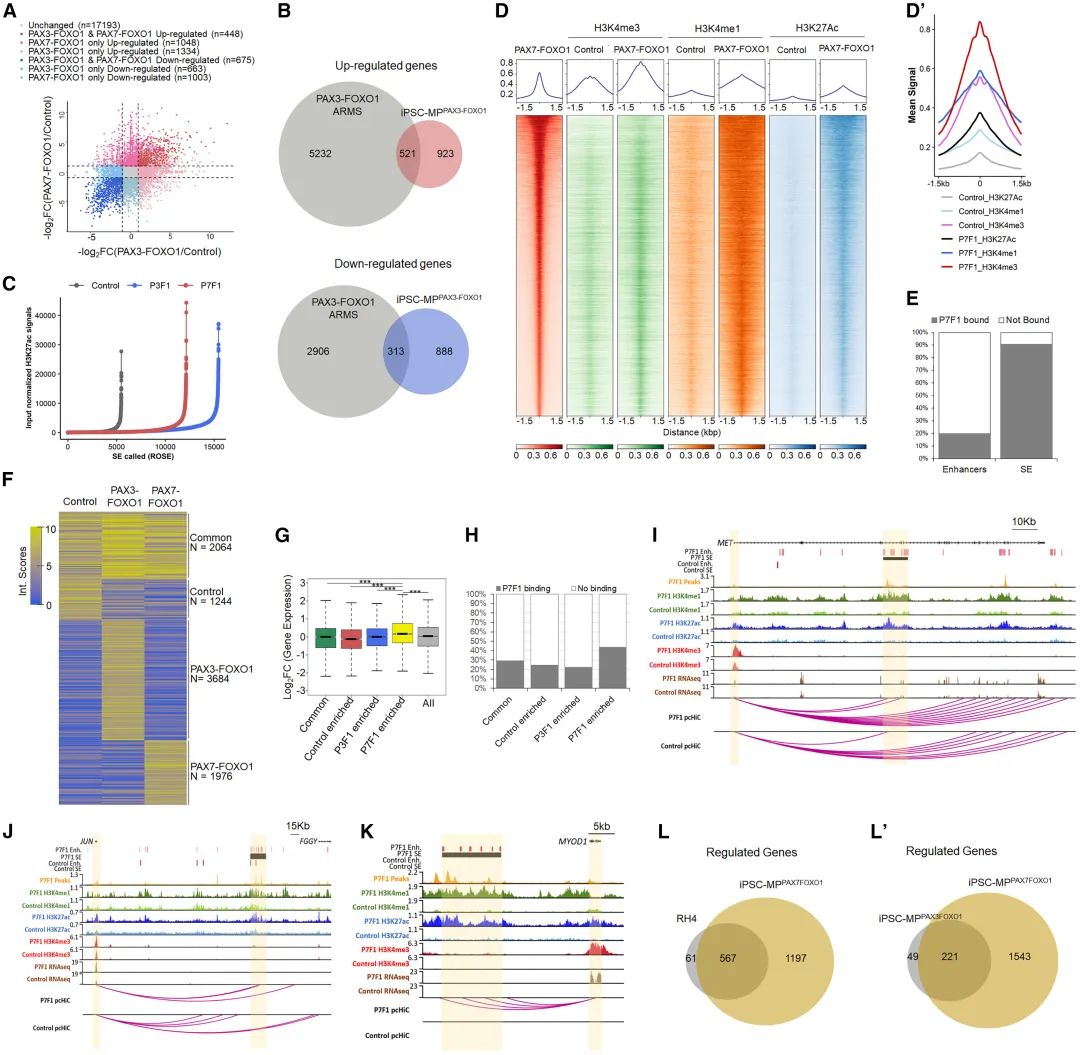
图2 肺泡型横纹肌瘤iPSC细胞模型基因组和表观基因组特征
在iPSC模型中,PAX3/7融合蛋白可以染色质区室转换(沉默B和激活A)和拓扑相关结构域TADs边界变化(图3A),尤其在MYCN基因位点处,在表达PAX7融合蛋白的细胞中,MYCN启动子下游约200kb处存在超级增强子,并招募PAX7-FOXO1通过长距离的启动子和增强子相互作用增加MYCN表达(图3B-C),与其他癌症相比,MYCN在ARMS中的表达更高,并且依赖得分仅高于神经母细胞瘤,说明MYCN在ARMS存活和进展起重要作用(图3D-E)。进一步,CRISPRi沉默该增强子可降低MYCN表达,削弱肺泡状横纹肌肉瘤细胞的增殖能力及体内成瘤性,证实了MYCN在ARMS发生中的重要作用(图3F-M),也验证了iPSC模型中PAX融合蛋白通过染色质重塑组装超级增强子上调基因表达的机制。
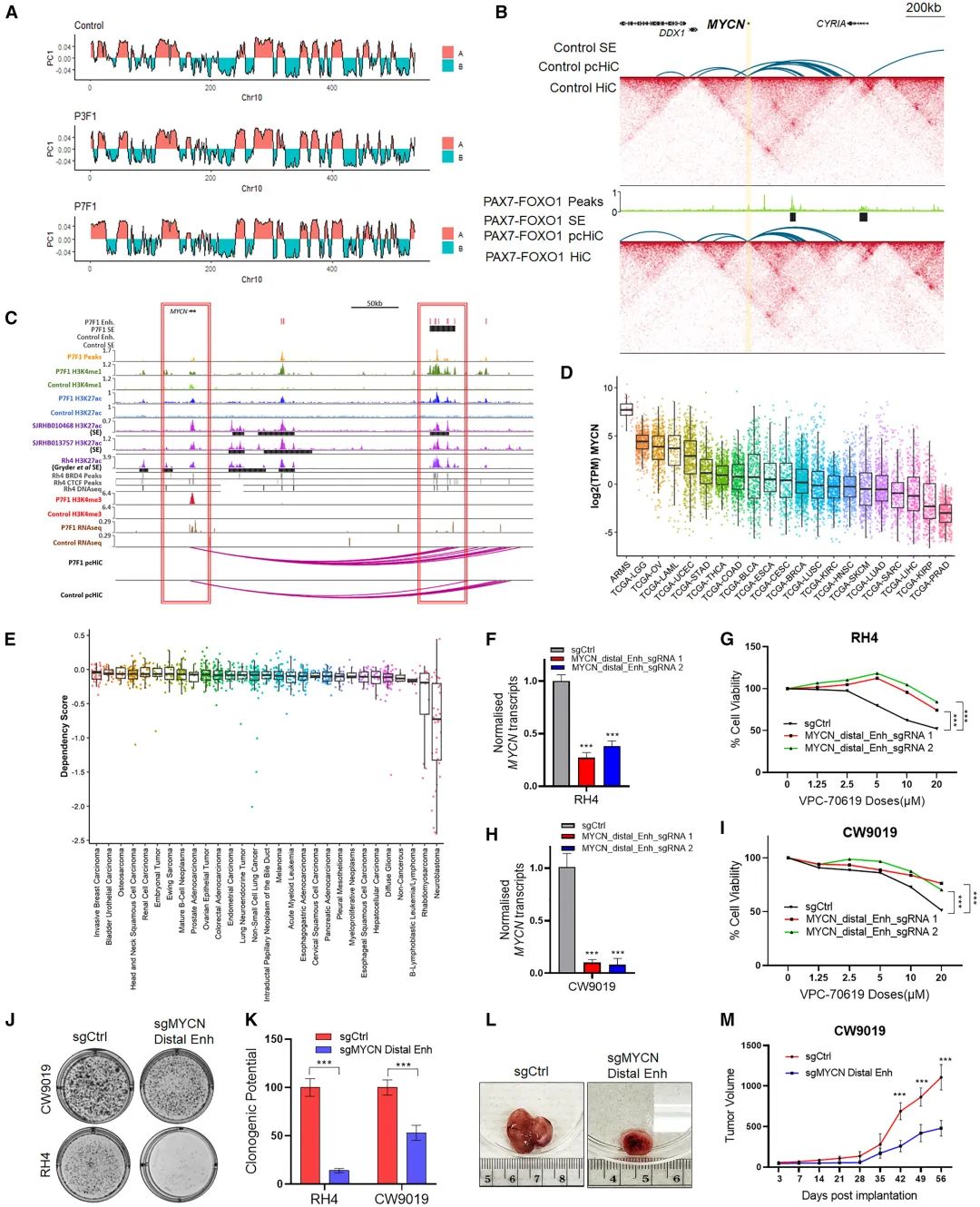
图3 鉴定MYCN下游的远端超级增强子增加MYCN表达促进肿瘤进展
为了寻找ARMS中可成药靶点,融合阳性及iPSC模型细胞线粒体相关基因表达失调,包括线粒体代谢的主要调节因子PPARGC1A及氧化磷酸化OXPHOS调控因子表达上调,PAX3-FOXO1与PPARGC1A增强子结合进而促进其表达,融合蛋白阳性细胞表现出更高的线粒体膜电位、质量和数量、基础及最大氧气消耗速率增加,说明其线粒体形态和功能增强,表明融合蛋白可通过PPARGC1A促进肿瘤细胞线粒体氧化磷酸化(图4)。
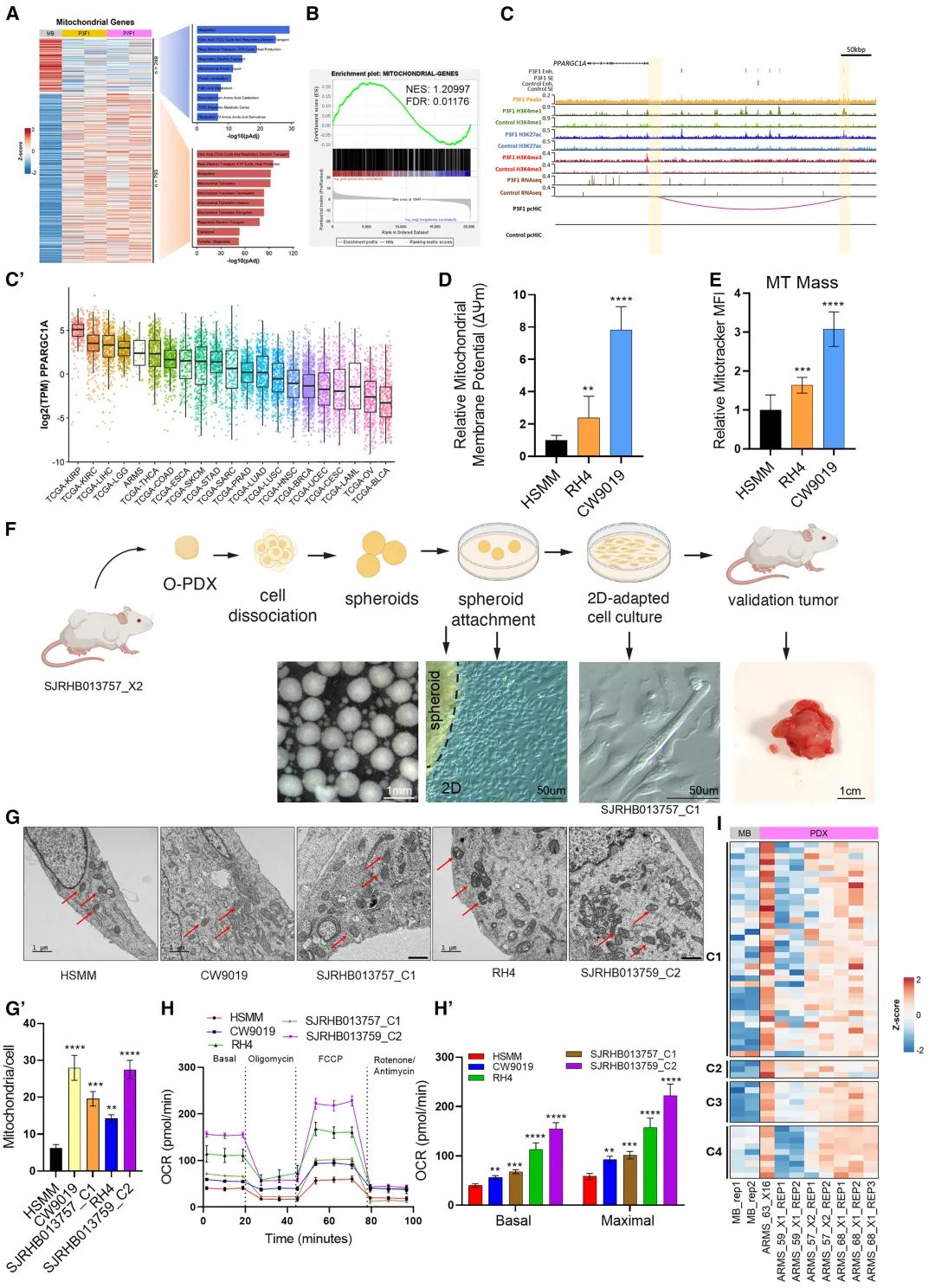
图4 ARMS中的线粒体变化及代谢特征分析
分析发现线粒体转运tRNA在ARMS患者及iPSC模型中上调表达,进一步研究发现tRNA甲基转移酶TRMT5为PAX3/7融合蛋白共同的转录靶点,可激活TRMT5表达;沉默下调TRMT5表达后,可显著抑制癌细胞的克隆形成能力,并在小鼠模型中延缓肿瘤生长,并且导致线粒体DNA含量和质量下降、基础及最大氧气消耗速率显著降低,氧化磷酸化受损,表明融合蛋白可通过激活TRMT5增强支持和维持ARMS肿瘤所需的线粒体氧化磷酸化(图5)。
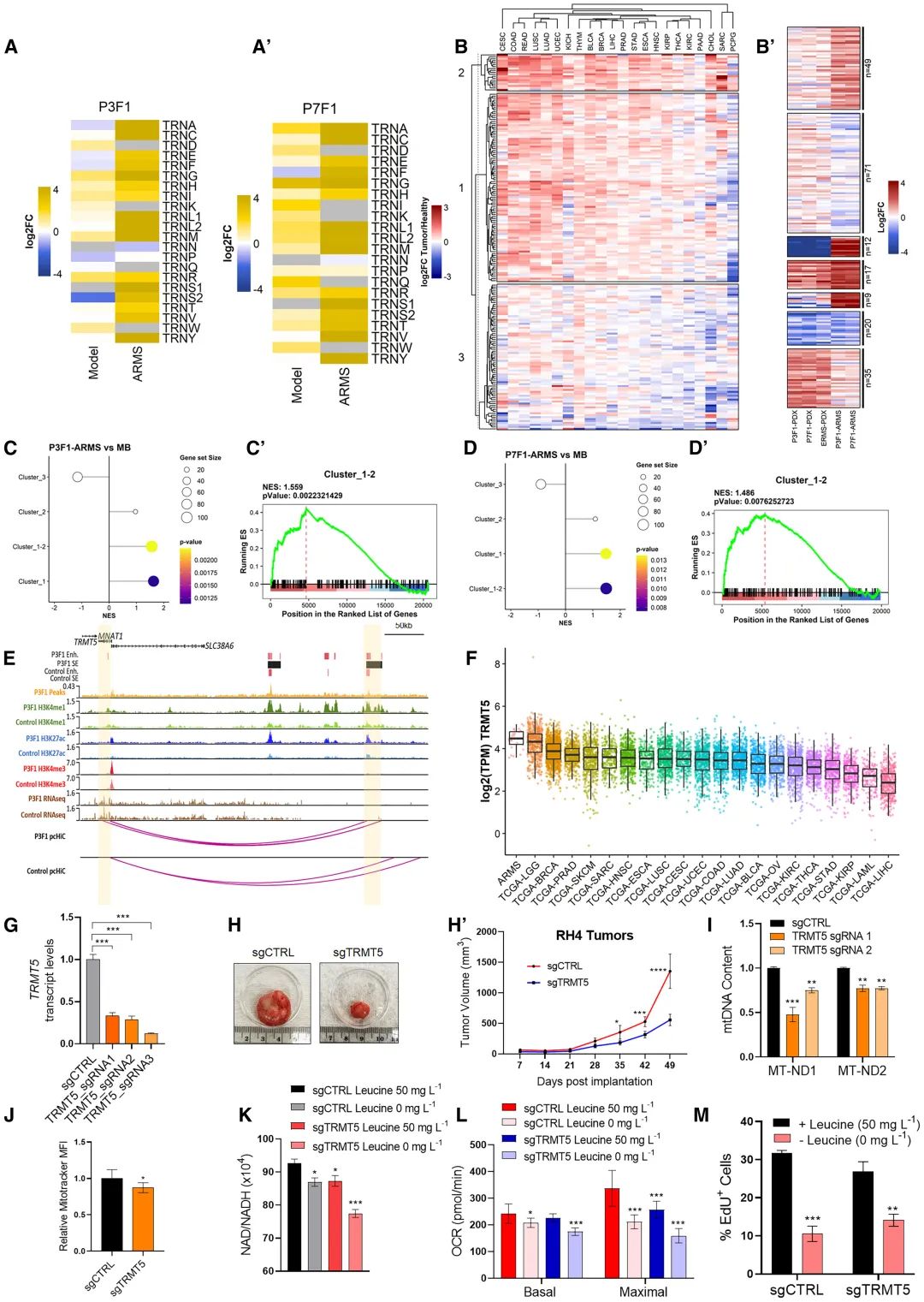
图5 TRMT5在ARMS发展中的关键作用
分析发现ARMS细胞优先表达线粒体编码基因且偏好特定亮氨酸密码子,并且亮氨酸缺乏导致细胞克隆形成和增殖能力下降更明显,体内实验也证实限制亮氨酸可减轻肿瘤负担、改善生存,肿瘤细胞增殖减少并非死亡,说明PAX融合蛋白阳性ARMS肿瘤细胞对亮氨酸敏感性增加(图6)。
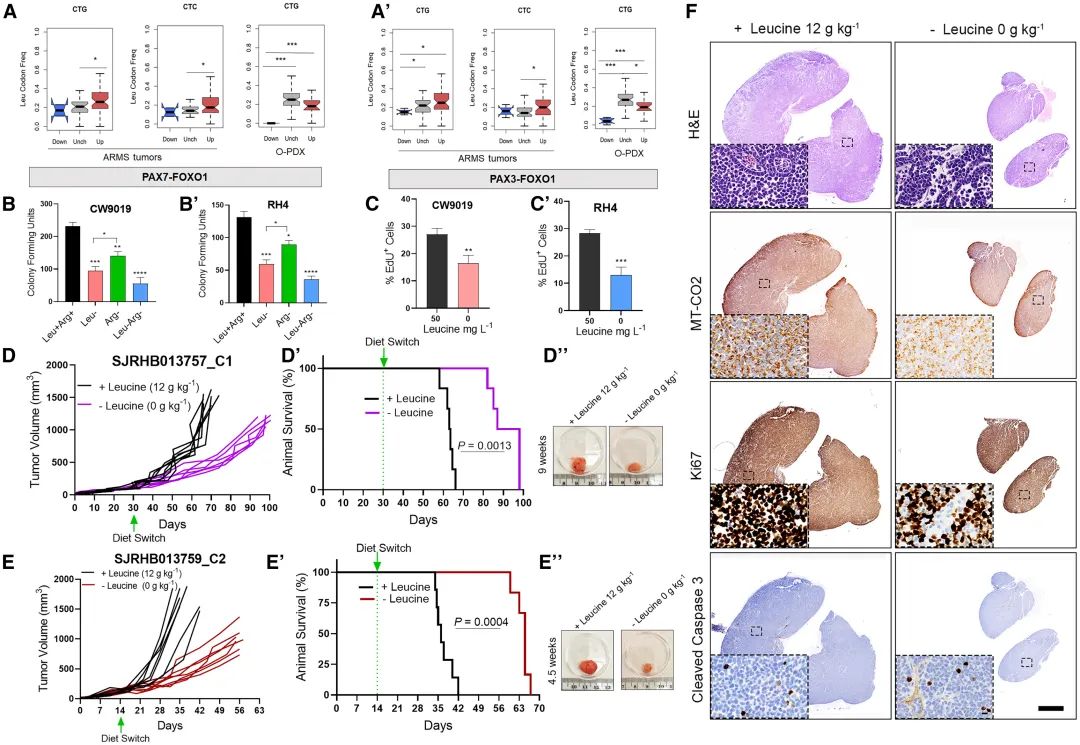
图6 限制亮氨酸摄入可延缓肺泡状横纹肌肉瘤肿瘤进展
分析发现成纤维细胞生长因子受体4(FGFR4)也是PAX融合蛋白的关键靶标,在RMS中高表达,染色质相互作用图谱分析融合蛋白可增强FGFR4表达。研究者尝试联合使用选择性FGFR4抑制剂roblitinib(ROB)和线粒体翻译抑制剂tigecycline(TIG)治疗ARMS,体外实验显示,联合用药对ARMS肿瘤细胞的增殖和自我更新能力有显著抑制作用。体内实验,使用携带不同ARMS肿瘤的O-PDX小鼠模型,结果表明,对于PAX3/7融合阴性的O-PDX模型治疗无效;对于PAX3/7融合阳性的O-PDX模型,TIG+ROB联合治疗显著提高了小鼠的生存率,如SJRHB013757_X2(PAX7-FOXO1)模型中,联合治疗组平均生存期为70.8天,而TIG单药组为44.5天(图7)。
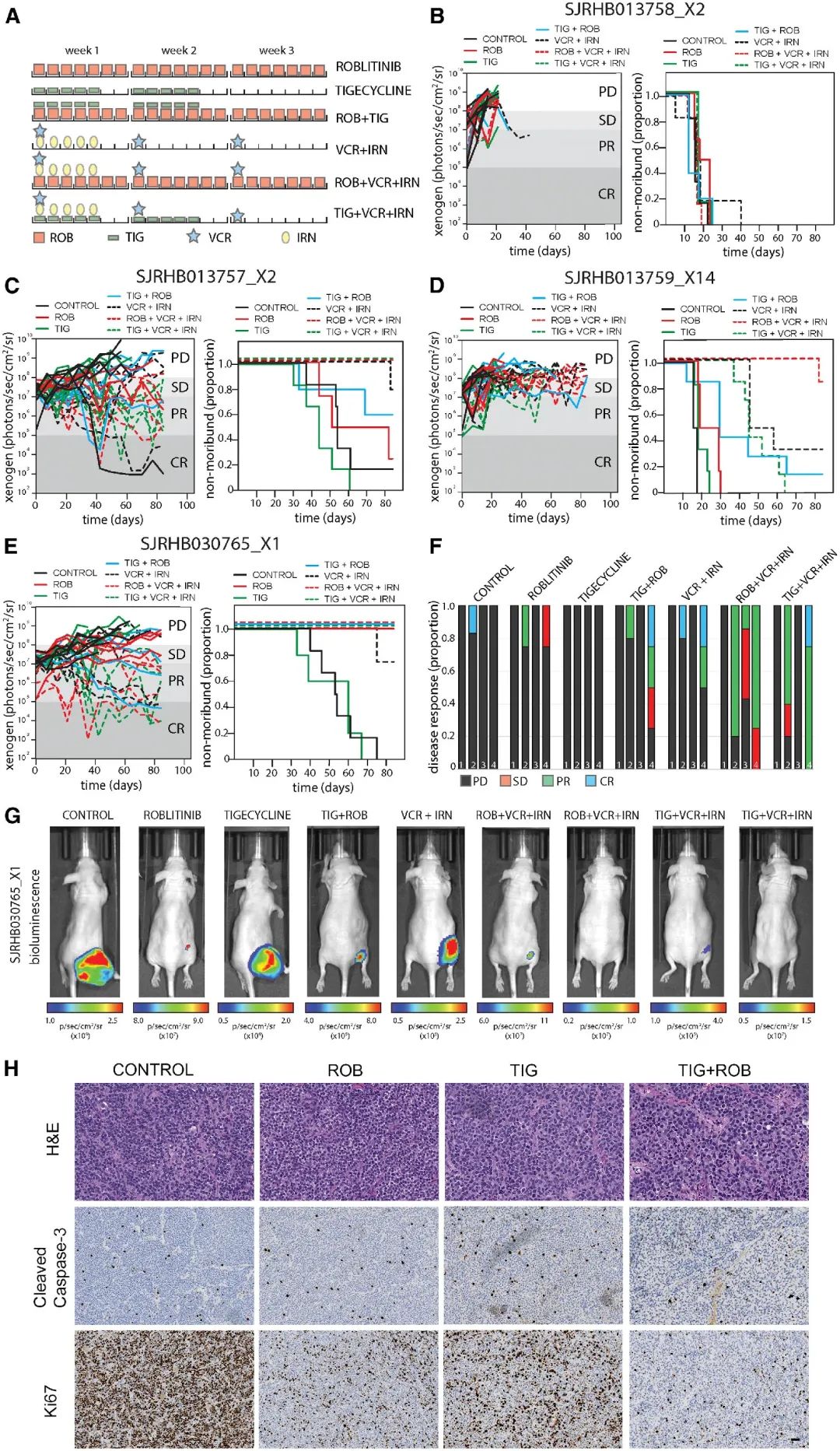
图7 ROB和TIG联合使用在小鼠RMS O-PDX模型疗效
总之,本研究通过工程化iPSC构建了ARMS肿瘤模型,解析了PAX3/7-FOXO1融合蛋白重塑染色质图谱及转录调控机制,激活超级增强子增强关键致癌基因和线粒体代谢相关基因的表达。融合蛋白驱动MYCN、FGFR4、PPARGC1A、TRMT5以及亮氨酸tRNA表达上调,增强线粒体氧化磷酸化,从而促进肿瘤生长。沉默关键靶点和限制亮氨酸摄入均可削弱ARMS细胞代谢能力,延缓肿瘤进展。联合使用线粒体翻译抑制剂TIG与FGFR4抑制剂ROB在小鼠模型中展现协同疗效,为高危肺泡状横纹肌肉瘤提供潜在治疗策略。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)