首页 > 医疗资讯/ 正文
线粒体功能障碍在阿尔茨海默病(AD)的神经炎症和认知障碍中起重要作用。
2024年12月23日,空军军医大学Zhou Siyuan、Cheng Ying、杨志福共同通讯在 Small 在线发表题为 “The Mitochondria-Targeted Micelle Inhibits Alzheimer's Disease Progression by Alleviating Neuronal Mitochondrial Dysfunction and Neuroinflammation” 的研究论文。该研究设计了一种线粒体靶向胶束CsA-TK-SS-31(CTS),通过同时减轻小胶质细胞和神经元中的线粒体功能障碍来阻断AD进展。
线粒体靶向肽SS-31驱动环孢菌素A(CsA)穿透血脑屏障(BBB),并将CsA递送到5×FAD小鼠大脑小胶质细胞和神经元的线粒体中。在小胶质细胞和神经元受损线粒体中高水平活性氧(ROS)环境中,CsA和SS-31之间的接头(酮缩硫醇,TK)断裂,释放CsA和SS-31的同时消耗微环境中的ROS。释放的CsA和SS-31协同恢复线粒体膜电位和线粒体分裂与融合之间的平衡,从而保护神经元免受凋亡并减少5×FAD小鼠大脑中小胶质细胞的激活。最终,5×FAD小鼠的神经炎症和认知障碍得到改善。该研究通过缓解线粒体功能障碍来减少神经炎症,恢复神经元功能,为AD提供了一种协同治疗策略。

阿尔茨海默病(AD)是一种以记忆缺陷和认知障碍为特征的神经退行性疾病,是老年痴呆症患者死亡的主要原因。目前,全球约有5500万人患有痴呆,预计到2050年,痴呆患者人数将达到1.5亿,其中约60-70%的人将患有AD。AD的主要病理特征是存在淀粉样蛋白斑块和神经原纤维缠结。目前,美国食品药品监督管理局(FDA)已批准三种靶向Aβ的单克隆抗体aducanumab、lecanemab和donanemab用于AD治疗。
在AD患者中,Aβ在脑内形成不溶性寡聚体、纤维甚至斑块, Aβ的过度沉积引起双重神经毒性。一方面,Aβ沉积诱导小胶质细胞极化为促炎性M1表型(M1小胶质细胞)。M1小胶质细胞不断分泌炎性细胞因子,产生大量活性氧,导致神经元损伤。此外,M1小胶质细胞在Aβ沉积周围募集更多的小胶质细胞形成神经炎性斑块,形成慢性、不受控的炎症。另一方面,Aβ进入神经元后,部分积聚在线粒体膜上,导致线粒体呼吸功能障碍,破坏氧化磷酸化呼吸链,产生大量ROS和线粒体超氧化物,触发线粒体通透性转换孔(mPTP)过度开放。mPTP的过度开放导致线粒体膜电位(MMP)降低、线粒体超微结构破坏、ATP分解和细胞色素c释放。更重要的是,细胞色素c的释放导致神经元凋亡,加剧神经退行性疾病的进展。因此,神经元线粒体功能障碍和小胶质细胞极化引起的氧化应激和神经炎症越来越受到重视。
已经报道了几种通过调节线粒体功能障碍来治疗AD的递送系统,如使用Beclin-1(一种自噬肽)和载有烟酰胺腺嘌呤二核苷酸的血管生成素-2修饰的聚(l-丙交酯-共乙交酯)-硫代醛-聚乙二醇(PLGA-TK-PEG)纳米颗粒来调节线粒体自噬,纠正小胶质细胞中的线粒体功能障碍。此外,含有白藜芦醇和硒的纳米制剂可以减轻神经元中的氧化应激损伤和线粒体功能障碍。最后,(3-羧丙基)三苯基-鏻溴化物(TPP,一种线粒体靶向剂)已被用于修饰Cu2-xSe纳米酶,通过减轻氧化应激促进神经保护,并调节小胶质细胞极化重塑炎症微环境。通过调节线粒体功能障碍来抑制小胶质细胞活化、减少神经元氧化应激和预防神经元凋亡是治疗AD的有效策略。
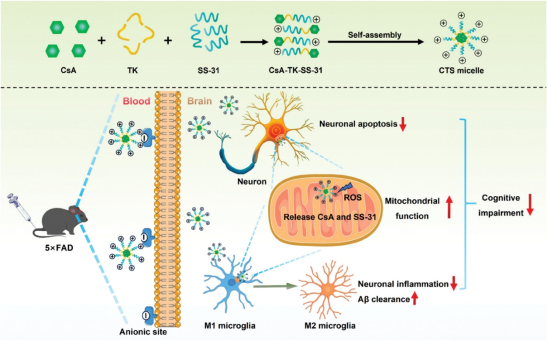
图1 CsA-TK-SS-31胶束的制备及其治疗AD机制示意图(摘自Small)
临床研究表明,长期接受环孢菌素A(CsA)治疗的器官移植患者的AD发病率明显低于普通人群。CsA能够与亲环蛋白D(CYPD)结合,抑制线粒体膜中mPTP的过度开放。CsA还通过减少线粒体衍生的ROS、超氧化物和细胞色素c的释放而发挥抗凋亡作用,不仅有效保护神经元免受Aβ诱导的损伤,促进受损突触的生长,还可以阻断小胶质细胞的激活。因此,环孢杆菌具有治疗AD的潜力。然而,尽管CsA具有疗效,但其水溶性较差,且缺乏线粒体靶向能力。然而,如何将CsA递送到大脑内受损神经元和活化小胶质细胞的线粒体,对于其在AD治疗中的应用至关重要。
在生理条件下,由于大量糖蛋白羧基的分布,脑毛细血管的管腔表面带负电。SS-31是一种阳离子水溶性肽,通过静电相互作用与脑血管内皮细胞表面的阴离子位点具有很强的亲和力。此外,SS-31作为一种短细胞穿透肽,不仅可以自行进入细胞,还可以携带其他大分子物质进入细胞。因此,SS-31可以通过吸附介导的转胞吞作用和无损伤细胞跨膜作用穿过血脑屏障(BBB)。SS-31肽对线粒体内膜的高靶向特异性主要是由于两种类型的相互作用。一方面,SS-31带正电的胍基和氨基通过静电相互作用与线粒体中心磷脂头部基团上带负电的氧阴离子相互作用。另一方面,SS-31内的亲脂性芳香族部分与线粒体中心磷脂的脂肪侧链之间发生疏水相互作用。此外,SS-31可以直接清除ROS并抑制线粒体心磷脂氧化,从而减少线粒体ROS的产生。总之,SS-31具备靶向大脑内受损细胞中线粒体的能力,并显示出神经元保护免受氧化应激的潜力。
AD患者大脑中ROS水平显著升高,约90%的细胞内ROS由线粒体产生。据报道,硫酮缩醇(TK)可以在ROS的作用下特异性地断裂。该研究通过将亲脂性CsA和亲水性SS-31通过TK偶联,合成CsA-TK-SS-31(CTS),并将CTS在水中自组装成胶束。SS-31驱动CsA穿过BBB,进一步靶向受损神经元和活化小胶质细胞的线粒体,确保CTS纳米胶束仅在具有高水平ROS的线粒体中释放CsA。TK的断裂消耗ROS,线粒体中释放的CsA和SS-31在改善受损神经元和活化小胶质细胞的线粒体功能方面发挥了协同作用。最后,CTS胶束抑制受损神经元的凋亡,促进M1小胶质细胞极化为M2小胶质细胞,进而改善神经元的炎症微环境,提高5×FAD小鼠的记忆力和认知能力。
参考消息:
https://onlinelibrary.wiley.com/doi/full/10.1002/smll.202408581?saml_referrer
- 上一篇:江苏如东:“法”剑出鞘 筑牢群众健康“防火墙”
- 下一篇:户外运动要系牢“安全带”
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)